索拉非尼联合立体定向精确放疗治疗肝癌肺转移疗效观察
尹小兰, 许 青
同济大学医学院,上海 200092
·论 著·
索拉非尼联合立体定向精确放疗治疗肝癌肺转移疗效观察
尹小兰, 许 青*
同济大学医学院,上海 200092
目的: 观察靶向药物索拉非尼(sorafenib)联合立体定向精确放射治疗(stereotactic body radiation therapy,SBRT)治疗原发性肝癌(HCC)肺转移的临床疗效和不良反应,评价联合治疗的安全性。方法: 将2011年6月至2013年6月收治的60例HCC伴肺转移患者分2组,联合治疗组30例,行索拉非尼联合SBRT;对照组30例,仅行SBRT。比较两组患者治疗结束3个月的短期疗效及不良反应以及长期疗效(1年、2年生存率及中位生存期)。结果: 治疗后3个月随访,联合治疗组总有效率80.2%,显著高于对照组(73.3%)(P=0.045);联合治疗组中位疾病进展时间为8.5个月;对照组为4.6个月,具有统计学差异(P=0.02);联合治疗组1年、2年生存率分别为53.3%(16/30)、30%(9/30);对照组1年、2年生存率分别为46.7%(14/30)、20%(6/30);联合治疗组中位生存时间为13.2个月,对照组为11.8个月,两组差异有统计学意义(P=0.019);两组患者毒性反应均可耐受,无严重不良反应。结论: 索拉非尼联合SBRT与单纯SBRT组相比,可显著提高HCC肺转移的疾病进展时间和中位生存期,且无明显严重不良反应的发生。
立体定向放射治疗;索拉非尼;原发性肝癌;肺转移;联合治疗
原发性肝细胞肝癌(hepatocellular carcinoma,HCC)是全球最常见的恶性肿瘤之一,严重威胁着人们的健康。有资料[1-3]显示,全球大约每年有50万人罹患HCC。其中我国的新发病例大约占一半以上,每年约有11万人死亡,占全世界HCC死亡人数的45%[4-5]。可见我国HCC的高发趋势已十分严峻,应引起足够重视。目前,随着外科和影像技术的发展,HCC的预后有了一定程度的改善,但其治疗疗效仍不尽如人意。外科手术治疗是HCC患者的首选有效的治疗方法,但由于HCC的起病较为隐匿,早期症状通常不典型,至发现时往往已为中晚期,因此超过70%的HCC患者伴有门静脉高压或者多中心病变的疾病进展表现,大部分患者丧失了最佳手术治疗时机[6-7]。而高复发率和过早远处转移是治疗HCC的一大困境[6-7]。HCC肝外转移最常见的部位是肺。目前,对于HCC伴肝外转移的患者,主要的治疗方式有手术、动脉栓塞化疗、化疗、放疗、靶向治疗、免疫治疗及中医中药治疗等[8-9]。近年来,多项研究[10-12]显示,立体定向精确放疗(stereotactic body radiation therapy,SBRT)治疗原发性HCC伴或不伴肝外转移有较好的疗效和较小的不良反应,是失去手术机会原发性HCC及HCC伴肝外转移的有效治疗手段之一。靶向药物索拉非尼是目前为止唯一被证明能延长HCC患者生存期的系统性治疗药[13]。
为探讨HCC伴肺转移患者的治疗,本研究选取2011年6月份至2013年6月解放军第411医院放疗科收治的60例患者为研究对象,并分成2组。一组患者行索拉非尼联合体部SBRT,一组患者单独行SBRT。收集治疗前后的临床及影像学资料并进行分析,比较两组患者治疗结束3个月的疗效效果及不良反应、长期疗效(1年、2年生存率及中位生存期)以及随访情况。
1 资料与方法
1.1 临床资料 自2011年6月1日至2013年6月30日,选取符合条件的HCC患者60例为研究对象,其中男性54例、女性6例;年龄25~75岁,中位年龄55岁;病理证实46例、临床诊断14例。所有的患者诊断均符合2001年9月份广州全国肝癌学术会议制定的《原发性肝癌的临床诊断与分期标准》,且均证实为HCC肺转移(无其他部位转移)(巴塞罗那分期均属BCLC C期)。其中经上腹部MRI增强等影像学检查证实肝脏无病灶或病灶控制良好35例,肝脏病灶未控25例。肺转移的确诊主要依据CT或PET-CT,其主要表现为肺野内的占位阴影,边缘清晰,分布两肺或局部限于一侧肺野或肺叶,可伴或不伴临床症状。按患者意愿分联合治疗组和对照组,每组30例,其中联合治疗组行索拉非尼联合SBRT(伽玛刀);对照组仅行SBRT。两组HCC患者的资料均衡性比较如表1所示。两组的性别、年龄、治疗前体力活动状态(performance status,PS)评分、Child-Pugh分级、甲胎蛋白(AFP)水平、肺部结节大小、个数、白细胞计数WBC、肝脏病灶情况等方面差异均无统计学意义(均P>0.05),具有可比性。
1.2 治疗方法
1.2.1 对照组 对照组患者采用SBRT,即伽玛刀治疗。通过OUR-QGD型体部立体定向精确放射治疗系统对肝脏未控病灶和肺转移病灶进行治疗,根据患者的病灶部位选择合适体位仰卧或俯卧于CT定位模拟架的三维立体定向体架中的负压袋内,固定好体位,抽至真空固定躯体,仔细核对定位架数据,以3~5 mm层厚在CT下对病灶进行完整扫描,扫描结束后记录N型尺数据,再次仔细核对定位尺数据及患者体表标记点的X、Y、Z坐标值,并详细纪录每一个数据(精确到毫米),将CT下获取的影像学图像资料和坐标值详细数据输入TPS治疗计划系统进行计划制定及图像重建,勾画肿瘤临床靶区(clinical target volume,CTV)及计划靶区(planning target volume,PTV),在冠状面上对采用单靶点或多靶点进行拟合(尽可能避免多靶点数和大号准直器),并用50%~60%处方等剂量曲线包绕PTV,用60%~80%剂量曲线包裹95%以上的,以50%或60%剂量线作为处方剂量曲线。根据病灶的大小、部位、周围危及器官、组织放射敏感性等多种因素选择合适的治疗单次剂量、总剂量、分割次数等。肿瘤临床靶区为肺转移病灶和(或)肝内病灶。单次剂量300~550 cGy, 1次/d,治疗2次休息1次或隔日治疗,治疗总次数8~13次,累计总剂量3 600~4 500 cGy。
1.2.2 联合治疗组 联合治疗组行索拉非尼联合SBRT。SBRT的方法与对照组一致。索拉非尼治疗:30例患者在SBRT治疗前1周或同时开始口服甲苯磺酸索拉非尼(多吉美),400 mg/次,2次/d,间隔12 h,进食1 h前或进食2 h后服药;连续不间断用药至少8周,如出现Ⅲ期或Ⅳ期限制性不良反应,酌情剂量减半,必要时予以停药。
两组患者均于放疗前、放疗结束后检查血常规、生化常规、AFP等,并于放疗结束后每3个月复查胸部CT增强及(或)上腹部磁共振增强,每6个月复查头磁共振增强及骨扫描,详细纪录肿瘤大小及肿瘤进展情况变化。
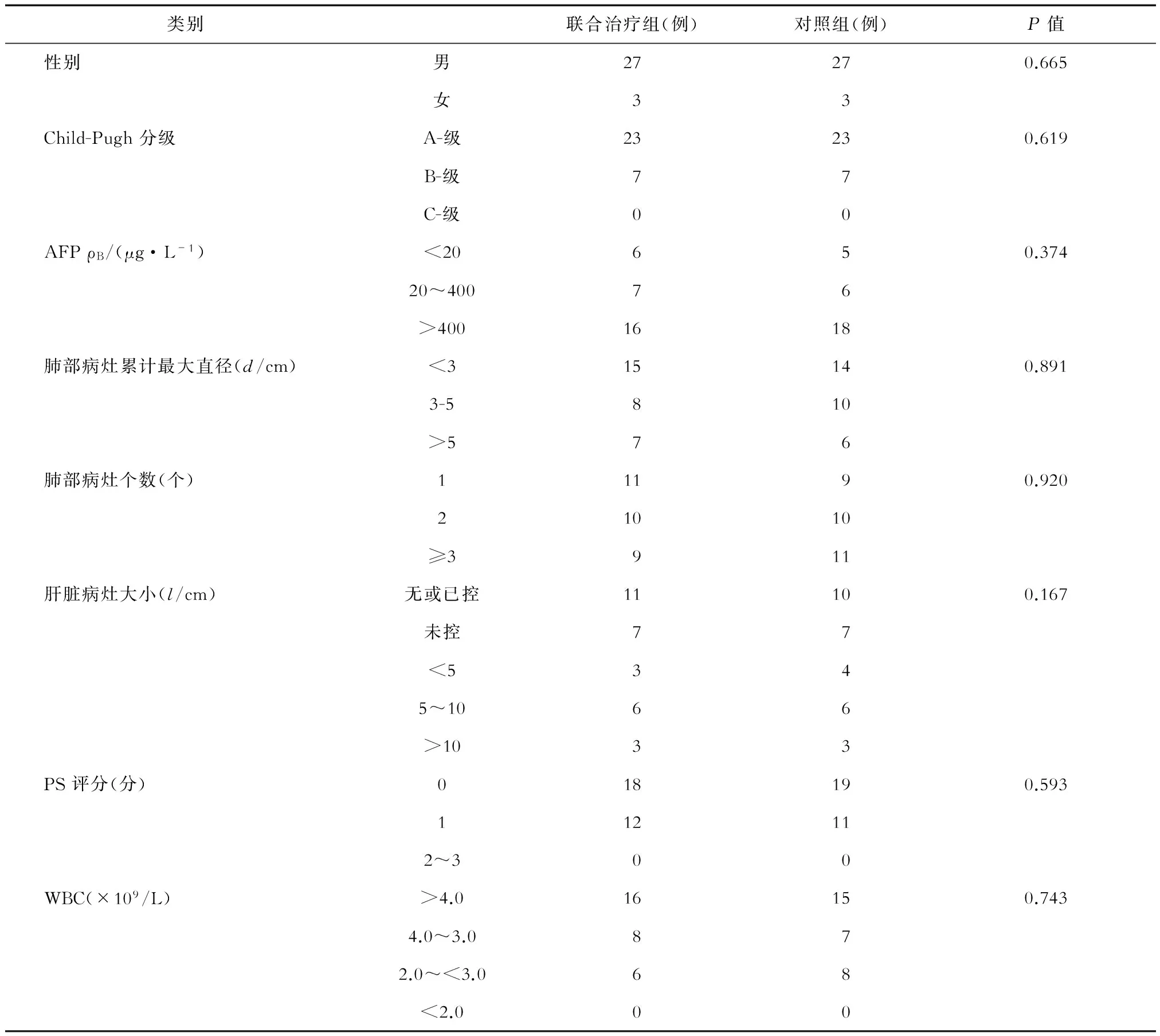
表1 两组患者的基线资料比较
1.3 观察指标
1.3.1 治疗结束3个月后进行疗效及不良反应评估 (1)参照RECIST1.1标准进行疗效评估。完全缓解(CR)为所有的病灶均消失并维持4周,无新病灶;部分缓解(PR)为病灶最长直径总和减少≥30%,并维持4周;疾病稳定(SD)为病灶缩小总直径没有达到部分缓解或直径增加未达疾病进展;疾病进展(PD)为病灶直径大小总和增加≥20%或出现新发病灶。根据患者的3个月复查的影像学结果,分别参考RECIST标准进行肝脏及肺部病灶疗效评价,以CR+PR计算总有效率。(2)SBRT及索拉非尼的不良反应评估。参考放射治疗肿瘤协作组制定的急性放射损伤分级标准评估急性放疗不良反应,早期反应为自放射治疗开始日起至90 d内出现的放射反应,晚期放射反应为放射治疗后90 d后出现的放射反应。骨髓抑制根据WHO制定的标准分0~4级。药物不良反应参考美国国家癌症研究所通用不良反应评定标准第3版(NCI-CTCAE version 3.0),分级0~4级。
1.3.2 长期疗效评估 首次治疗后每3个月复查上腹部CT增强或上腹部MRI增强和胸部增强CT,或有病情变化时复查。血常规、生化常规、AFP治疗结束后及每月复查1次,收集患者随访数据,跟踪患者的生存状况,直至死亡或失访,计算两组患者的疾病进展时间、总生存期并比较其差异,统计两组病例的1年、2年生存率及中位生存期,并评估其差异。
1.4 随访 随访自SBRT结束开始,截至2015年6月30日。随访率为96.7%(58/60),失访2例,两组各失访1例,失访人数均按死亡人数计算。

2 结 果
2.1 两组患者的近期疗效评估 联合治疗组患者的治疗有效率为80%(24/30);单纯放疗组为73.3%(22/30),差异有统计学意义(P=0.045)。
2.2 两组患者不良反应的比较 治疗期间,患者均出现不同程度的疲乏、食欲下降、恶心等不良反应,经对症处理后,治疗结束后2~3周后症状基本能缓解。治疗前患者的WBC计数为(4.79±0.24)×109/L,治疗后为(4.32±0.22)×109/L,差异有统计学意义(P=0.015 8)。其中29例患者存在脾功能亢进,与无脾功能的患者相比,治疗前后患者粒细胞的变化差异无统计学意义(P>0.05)。
联合治疗组患者中Ⅲ级骨髓抑制1例,无Ⅲ级以上骨髓抑制发生;而对照组无Ⅲ级及以上的骨髓抑制发生。联合治疗组患者Ⅰ~Ⅱ级放射性肺炎的发生率为13.3%(4/30);对照组Ⅰ~Ⅱ级放射性肺炎的发生率为10%(3/30),无Ⅲ级以上的放射性肺炎发生,两组患者的差异无统计学意义。联合治疗组出现Ⅰ~Ⅱ级手足综合征16例(53.3%)、高血压3例(10%)、肝功能异常2例(6.7%)、腹泻Ⅰ~Ⅱ级13例(43.3%),发生Ⅲ级不良反应4例,分别为2例手足综合征和2例腹泻。患者予以药物减半及对症处理后症状缓解,无Ⅳ级不良反应。
2.3 两组患者的长期疗效评估 联合治疗组患者疾病进展时间为8.5个月;对照组为4.6个月,差异有统计学意义(P=0.02)。具体情况详见图1。治疗组1年、2年生存率分别为53.3%(16/30)、30%(9/30),中位生存时间为13.2个月;对照组1年、2年生存率分别为46.7%(14/30)、20%(6/30),中位生存时间为11.8个月,差异有统计学意义(P=0.019),详细情况见图2。

图1 两组患者的TTP曲线(P=0.02)
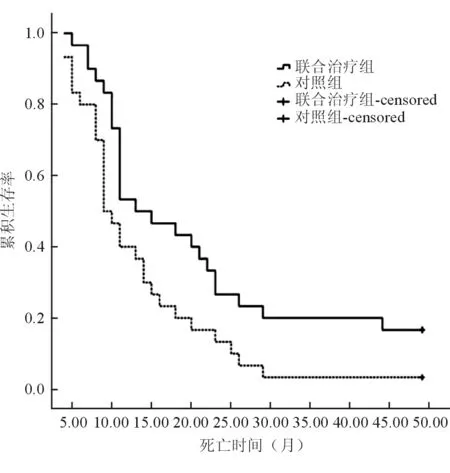
图2 生存曲线对照图(P=0.019)
3 讨 论
原发性HCC是我国常见的恶性肿瘤之一,其相关死亡率仅次于肺癌。每年全球约有74万新发病例,其中一半在中国,HCC占原发性肝癌的绝大部分,达85%~90%[14]。近年来,随着诊疗手段和治疗技术的进步,HCC的局部控制率逐步提高,患者的生存期明显延长。有报道[13, 15]显示,早期HCC患者通过根治性治疗,如手术、射频消融或肝移植等,患者5年生存率可达到40%~70%。然而,2/3的HCC患者确诊时已失去了根治性治疗的机会。而接受过根治性手术治疗的患者,每年将面临15%~20%的复发率,5年复发率累计可达80%~90%。且随着生存期的延长,原发性HCC伴肝外转移的发生率越来越高。据资料[16]统计,约20%的HCC患者会出现肝外转移。而HCC患者的尸体检查显示,肝外转移发生率可达40%~73%。
肺是HCC最常见的转移部位,占肝外转移的39.5%~53.8%[17],HCC肺转移主要好发于伴癌栓患者,约53%的下腔静脉癌栓患者和18%的门静脉癌栓患者会出现肺转移[18]。HCC肺转移的治疗手段很多,目前尚无标准治疗方法,主要治疗手段有手术、介入、微波或射频消融、放疗及分子靶向治疗和系统化疗等。有研究[19]认为,肺转移的成功治疗可以明显延长HCC患者的生存时间。对原发病灶控制,无肺外其他转移部位转移的患者行手术切除肺转移瘤,2年的生存率可达43.5%~53.9%[20],但手术切除仅限于肝内病灶完全控制,转移局限于同侧肺、且病灶较少的患者。对于复发伴转移患者,手术并发症发生率较高(6.2%~68.2%),且手术风险较大[14]。HCC肺转移患者的介入诊疗主要通过肺动脉灌注化疗药物或支气管动脉灌注化疗(BAI)及化疗栓塞(BAE)等。有研究[21-22]显示,接受介入诊疗,患者生存期较不治者延长。但是单纯TACE治疗存在供血动脉栓塞不完全,残存的肿瘤细胞因乏氧、乏营养等导致VEGF高表达,从而使肿瘤侵袭、转移能力提高,反而成为肿瘤复发转移的根源[23]。微波或射频消融作为微创手术治疗,近年来也有不少用于转移性肺癌的报道,但仅适合于转移病灶少、最好肿瘤<3 cm的病变[24],且射频治疗有癌组织残留可能,局部复发率高,存在气胸、脓肿、皮肤灼伤等多种不良反应。HCC肺转移属于Ⅳ期,原则上应该行全身治疗,但是HCC没有疗效肯定的化疗方案。多中心随机对照试验[25]显示,FOLFOX4组的缓解率和疾病控制率显著高于多柔比星组(RR:8.6%vs1.4% 6;DCR:47.1%vs26.6%),但总生存并不理想(FOLFOX4组中位生存期6.4个月vs多柔比星5.0个月,P=0.07)。He等[26]对32例原发性HCC合并有肝外转移的患者进行卡培他滨和奥沙利铂化疗的前瞻性研究显示,疾病控制率为62.5%。中位OS时间为9.2个月(95%CI:6.5~17.8),1年生存率为43.6%(95%CI:29.0~66.0),且病例量较少,总体疗效如何,有待于进一步研究。
放射治疗是HCC的主要治疗方式之一。传统放疗治疗HCC效果欠佳。SBRT是近年来发展起来的精准放射治疗手段之一,采用旋转聚焦照射的原理,具有更好的适形性和更高的局部剂量,同时减少了靶区周围组织受照射剂量,提高了疗效,并降低并发症的发生率[23],其疗效得到越来越多的肯定。有学者[24]报道的伽玛刀治疗I/II期原发性HCC患者总有效率为80.8%,1年、2年的总体生存率分别为82.7%、75.0%,其他来自美国和日本的报道[29-30]也得到类似令人鼓舞的结果。SBRT治疗晚期HCC患者的疗效显著,一个来自韩国的报道[31]显示,SBRT治疗45例HCC晚期患者,中位生存时间达14个月,1年和3年总生存率分别达到了52%和21%。Jang等[32]报道的放射治疗治疗HCC伴肺、腹膜后淋巴结转移患者,1年生存率为50.1%。放疗能让进展期HCC患者生存获益。但放射治疗作为一种局部治疗存在一定的局限性,同时受照射区域外有播散及区域转移的风险,提高放射剂量和增大放疗面积又可能导致放射性损伤发生。故在精准治疗的时代,探讨并开展多学科综合治疗具有迫切的现实意义。
分子靶向药物索拉非尼是一种口服多激酶抑制剂,一方面通过靶向作用于RAF/MEK/ERK信号通道中RAF激酶阻断肿瘤细胞增殖、抑制凋亡,同时作用于VEGFR-2、VEGFR-3和PDGFR-B酪氨酸激酶而发挥血管生成作用[33],是晚期HCC患者(BCLC C期)标准一线治疗药物,也是目前唯一被证实可让生存获益的全身性治疗方式。但是索拉非尼的III期临床实验[34]显示,与安慰剂相比,索拉非尼给晚期HCC患者带来的实际生存获益时间仅为2~3个月。
本研究通过靶向药物索拉非尼联合SBRT和单纯SBRT治疗HCC肺转移患者显示,联合组治疗后短期总有效率为80.2%,高于对照组(73.3%),短期疗效显著。联合治疗组中位疾病进展时间为8.5个月;对照组为4.6个月,具有统计学差异(P=0.02);治疗组1年、2年生存率分别为53.3%(16/30)、30%(9/30),中位生存时间为13.2个月;对照组1年、2年生存率分别为46.7%(14/30)、20%(6/30);中位生存时间为11.8个月,差异有统计学意义(P=0.02),联合治疗组效果优于单纯治疗组,与国际上相关报道[35]的HCC肺转移综合治疗结果一致。索拉非尼能够协同细胞毒性,增加细胞凋亡的作用;同时,在放疗的基础上,索拉非尼能进一步激活RAS-RAF-MAPK和VEGFR信号通路,使异常血管正常化,改善局部氧供,促进细胞周期同步化,减少不敏感期细胞数,减少肿瘤细胞的放射抵抗(radio-resistance)而增加放疗敏感性。综合治疗较单一治疗更能让HCC肺转移患者生存获益。
总之,本研究证实,索拉非尼联合SBRT可延长HCC伴肺转移患者的无疾病进展时间和生存时间,且严重不良反应发生率并未明显增加,是针对HCC伴肺转移患者的一种有效的联合治疗方式。但本研究也存在一定的不足,比如样本数量相对较少,因索拉非尼费用较高,本研究治疗选择为非随机,且大部分患者肝脏肿瘤控制良好等。故需要更多中心的随机对照研究加以验证,以便给晚期HCC患者提供更合理有效的治疗选择。
[ 1 ] Bae SH, Kim MS, Cho CK, et al. Feasibility and efficacy of stereotactic ablative radiotherapy for Barcelona Clinic Liver Cancer-C stage hepatocellular carcinoma [J]. J Korean Med Sci, 2013, 28 (2): 213-219.
[ 3 ] Mancuso A, Perricone G. Hepatocellular Carcinoma and Liver Transplantation: State of the Art [J]. J Clin Transl Hepatol, 2014, 2 (3): 176-181.
[ 4 ] Jiang XB, Ke C, Zhang GH, et al. Brain metastases from hepatocellular carcinoma: clinical features and prognostic factors [J]. BMC Cancer, 2012, 12: 49.
[ 5 ] Zhou JY, Zhang L, Li L, et al. High hepatitis B virus load is associated with hepatocellular carcinomas development in Chinese chronic hepatitis B patients: a case control study [J]. Virol J, 2012, 9: 16.
[ 6 ] Chang WT, Kao WY, Chau GY, et al. Hepatic resection can provide long-term survival of patients with non-early-stage hepatocellular carcinoma: extending the indication for resection? [J]. Surgery, 2012, 152 (5): 809-820.
[ 7 ] Samuel D, Colombo M, El-Serag H, et al. Toward optimizing the indications for orthotopic liver transplantation in hepatocellular carcinoma [J]. Liver Transpl, 2011, 17 Suppl 2: S6-S13.
[ 8 ] Kim KS, Kim K, Chie EK, et al. Post-treatment intracranial hemorrhage of brain metastases from hepatocellular carcinoma [J]. Radiat Oncol J, 2015, 33 (1): 36-41.
[ 9 ] Lasley FD, Mannina EM, Johnson CS, et al. Treatment variables related to liver toxicity in patients with hepatocellular carcinoma, Child-Pugh class A and B enrolled in a phase 1-2 trial of stereotactic body radiation therapy [J]. Pract Radiat Oncol, 2015, 5 (5): e443-e449.
[10] Wigg AJ, Palumbo K, Wigg DR. Radiotherapy for hepatocellular carcinoma: systematic review of radiobiology and modeling projections indicate reconsideration of its use [J]. J Gastroenterol Hepatol, 2010, 25 (4): 664-671.
[11] Andolino DL, Johnson CS, Maluccio M, et al. Stereotactic body radiotherapy for primary hepatocellular carcinoma [J]. Int J Radiat Oncol Biol Phys, 2011, 81 (4): e447-e453.
[12] Kwon JH, Bae SH, Kim JY, et al. Long-term effect of stereotactic body radiation therapy for primary hepatocellular carcinoma ineligible for local ablation therapy or surgical resection. Stereotactic radiotherapy for liver cancer [J]. BMC Cancer, 2010, 10: 475.
[13] Bujold A, Massey CA, Kim JJ, et al. Sequential phase I and Ⅱ trials of stereotactic body radiotherapy for locally advanced hepatocellular carcinoma [J]. J Clin Oncol, 2013, 31 (13): 1631-1639.
[14] El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis [J]. Gastroenterology, 2007, 132 (7): 2557-2576.
[15] Lehman EM, Soliman AS, Ismail K, et al. Patterns of hepatocellular carcinoma incidence in Egypt from a population-based cancer registry [J]. Hepatol Res, 2008, 38 (5): 465-473.
[16] Taketomi A, Toshima T, Kitagawa D, et al. Predictors of extrahepatic recurrence after curative hepatectomy for hepatocellular carcinoma [J]. Ann Surg Oncol, 2010, 17 (10): 2740-2746.
[17] Negewo NA, McDonald VM, Gibson PG. Comorbidity in chronic obstructive pulmonary disease [J]. Respir Investig, 2015, 53 (6): 249-258.
[18] Zeng ZC, Fan J, Tang ZY, et al. Prognostic factors for patients with hepatocellular carcinoma with macroscopic portal vein or inferior vena cava tumor thrombi receiving external-beam radiation therapy [J]. Cancer Sci, 2008, 99 (12): 2510-2517.
[19] Cruz RJ Jr, Ranganathan S, Mazariegos G, et al. Analysis of national and single-center incidence and survival after liver transplantation for hepatoblastoma: new trends and future opportunities [J]. Surgery, 2013, 153 (2): 150-159.
[20] Ohba T, Yano T, Yoshida T, et al. Results of a surgical resection of pulmonary metastasis from hepatocellular carcinoma: prognostic impact of the preoperative serum alpha-fetoprotein level [J]. Surg Today, 2012, 42 (6): 526-531.
[21] Duan F, Wang MQ, Liu FY, et al. Sorafenib in combination with transarterial chemoembolization and bronchial arterial chemoinfusion in the treatment of hepatocellular carcinoma with pulmonary metastasis [J]. Asia Pac J Clin Oncol, 2012, 8 (2): 156-163.
[22] Zhang SM, Zeng ZC, Tang ZY, et al. Prognostic analysis of pulmonary metastases from hepatocellular carcinoma [J]. Hepatol Int, 2008, 2 (2): 237-243.
[23] Shim JH, Park JW, Kim JH, et al. Association between increment of serum VEGF level and prognosis after transcatheter arterial chemoembolization in hepatocellular carcinoma patients [J]. Cancer Sci, 2008, 99 (10): 2037-2044.
[24] Lencioni R, Crocetti L. Local-regional treatment of hepatocellular carcinoma [J]. Radiology, 2012, 262 (1): 43-58.
[25] Qin S, Bai Y, Lim HY, et al. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia [J]. J Clin Oncol, 2013, 31 (28): 3501-3508.
[26] He SL, Shen J, Sun XJ, et al. Efficacy of capecitabine and oxaliplatin regimen for extrahepatic metastasis of hepatocellular carcinoma following local treatments [J]. World J Gastroenterol, 2013, 19 (28): 4552-4558.
[27] Chan LC, Chiu SK, Chan SL. Stereotactic radiotherapy for hepatocellular carcinoma: report of a local single-centre experience [J]. Hong Kong Med J, 2011, 17 (2): 112-118.
[28] Pal HC, Diamond AC, Strickland LR, et al. Fisetin, a dietary flavonoid, augments the anti-invasive and anti-metastatic potential of sorafenib in melanoma [J]. Oncotarget, 2016, 7(2): 1227-1241.
[29] Cardenes HR, Price TR, Perkins SM, et al. Phase I feasibility trial of stereotactic body radiation therapy for primary hepatocellular carcinoma [J]. Clin Transl Oncol, 2010, 12 (3): 218-225.
[30] Honda Y, Kimura T, Aikata H, et al. Pilot study of stereotactic body radiation therapy combined with transcatheter arterial chemoembolization for small hepatocellular carcinoma [J]. Hepatogastroenterology, 2014, 61 (129): 31-36.
[31] Son SH, Choi BO, Ryu MR, et al. Stereotactic body radiotherapy for patients with unresectable primary hepatocellular carcinoma: dose-volumetric parameters predicting the hepatic complication [J]. Int J Radiat Oncol Biol Phys, 2010, 78 (4): 1073-1080.
[32] Jang JW, Kay CS, You CR, et al. Simultaneous multitarget irradiation using helical tomotherapy for advanced hepatocellular carcinoma with multiple extrahepatic metastases [J]. Int J Radiat Oncol Biol Phys, 2009, 74 (2): 412-418.
[33] Wilhelm SM, Carter C, Tang L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis [J]. Cancer Res, 2004, 64 (19): 7099-7109.
[34] Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma [J]. N Engl J Med, 2008, 359 (4): 378-390.
[35] Kawaoka T, Aikata H, Kan H, et al. Clinical outcome and prognostic factors of patients with hepatocellular carcinoma and extrahepatic metastasis treated with sorafenib [J]. Hepatol Res, 2014, 44 (13): 1320-1328.
[本文编辑] 叶 婷, 晓 璐
Observation of the curative effect of Sorafenib combined stereotactic body radiation therapy in the treatment of primary hepatocellular carcinoma with pulmonary metastasis
YIN Xiao-lan, XU Qing*
School of Medicine, Tongji University, Shanghai 200092, China
Objective: To observe the curative effect and adverse reaction of Sorafenib combined stereotactic body radiation therapy (SBRT) in the treatment of primary hepatocellular carcinoma (HCC) with pulmonary metastasis, and to evaluate the safety of combine treatment. Methods: Sixty primary HCC patients with pulmonary metastasis were recruited from June 2011 to June 2013. The patients were equally divided into combine treatment group, which received Sorafenib combined SBRT treatment and control group with only SBRT treatment. The curative effect, adverse reaction after three months of treatment, and long-term curative effect (1 year, 2 years survival rate and median survival time) were compared between two groups. Results: After a three months of follow-up, the total efficiency rate of combined treatment group was 80.2%, which was significantly higher than control group of 73.3%(P=0.045). The median time to progression in combined treatment group was 8.5 months, and control group was 4.6 months (P=0.02). The one year survival rate in combined treatment was 53.3%(16/30), two year survival rate was 30%(9/30); and in control group, one year survival rate was 46.7%(14/30), two year survival rate was 20%(6/30). The median survival time of combined treatment group was 13.2 months, and that of control group was 11.8 months(P=0.019). The toxicity in the two groups was tolerated, and no serious adverse reactions occurred. Conclusions: The Sorafenib combined with SBRT can improve the time to progression and median survival time of HCC patients with pulmonary metastasis without increasing the incidences of adverse events.
stereotactic body radiation therapy; Sorafenib; primary hepatocellular carcinoma; pulmonary metastasis; combined treatment
2016-03-21 [接受日期] 2016-08-31
国家自然科学基金 (81372749). Supported by National Natural Science Foundation of China(81372749).
尹小兰,硕士,主治医师.E-mail:11304090@qq.com
*通信作者(Corresponding author). Tel: 021-66313384, E-mail: qingxu1807@hotmail.com
10.12025/j.issn.1008-6358.2016.20160309
R 815.2
A

