补肾益髓方促进实验性自身免疫性脑脊髓炎小鼠髓鞘再生的作用
王永强 师一民 安辰 赵晖 李明 齐放 张秋霞 陈振振 樊永平 王蕾
·论著·
补肾益髓方促进实验性自身免疫性脑脊髓炎小鼠髓鞘再生的作用
王永强 师一民 安辰 赵晖 李明 齐放 张秋霞 陈振振 樊永平 王蕾
目的 观察补肾益髓方促进实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠髓鞘再生的作用。方法 80只雌性C57BL/6小鼠随机分为正常对照、模型、醋酸泼尼松及补肾益髓方组。以髓鞘少突胶质细胞糖蛋白(myelin oligodendroglia glycoprotein,MOG)35-55诱导小鼠EAE模型。治疗组小鼠每天给予相应药物灌胃治疗,共40天,醋酸泼尼松为阳性对照药物。每天观察动物的一般情况,记录小鼠神经功能评分,统计小鼠的发病率、潜伏期、病程和疾病负荷等。取小鼠脑和脊髓经固蓝染色观察其髓鞘变化,免疫组化法测定髓鞘再生相关蛋白硫酸软骨素蛋白多糖2胶质细胞和髓鞘碱性蛋白(myelin basic protein,MBP)的表达。结果 补肾益髓方能够延长小鼠发病潜伏期、缩短EAE病程、降低小鼠疾病负荷(P<0.05),减少小鼠脑和脊髓内炎细胞浸润和髓鞘脱失;本方还可促进NG2和MBP蛋白的表达(P<0.01)。结论 补肾益髓方对EAE小鼠有神经保护作用,并能减轻髓鞘损伤和促进髓鞘修复。
补肾益髓方; 实验性自身免疫性脑脊髓炎; 髓鞘再生
多发性硬化(multiple sclerosis,MS)是一种以中枢神经系统脑白质脱髓鞘为病变特点的自身免疫性疾病[1-2],髓鞘脱失、轴突损伤和少突胶质细胞等破坏是MS的病理特征[3]。研究发现,在疾病早期髓鞘尚有一定的再生能力[4]。MS脱髓鞘后,髓鞘再生主要由少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)募集至损伤部位,分化成少突胶质细胞(oligodendrocytes,OLs)并产生髓磷脂包裹受损的轴突[5-7],最终实现再髓鞘化来恢复神经功能。因此在治疗上,除了控制炎症以减轻神经损伤外,促进髓鞘再生也是治疗MS的重要环节[8]。目前西医采用免疫治疗(如激素、干扰素等)以控制其炎症,糖皮质激素(如醋酸泼尼松等)是治疗MS的基本药物[9],但长期大量使用,毒副作用明显,现代医学在髓鞘再生方面几乎无药可用[10]。而越来越多的文献报道显示了中医药在治疗MS疾病方面存在的优势[11]。补肾益髓方具有滋阴补肾、化痰活血的功用,能够改善MS患者症状和体征,延长缓解期控制复发;同时能够调节免疫功能,促进轴突及髓鞘的修复再生,临床效果明显[12]。研究发现,髓鞘形成过程中在OPCs阶段主要表达NG2和A2B5,在髓鞘OLs阶段主要表达MBP和O4成熟的特异性蛋白[13-14]。因此本实验在前期研究的基础上,利用MS动物模型实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠,观察补肾益髓方对EAE小鼠的神经保护作用,并通过免疫组化法观察其对NG2和MBP表达的影响,以探讨本方促进EAE小鼠髓鞘再生的作用。
1 材料与方法
1.1 实验动物
SPF级C57BL/6雌性小鼠,6~8周龄,体质量15~17 g,购于北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012-0001,饲养于首都医科大学实验动物中心国家标准实验室。置于独立通风系统单笼饲养,温度18~22℃,相对湿度40%~60%,自由饮食和饮水。所有实验步骤均经首都医科大学伦理委员会审核批准。
1.2 药物和试剂
补肾益髓方(生地黄10 g、熟地黄10 g、制何首乌10 g、酒大黄2 g、益母草10 g、浙贝母6 g、水蛭3 g、全蝎2 g、天麻3 g、连翘6 g)由北京亚东生物制药有限公司制备。制备方法简述如下:浙贝母研粉过筛;其余药物煎煮浓缩成稠膏,与浙贝母粉混匀备用。醋酸泼尼松片由天津力生制药有限公司生产。
髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)35-55由北京旭和源生物科技有限公司合成;灭活结核分枝杆菌(mycobacterium tuberculosis,H37Ra,MTB,批号:4283842,购自BD公司);完全弗氏佐剂(complete Freund’s adjuvant, CFA,批号:SLBH7316V,购自Sigma公司);百日咳毒素(pertussis toxin,PTX,批号:SLBP1591V,购自Sigma公司); NG2抗体(批号:GR26516-29,购自abcam公司);MBP抗体(批号:GR170892-2,购自abcam公司)。
1.3 分组及模型制备
将80只小鼠随机分为正常对照组(n=20)、模型组(n=20)、醋酸泼尼松组(n=20)及补肾益髓方组(n=20)。在免疫当天及免疫后第7天于小鼠后背中线两侧皮下4点注射MOG35-55与CFA按1∶1混合的乳化抗原0.2 mL(含50 μg MOG35-55、100 μL CFA,0.3 mg的MTB和100 μL生理盐水),且免疫当天及48小时后,腹腔注射PTX 500 ng/只,诱导小鼠建立EAE模型。正常对照组小鼠用同体积生理盐水代替。
1.4 给药和处理方法
免疫第一天开始分别灌胃给予醋酸泼尼松(5 mg/kg 体重)和补肾益髓方(3.02 g生药/kg体重)。正常对照组和模型组均灌服相同体积蒸馏水。每天1次,连续40天,每天观察小鼠神经行为学变化。各组小鼠分别于发病急性期(20天)、缓解期(40天)取脑和脊髓。
1.5 组织标本采集及处理
在发病第20、40天,每组取4只小鼠予10%水合氯醛(190 mg/kg)腹腔注射麻醉,4%多聚甲醛心脏灌流,取脑和脊髓,石蜡包埋成2 μm厚度的切片,固蓝(luxol fast blue,LFB)染色,光镜观察组织形态学变化。
1.6 检测指标
1.6.1 小鼠神经行为学观察 小鼠造模后,每天对小鼠进行神经功能评分。神经功能评分采用15分记分法:尾巴活动分为3级:无症状者0分,尾巴张力减低或尾巴远端瘫痪1分,尾巴全瘫2分;肢体活动分为4级:无症状者0分,步态不稳1分,肢体轻瘫,行走时肢体拖曳2分,肢体全瘫,行走时肢体外翻3分。通过累积分数得出总分。若出现死亡则记为15分。计算小鼠的发病率、潜伏期、病程和疾病负荷。疾病负荷是指观察期内每只小鼠神经功能评分的总和。
1.6.2 NG2与MBP免疫组化染色观察 小鼠脑和脊髓切片经二甲苯脱蜡,梯度乙醇洗脱至水,PBS冲洗后,放入柠檬酸缓冲液中进行抗原修复20分钟,取出,室温下自然冷却至35℃以下,用3%H2O2孵育10分钟,滴加一抗稀释液NG2(1∶150)/ MBP(1∶350),4℃孵育12小时。取出后,在37℃放置1小时,再依次加入聚合酶辅助剂一、抗兔IgG多聚体(试剂二)后,37℃孵育1小时。DAB显色1~5分钟,脱水、透明、中性树胶封片,光学显微镜下观察照相,并用NIS-Elements BR 3.2软件测定积分光密度(integral optical density,IOD)值。
人力资本可以划分为:员工拥有知识的多样性;员工解决问题的能力;员工的受教育背景或者高学历员工的比例;员工的基本技能;员工的学习能力或工作经验。
1.7 统计学处理

2 结果
2.1 补肾益髓方对EAE小鼠神经行为学变化的影响
模型组小鼠于造模12天后开始发病,并于造模19天达到高峰,发病率为100%,随后成缓慢下降趋势,但在40天时发病率仍为80%。醋酸泼尼松和补肾益髓方治疗组发病率变化趋势与模型组相一致,但其发病高峰期稍有后移,发病率均低于模型组。其中醋酸泼尼松组于造模12天开始发病,第20天发病率最高为90%,在40天时发病率降至50%;补肾益髓方组于造模后13天开始发病,造模21天发病率最高为90%,在40天时发病率下降为40%。
表1显示,模型组小鼠潜伏期为(14.4±0.6)天,而醋酸泼尼松和补肾益髓方明显延长了EAE小鼠的潜伏期,较模型组有统计学意义(P<0.05)。模型组小鼠的病程最长,为(36.2±2.1)天,醋酸泼尼松组的病程缩短为(31.9±2.0)天,补肾益髓方组的病程明显缩短为(28.9±2.3)天,差异有统计学意义(P<0.05)。并且醋酸泼尼松和补肾益髓方组较模型组均能够降低EAE小鼠疾病负荷值(P<0.05)。
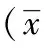
表1 各组小鼠发病潜伏期、病程及疾病负荷的变化±s)
注: 与模型组相比,aP<0.05。
2.2 补肾益髓方对EAE小鼠脑及脊髓髓鞘的影响
LFB染色结果分析得出,在20天时正常对照组大鼠脑及脊髓均着色均匀,结构有序完整;模型组有大量炎症细胞浸润现象,髓鞘板层结构疏松呈泡沫状、髓鞘不连续、甚至呈片状脱失。醋酸泼尼松组及补肾益髓方组均有炎细胞浸润及髓鞘脱失现象,但均相对于模型组较轻。见图1、2。
第20天,模型组小鼠脑和脊髓中NG2表达较正常对照组明显升高(P<0.001),醋酸泼尼松和补肾益髓方组NG2表达与模型组相比均明显降低(P<0.001);但在第40天时,模型组小鼠脑和脊髓中NG2表达较正常对照组明显降低(P<0.001),醋酸泼尼松和补肾益髓方组小鼠NG2表达均较模型组明显升高(P<0.05,P<0.01)。见图3、图4,表2。
2.4 补肾益髓方对EAE小鼠脑及脊髓组织中MBP表达的影响
在第20天和第40天,模型组小鼠脑和脊髓中MBP表达较正常对照组均明显降低(P<0.05,P<0.001),但经过醋酸泼尼松和补肾益髓方治疗后,小鼠脑和脊髓中MBP表达均较明显升高,与模型组比较有统计学意义(P<0.05,P<0.01)。见图5、图6,表3。

注:A.正常对照组;B.模型组;C.醋酸泼尼松组;D.补肾益髓方组

注: A.正常对照组;B.模型组;C.醋酸泼尼松组;D.补肾益髓方组

注: A.正常对照组(20天);B.模型组(20天);C.醋酸泼尼松组(20天);D.补肾益髓方组(20天)E.正常对照组(40天);F.模型组(40天);G.醋酸泼尼松组(40天);H.补肾益髓方组(40天)

注:A.正常对照组(20天);B.模型组(20天);C.醋酸泼尼松组(20天);D.补肾益髓方组(20天)E.正常对照组(40天);F.模型组(40天);G.醋酸泼尼松组(40天);H.补肾益髓方组(40天)

组别n脑第20天第40天脊髓第20天第40天正常对照组420.48±0.6220.30±0.3619.35±0.5020.27±1.05模型组436.55±1.17a13.76±0.48a34.82±1.31a13.06±1.30a醋酸泼尼松组429.02±1.08d16.47±0.93c27.63±0.58d16.19±0.40b补肾益髓方组428.46±1.12d17.91±0.64d28.89±1.70d17.46±0.56c
注: 与正常对照组比较,aP<0.001;与模型组比较,bP<0.05,cP<0.01,dP<0.001。

注:A.正常对照组(20天);B.模型组(20天);C醋酸泼尼松组(20天); D.补肾益髓方组(20天)E.正常对照组(40天);F.模型组(40天);G.醋酸泼尼松组(40天);H.补肾益髓方组(40天)

注:A.正常对照组(20天);B.模型组(20天);C.醋酸泼尼松组(20天);D.补肾益髓方组(20天)E.正常对照组(40天);F.模型组(40天);G.醋酸泼尼松组(40天);H.补肾益髓方组(40天)

组别n脑第20天第40天脊髓第20天第40天正常对照组426.84±0.8826.41±0.7526.12±0.9825.54±0.79模型组417.20±2.02a13.82±0.93a16.32±0.40a12.42±0.44a醋酸泼尼松组422.12±0.70b17.39±0.66b22.04±0.85d16.64±0.61d补肾益髓方组421.78±0.67b20.39±1.37d20.84±1.34c19.32±0.49d
注: 与正常对照组比较,aP<0.001;与模型组比较,bP<0.05,cP<0.01,dP<0.001。
3 讨论
MS属于中医“痿症”范畴,根据临床症状观察该病与“骨痿”最为相似[15-16]。目前中医对该病的认识为本虚标实,肾虚为发病之本,湿热浊毒为标,与肾、脾、肝密切相关[16-17]。临床研究发现,MS患者的肝肾阴虚和痰瘀阻络证具有普遍性,因此,以补肾配伍化痰活血法为指导创立了补肾益髓方。方中生地黄、熟地黄滋肾养阴,奏扶正之功;浙贝母、益母草、水蛭、全蝎等,化痰祛瘀通络,起祛邪之用。前期研究证实补肾益髓方对EAE模型具有明显治疗作用[12]。本次实验发现,补肾益髓方能够明显降低EAE小鼠发病率,延长发病潜伏期、缩短了病程,并明显降低了EAE小鼠的疾病负荷,与之前的结果一致。研究显示,在本病初期,CD4+T淋巴细胞数目增多,并从外周经血脑屏障进入CNS攻击髓鞘等,最终造成脱髓鞘损伤[18],是导致MS患者神经功能障碍的主要原因。从LFB染色结果分析得出,补肾益髓方能够减轻EAE小鼠炎细胞浸润及髓鞘脱失现象,从而发挥神经保护作用。
NG2是一种表达在OPCs细胞膜上的糖蛋白,称为硫酸软骨素蛋白多糖NG2,其可作为OPCs的特异性细胞标志物[19]。MBP是一种具有黏附作用并在髓鞘的形成中起到关键作用的一个重要的髓鞘组成成分[20],在OPCs分化过程中,有丝分裂后期的少突胶质细胞成熟阶段,髓鞘抗原MBP被合成[21],并在髓鞘外缘形成稳定膜状板层结构,从而保证了髓鞘的完整性,故MBP是成熟少突胶质细胞的标志。
本次实验结果发现,急性期EAE小鼠脑和脊髓NG2表达明显升高,在缓解期却明显降低,而MBP水平无论急性期还是缓解期均显著降低。研究证实,当CNS系统受到损伤后,NG2细胞在损伤区的周围迅速做出反应。如在动物脊髓半损伤、兴奋性中毒以及脱髓鞘模型中,均出现脑NG2细胞的增殖反应[22]。有学者认为NG2增殖机制可能与临近的神经元和少突胶质细胞通过Notch信号通路调节NG2细胞有关[23]。由于NG2细胞上存在腺苷受体,其激活又会抑制NG2的过度增殖而加速其髓鞘化过程[24],因此在缓解期NG2的表达量显著降低,推测可能与OPCs逐渐分化以补偿损失的髓鞘成分有关。MBP水平的持续降低说明EAE疾病发生后,大量炎症细胞攻击髓鞘,导致髓鞘损伤,虽然髓鞘的再生发生在EAE中,但其能力是有限的。原因可能是脱髓鞘后产生的抑制环境,特别是影响OPCs功能的内源性和外源性因素,如转录因子、脑源性神经营养因子、抑制因子、趋化因子等异常表达,阻碍了OPCs完成髓鞘再生过程,导致髓鞘再生失败[25-26]。然而补肾益髓方明显降低急性期EAE小鼠NG2,升高缓解期NG2水平,同时明显升高了急性期和缓解期MBP的表达,说明补肾益髓方促进髓鞘再生的作用与OPCs增殖有关。Yang T等[27]的研究中发现补肾益髓方促进髓鞘再生的作用还与调节其转录因子Olig1和Olig2有关。
综上所述,补肾益髓方可减轻EAE动物的神经损伤并促进其髓鞘再生,这些结果为本方临床治疗MS疾病提供了依据,但其深入的机制还有待进一步研究。
[1] Fujiyoshi K, Hikishima K, Nakahara J, et al. Application of q-Space Diffusion MRI for the Visualization of White Matter[J]. J Neurosci, 2016,36(9):2796-2808.
[2] Beauchemin P, Carruthers R. MS arising during Tocilizumab therapy for rheumatoid arthritis[J]. Mult Scler, 2016,22(2):254-256.
[3] Haider L, Simeonidou C, Steinberger G, et al. Multiple sclerosis deep grey matter: the relation between demyelination, neurodegeneration, inflammation and iron[J]. J Neurol Neurosurg Psychiatry, 2014,85(12):1386-1395.
[4] Gaesser JM, Fyffe-Maricich SL. Intracellular signaling pathway regulation of myelination and remyelination in the CNS[J]. Exp Neurol, 2016,283(PtB):501-511.
[5] 姚宏波, 张萌, 宫学武, 等. Olig对少突胶质细胞介导脱髓鞘大鼠髓鞘再生的影响[J].解剖学报,2014,45(1):37-40.
[6] Lourenço T, de Faria JP, Bippes CA, et al. Modulation of oligodendrocyte differentiation and maturation by combined biochemical and mechanical cues[J]. Sci Rep, 2016,6:21563.
[7] Khalaj AJ, Hasselmann J, Augello C, et al. Nudging oligodendrocyte intrinsic signaling to remyelinate and repair:Estrogen receptor ligand effects[J]. J Steroid Biochem MolBiol, 2016,160:43-52.
[8] Kremer D, Küry P, Dutta R. Promoting remyelination in multiple sclerosis: current drugs and future prospects[J]. Mult Scler, 2015,21(5):541-549.
[9] 申丽萍. 多发性硬化的临床治疗进展[J].临床医药文献电子杂志,2015,(18):3689-3690.
[10] Kamm CP, Uitdehaag BM, Polman CH. Multiple sclerosis: current knowledge and future outlook[J]. Eur Neurol, 2014,72(3-4):132-141.
[11] 樊永平, 王蕾. 炎性脱髓鞘疾病中医药治疗[M].北京: 人民军医出版社,2015:30-99.
[12] 房玲, 樊永平, 赵晖, 等. 补肾益髓方防治多发性硬化的研究进展[J].中医药导报,2013,19(12):108-110.
[13] 李彩红, 张婷, 陈雪, 等. 大鼠脊髓少突胶质前体细胞的培养与鉴定方法[J].卒中与神经疾病,2014,21(4):199-202.
[14] Girolamo F, Ferrara G, Strippoli M, et al. Cerebral cortex demyelination and oligodendrocyte precursor response to experimental autoimmune encephalomyelitis[J]. Neurobiol Dis, 2011,43(3):678-689.
[15] 郑琦, 杨涛, 徐大鹏, 等. 补肾方药防治多发性硬化研究述评[J].辽宁中医药大学学报,2011,13(8):96-98.
[16] 樊永平. 多发性硬化中医病因病机和治疗[J].环球中医药,2013,9(6):668-670.
[17] 刘剑, 高颖. 分期辨治复发缓解型多发性硬化的理论探讨[J].中华中医药杂志,2013,28(4):990-993.
[18] Goverman JM. Immune tolerance in multiple sclerosis[J]. Immunol Rev, 2011,241(1):228-240.
[19] Xing YL, Röth PT, Stratton JA, et al. Adult neural precursor cells from the subventricular zone contribute significantly to oligodendrocyte regeneration and remyelination[J]. J Neurosci, 2014,34(42):14128-14146.
[20] Vincze A, Mázló M, Seress L, et al. A correlative light and electron microscopic study of postnatal myelination in the murine corpus callosum[J]. Int J Dev Neurosci, 2008,26(6):575-584.
[21] 赵红, 张拥波, 王得新, 等. 大鼠局灶性脑缺血后少突胶质前体细胞激活及髓鞘再生的实验研究[J].中风与神经疾病杂志,2012,29(4):332-334.
[22] Huang S, Tang C, Sun S, et al. Protective Effect of electroacupuncture on neural myelin sheaths is mediated via promotion of oligodendrocyte proliferation and inhibition of oligodendrocyte death after compressed spinal cord injury[J]. MolNeurobiol, 2015,52(3):1870-1881.
[23] Aparicio E, Mathieu P, Pereira LM, et al. The Notch signaling pathway: its role in focal CNS demyelination and apotransferrin-induced remyelination[J]. J Neurochem, 2013,127(6):819-836.
[24] Ceruti S, Viganò F, Boda E, et al. Expression of the new P2Y-like receptor GPR17 during oligodendrocyte precursor cell maturation regulates sensitivity to ATP-induced death[J]. Glia, 2011,59(3):363-378.
[25] Boyd A, Zhang H, Williams A. Insufficient OPC migration into demyelinated lesions is a cause of poor remyelination in MS and mouse models[J]. ActaNeuropathol, 2013,125(6):841-859.
[26] Boulanger JJ, Messier C. From precursors to myelinating oligodendrocytes: contribution of intrinsic and extrinsic factors to white matter plasticity in the adult brain[J]. Neuroscience, 2014,269(1):343-366.
[27] Yang T, Zheng Q, Zhao H, et al. Effect of BushenYisui Capsule on oligodendrocyte lineage genes 1 and 2 in mice with experimental autoimmune encephalomyelitis[J]. Chin J Integr Med, 2016,(2):1-9.
(本文编辑: 韩虹娟)
Effects ofBushenYisuiformula on promoting remyelination in mice with experimental autoimmune encephalomyelitis
WANGYong-qiang,SHIYi-min,ANChen,etal.
SchoolofTraditionalChineseMedicine,BeijingKeyLabofTCMCollateralDiseaseTheoryResearch,CapitalMedicalUniversity,Beijing100069,China
WANGLei,E-mail:tmwangl@ccmu.edu.cn
Objective To observe the effect ofBushenYisuiformula on promoting remyelination in mice with experimental autoimmune encephalomyelitis (EAE). Methods 80 female C57BL/6 mice were randomly divided into normal control, model, prednisone acetate andBushenYisuiformula-treated groups. EAE model was established through the injection of myelin oligodendroglia glycoprotein (MOG)35-55. The mice in treatment groups were administrated administration with corresponding medicines daily for 40 days. Prednisone acetate was considered as the positive control. Animal condition was observed and neurofunctional score was recorded every day. Meanwhile, the morbidity, latency, disease course and disease burden were acquired. Luxol fast blue staining of the brain and spinal cord was performed to observe the changes of myelin. The expressions of myelin regeneration associated proteins chondroitin sulfate proteoglycan 2 and myelin basic protein (MBP) were determined by the immunohistochemistry technique. ResultsBushenYisuiformula could prolong the latent period, shorten the course, lighten the disease burden(P<0.05).It could reduce inflammatory cell infiltration and demyelination in the brain and spinal cord of EAE mice.BushenYisuicould also improve the protein expressions of NG2 and MBP(P<0.01). ConclusionBushenYisuihad neuroprotective effects on EAE mice. It was able to alleviate myelin injury and promote the recovery of myelin.
BushenYisuiformula; Experimental autoimmune encephalomyelitis; Remyelination
国家自然科学基金(81273742、81573898);北京市属高等学校高层次人才引进与培养计划-长城学者项目(CIT&TCD20140329)
100069 北京,首都医科大学中医药学院中医络病研究北京市重点实验室[王永强(硕士研究生)、师一民(硕士研究生)、安辰(硕士研究生)、赵晖、李明、齐放、张秋霞、陈振振、王蕾];首都医科大学附属北京天坛医院中医科(樊永平)
王永强(1989- ),2014级在读硕士研究生。研究方向:中医药防治脑病研究。E-mail:644750798@qq.com
王蕾(1967- ),女,博士,教授,博士生导师。研究方向:中医药防治脑病研究。E-mail:tmwangl@ccmu.edu.cn
R285.5
A
10.3969/j.issn.1674-1749.2016.12.002
2016-04-14)

