日粮能量和蛋白水平对滩羊脂肪组织PPARγ和FABP4 mRNA表达的影响
王小芳,曾 洁,田崇奇,王小龙,杨雨鑫,陈玉林,张恩平
(西北农林科技大学动物科技学院,杨凌 712100)
日粮能量和蛋白水平对滩羊脂肪组织PPARγ和FABP4 mRNA表达的影响
王小芳,曾 洁,田崇奇,王小龙,杨雨鑫,陈玉林,张恩平*
(西北农林科技大学动物科技学院,杨凌 712100)
旨在研究日粮能量和蛋白水平对滩羊脂肪组织中PPARγ和FABP4 mRNA表达的影响。选择健康、体重相近的滩羊112只,公母各半,随机分4组,每组4个重复,每个重复7只羊。参考肉羊饲养标准NY/T(816-2004),根据生长阶段(22~28、29~35、36~40 kg)以目标增重设计标准日粮,每阶段设置0.84×标准(I组)、0.96×标准(II组)、1.08×标准(III组)和1.20×标准(IV组)4个营养水平日粮,分别饲喂4组试验滩羊。于每阶段末每个重复屠宰1只试验羊,取尾部脂肪、肾周脂肪和皮下脂肪组织,通过实时荧光定量PCR检测PPARγ和FABP4 mRNA表达水平。结果表明,尾部脂肪组织,在22~28和36~40 kg阶段末,II组PPARγ和FABP4 mRNA表达量显著高于其他组(P<0.05);在29~35 kg阶段末,II组FABP4 mRNA表达量显著高于其他组(P<0.05),且IV组mRNA表达量显著低于其他组(P<0.05)。肾周脂肪组织,在3个不同阶段末, II组PPARγmRNA表达量显著高于其他组(P<0.05),且IV组mRNA表达量显著低于III组(P<0.05)。在22~28 kg 阶段末,II组和III组FABP4 mRNA表达量显著高于其他组(P<0.05);在29~35 kg阶段末,II组FABP4 mRNA表达量显著高于IV组(P<0.05);在36~40 kg阶段,I组和II组FABP4 mRNA表达量显著高于其他组(P<0.05)。皮下脂肪组织,在3个阶段末,各组PPARγ和FABP4 mRNA表达无显著差异(P>0.05)。结果表明,日粮能量和蛋白水平对滩羊深层脂肪组织(肾周脂肪)中PPARγ和FABP4 mRNA表达的影响大于浅层脂肪组织(皮下脂肪),对尾部脂肪组织中PPARγ和FABP4 mRNA的表达有影响。
滩羊;能量和蛋白水平;脂肪组织;PPARγ;FABP4
滩羊是宁夏的优良绵羊品种,系蒙古羊的一个亚型,过去尤以生产二毛裘皮著称,近年来,由于其肉质细嫩可口、不膻不腻又极具地方特色而深受消费者青睐。滩羊属脂尾型绵羊,其尾部沉积脂肪的功能非常强大,这在一定程度上会减少其他部位的脂肪沉积(如肌内脂肪),而肌内脂肪含量的多少会影响羊肉的品质,且尾部脂肪的过多沉积会造成饲粮的浪费,增加饲养成本,并且与生产瘦肉相比,脂肪在绵羊体内的沉积需要更多的能量饲料。过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor,PPARγ)和脂肪酸结合蛋白4(Fatty acid binding protein 4,FABP4)在脂肪沉积过程中发挥重要作用[1]。PPARγ属于II型核激素受体超家族PPARs的一种亚型,是脂肪细胞分化的重要调节因子,参与脂质代谢和糖代谢。FABP4,是脂肪酸结合蛋白家族成员,通过可逆性结合长链脂肪酸促进脂肪酸的代谢和转运,是PPARγ的一个重要靶基因。在畜禽中,脂肪沉积因动物品种、年龄、营养及环境条件不同而存在差异[2-3]。
本试验研究了营养和生长阶段对滩羊PPARγ和FABP4基因mRNA表达的影响,旨在为探讨其脂肪代谢与调控提供基础数据。
1 材料与方法
1.1 试验动物
选取日龄、体重相近的4月龄左右健康滩羊112只,公母各半。
1.2 试验日粮
参考肉羊饲养标准(NY/T816-2004),根据滩羊增重目标分为22~28,29~35,36~40 kg 3个生长阶段,按日增重200 g设计各生长阶段标准日粮,每阶段设置4种日粮,能量和蛋白质水平分别为0.84×标准、0.96×标准、1.08×标准和1.20×标准,其他营养水平基本一致。日粮制成颗粒饲料饲喂。各阶段日粮组成及营养水平见表1。
1.3 试验设计与饲养管理
将112只试验滩羊随机分为4组,每组4个重复,每个重复7只羊。采用单因素随机区组试验设计,按生长阶段,I~IV组分别饲喂能量和蛋白质水平为0.84×标准、0.96×标准、1.08×标准和1.20×标准4种日粮。自由采食、饮水,每天饲喂3次。在每阶段末每个重复选取1只最接近平均体重的试验羊屠宰,采集尾部脂肪、肾周脂肪和皮下脂肪组织,用DEPC水冲洗干净,-80 ℃保存备用。
1.4 总RNA的提取和cDNA的合成
采用康为世纪超纯RNA提取试剂盒(Ultrapure RNA Kit)提取样品的总RNA,核酸蛋白仪检测RNA浓度及纯度,OD260 nm/OD280 nm=1.8~2.0,1%琼脂糖凝胶电泳鉴定RNA质量。按照TaKaRa反转录试剂盒(PrimeScriptTMRT Master Mix)操作说明合成cDNA,于-20 ℃保存备用。
1.5 引物设计
参照GenBank公布的绵羊PPARγ和FABP4基因的mRNA序列,用Primer Premier 5.0软件设计引物,交由南京金斯瑞生物科技有限公司合成,以绵羊β-actin为内参基因。引物序列见表2。
表1 不同生长阶段日粮组成及营养水平(干物质基础)
Table 1 Composition and nutritional levels at different stages(DM basis) %
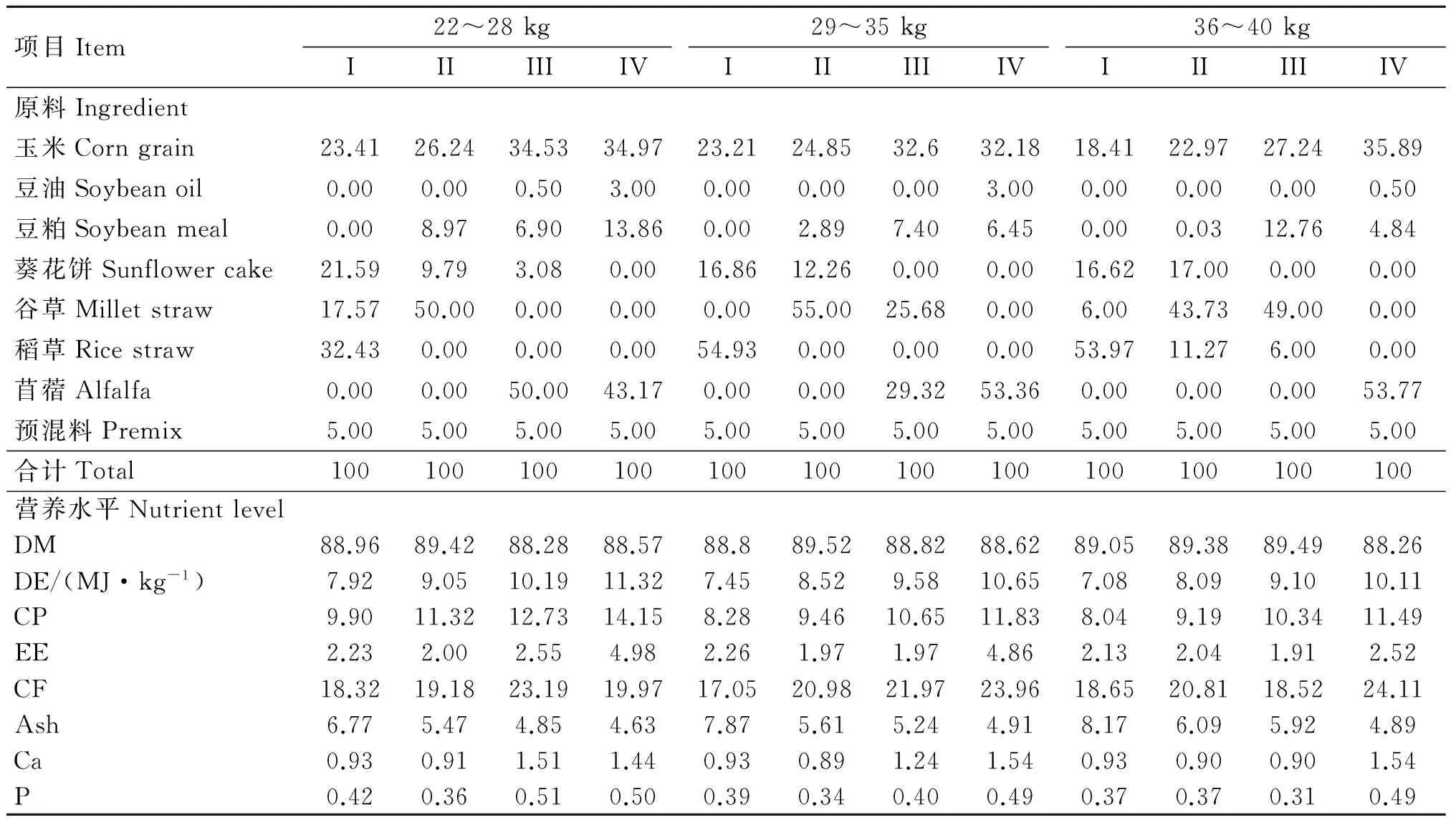
项目Item22~28kg29~35kg36~40kgIIIIIIIVIIIIIIIVIIIIIIIV原料Ingredient玉米Corngrain23.4126.2434.5334.9723.2124.8532.632.1818.4122.9727.2435.89豆油Soybeanoil0.000.000.503.000.000.000.003.000.000.000.000.50豆粕Soybeanmeal0.008.976.9013.860.002.897.406.450.000.0312.764.84葵花饼Sunflowercake21.599.793.080.0016.8612.260.000.0016.6217.000.000.00谷草Milletstraw17.5750.000.000.000.0055.0025.680.006.0043.7349.000.00稻草Ricestraw32.430.000.000.0054.930.000.000.0053.9711.276.000.00苜蓿Alfalfa0.000.0050.0043.170.000.0029.3253.360.000.000.0053.77预混料Premix5.005.005.005.005.005.005.005.005.005.005.005.00合计Total100100100100100100100100100100100100营养水平NutrientlevelDM88.9689.4288.2888.5788.889.5288.8288.6289.0589.3889.4988.26DE/(MJ·kg-1)7.929.0510.1911.327.458.529.5810.657.088.099.1010.11CP9.9011.3212.7314.158.289.4610.6511.838.049.1910.3411.49EE2.232.002.554.982.261.971.974.862.132.041.912.52CF18.3219.1823.1919.9717.0520.9821.9723.9618.6520.8118.5224.11Ash6.775.474.854.637.875.615.244.918.176.095.924.89Ca0.930.911.511.440.930.891.241.540.930.900.901.54P0.420.360.510.500.390.340.400.490.370.370.310.49
预混料为每千克饲粮提供:VA 7 500 IU, VD 1 050 IU, VE 10 IU, Fe 5 500 mg, Cu 500 mg, Mn 5 000 mg, Zn 4 000 mg, Se 32.5 mg, I 100 mg, Co 32.5 mg。营养水平中DM、DE和CP含量为分析值,EE、CF、Ash、Ca和P含量是根据原料组成计算所得(干物质基础)
The premix provides the following per kg diet: VA 7 500 IU, VD 1 050 IU, VE 10 IU, Fe 5 500 mg, Cu 500 mg, Mn 5 000 mg, Zn 4 000 mg, Se 32.5 mg, I 100 mg, Co 32.5 mg. The nutrient levels in DM, DE and CP content are analyzed values, EE, CF, Ash, Ca and P content are calculated values based on the obtained raw material composition(dry matter basis)
表2 实时荧光定量PCR引物序列
Table 2 Primer sequences for Real-time quantitative PCR
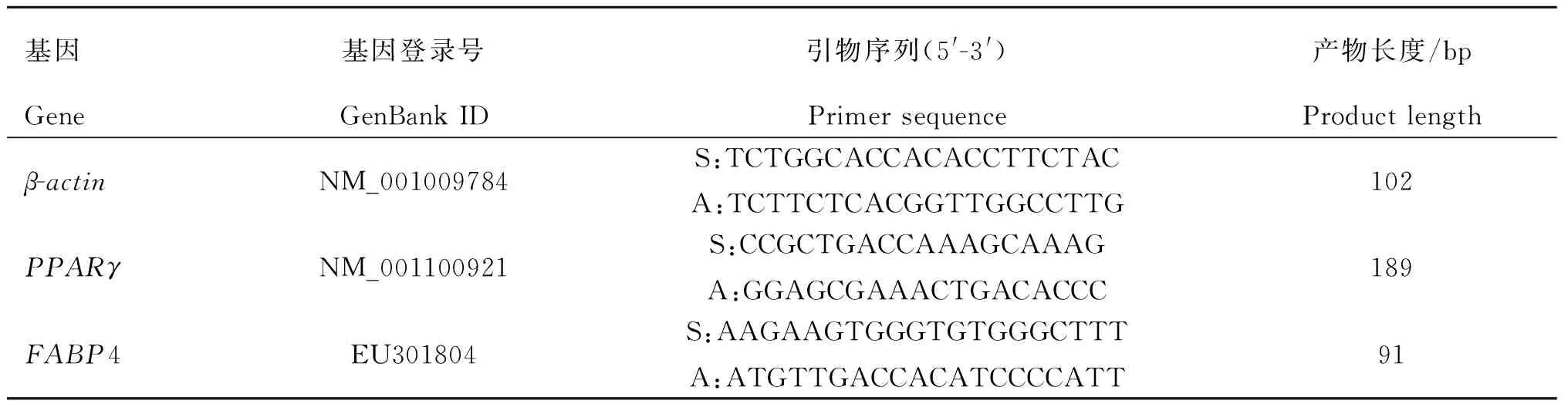
基因基因登录号引物序列(5'-3')产物长度/bpGeneGenBankIDPrimersequenceProductlengthβ-actinNM_001009784S:TCTGGCACCACACCTTCTACA:TCTTCTCACGGTTGGCCTTG102PPARγNM_001100921S:CCGCTGACCAAAGCAAAGA:GGAGCGAAACTGACACCC189FABP4EU301804S:AAGAAGTGGGTGTGGGCTTTA:ATGTTGACCACATCCCCATT91
S. 上游引物;A. 下游引物
S. Sense primer;A. Antisense primer
1.6 实时荧光定量PCR
采用荧光染料SYBR®Premix Ex TaqTMII进行实时荧光定量PCR。反应体系为20 μL:2×SYBR®Premix Ex TaqII 10 μL,上下游引物各0.8 μL,RNase-Free ddH2O 6.4 μL,cDNA模板2 μL。采用三步法进行PCR扩增,反应条件:95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸45 s(45个循环)。反应结束后进行熔解曲线分析:设置熔解曲线温度为55~95 ℃。每个样品3个平行,计算平均Ct值,以β-actin为参照基因,用2-△△Ct法计算各基因mRNA的相对表达量。
1.7 数据分析
采用SPSS 22.0统计软件对试验数据进行单因子方差分析(one-way ANOVA),并进行多重比较(Duncan),数据表示为“平均值±标准误(Mean±SE)”,P<0.05表示差异显著。
2 结 果
2.1 不同营养水平对滩羊尾脂PPARγ mRNA表达的影响
由图1可知,在22~28 kg阶段末,II组的尾脂PPARγmRNA的相对表达量显著高于其他组,且I组的表达量显著高于IV组(P<0.05)。在36~40 kg阶段末,II组的PPARγmRNA的相对表达量显著高于其他组,且I组的表达量显著高于III、IV组(P<0.05)。在29~35 kg阶段末,PPARγmRNA在各组的表达量无显著性差异(P>0.05)。
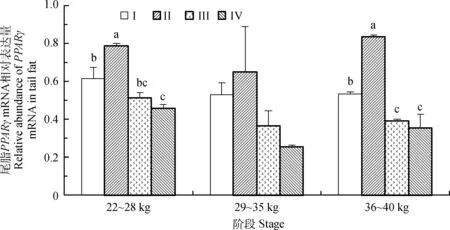
同一阶段,不同小写字母表示差异显著(P<0.05),下同The different small letter means significant difference at the same stage(P<0.05), the same as below图1 不同营养水平对滩羊尾脂PPARγ mRNA的影响Fig.1 The effect of different nutritional levels on PPARγ mRNA in tail fat of Tan sheep
2.2 不同营养水平对滩羊肾周脂肪PPARγ mRNA表达的影响
由图2可知,在22~28和36~40 kg阶段末,II组的肾周脂肪PPARγmRNA的相对表达量显著高于其他组,且III组的表达量显著高于IV组(P<0.05)。在29~35 kg阶段末,II组的肾周脂肪PPARγmRNA的相对表达量显著高于其他组,且I、III组的表达量显著高于IV组(P<0.05)。
2.3 不同营养水平对滩羊皮下脂肪PPARγ mRNA表达的影响
由图3可知,在3个不同的生长阶段,各组滩羊皮下脂肪中PPARγmRNA的相对表达量均无显著性差异(P>0.05)。
2.4 不同营养水平对滩羊尾脂FABP4 mRNA表达的影响
由图4可知,在22~28 kg阶段末,II组的尾脂FABP4 mRNA的相对表达量显著高于其他组(P<0.05)。在29~35 kg阶段末,II组FABP4 mRNA的相对表达量显著高于其他组,且I、III组的表达量显著高于IV组(P<0.05)。在36~40 kg阶段末,II组FABP4 mRNA的相对表达量显著高于其他组,且III组的表达量显著高于I、IV组(P<0.05)。
2.5 不同营养水平对滩羊肾周脂肪FABP4 mRNA表达的影响
由图5可知,在22~28 kg阶段末,II、III组的肾周脂肪FABP4 mRNA的相对表达量显著高于I、IV组(P<0.05)。在29~35 kg阶段末,II组FABP4 mRNA的相对表达量显著高于IV组(P<0.05)。在36~40 kg阶段末,I、II组FABP4 mRNA的相对表达量显著高于III、IV组(P<0.05)。
2.6 不同营养水平对滩羊皮下脂肪FABP4 mRNA表达的影响
由图6可知,在3个不同的生长阶段,滩羊皮下脂肪中FABP4 mRNA的相对表达量在各组间均无显著性差异(P>0.05)。
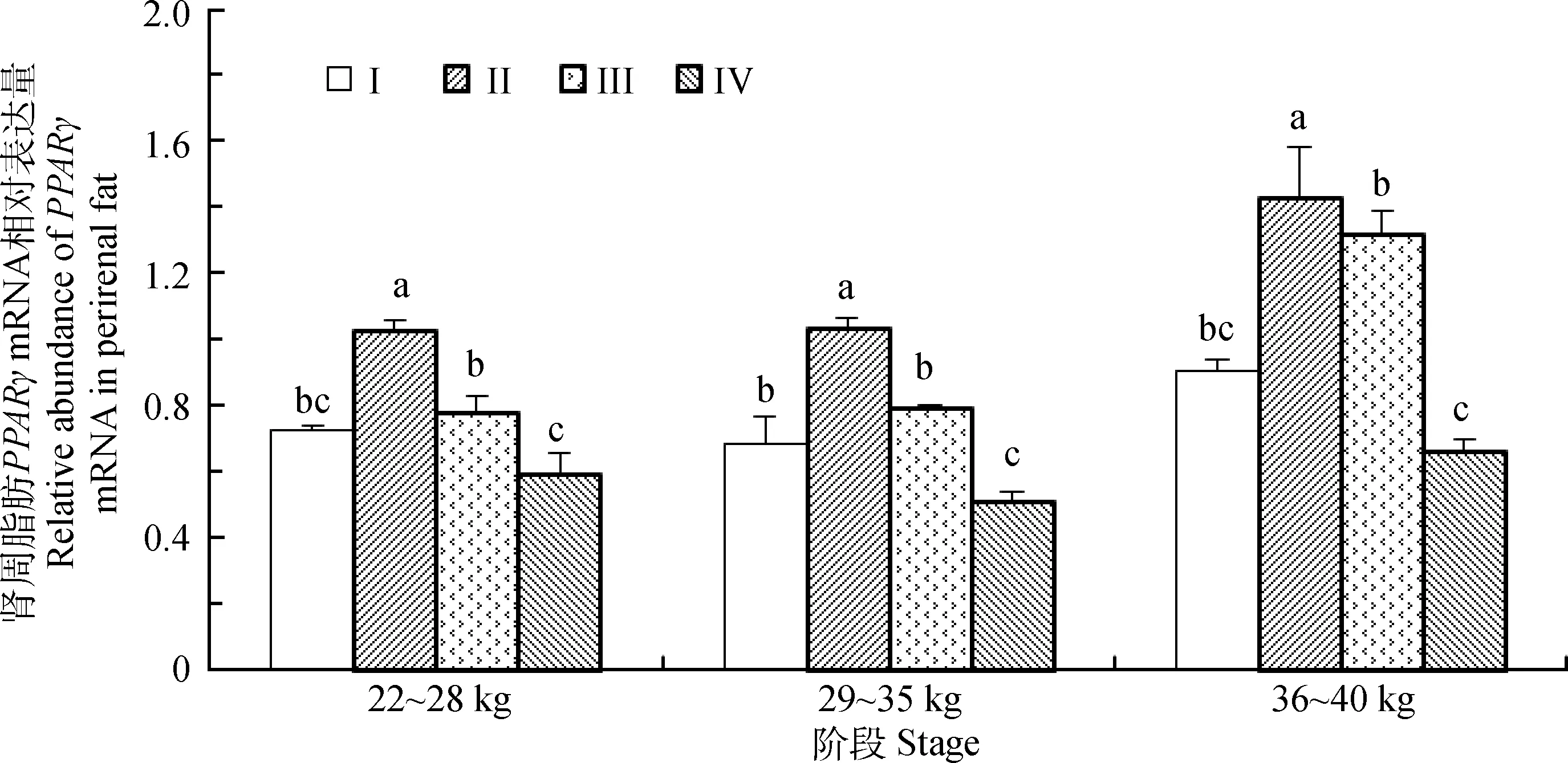
图2 不同营养水平对滩羊肾周脂肪PPARγ mRNA的影响Fig.2 The effect of different nutritional levels on PPARγ mRNA in perirenal fat of Tan sheep

图3 不同营养水平对滩羊皮下脂肪PPARγ mRNA的影响Fig.3 The effect of different nutritional levels on PPARγ mRNA in subcutaneous fat of Tan sheep

图4 不同营养水平对滩羊尾脂FABP4 mRNA的影响Fig.4 The effect of different nutritional levels on FABP4 mRNA in tail fat of Tan sheep

图5 不同营养水平对滩羊肾周脂肪FABP4 mRNA的影响Fig.5 The effect of different nutritional levels on FABP4 mRNA in perirenal fat of Tan sheep
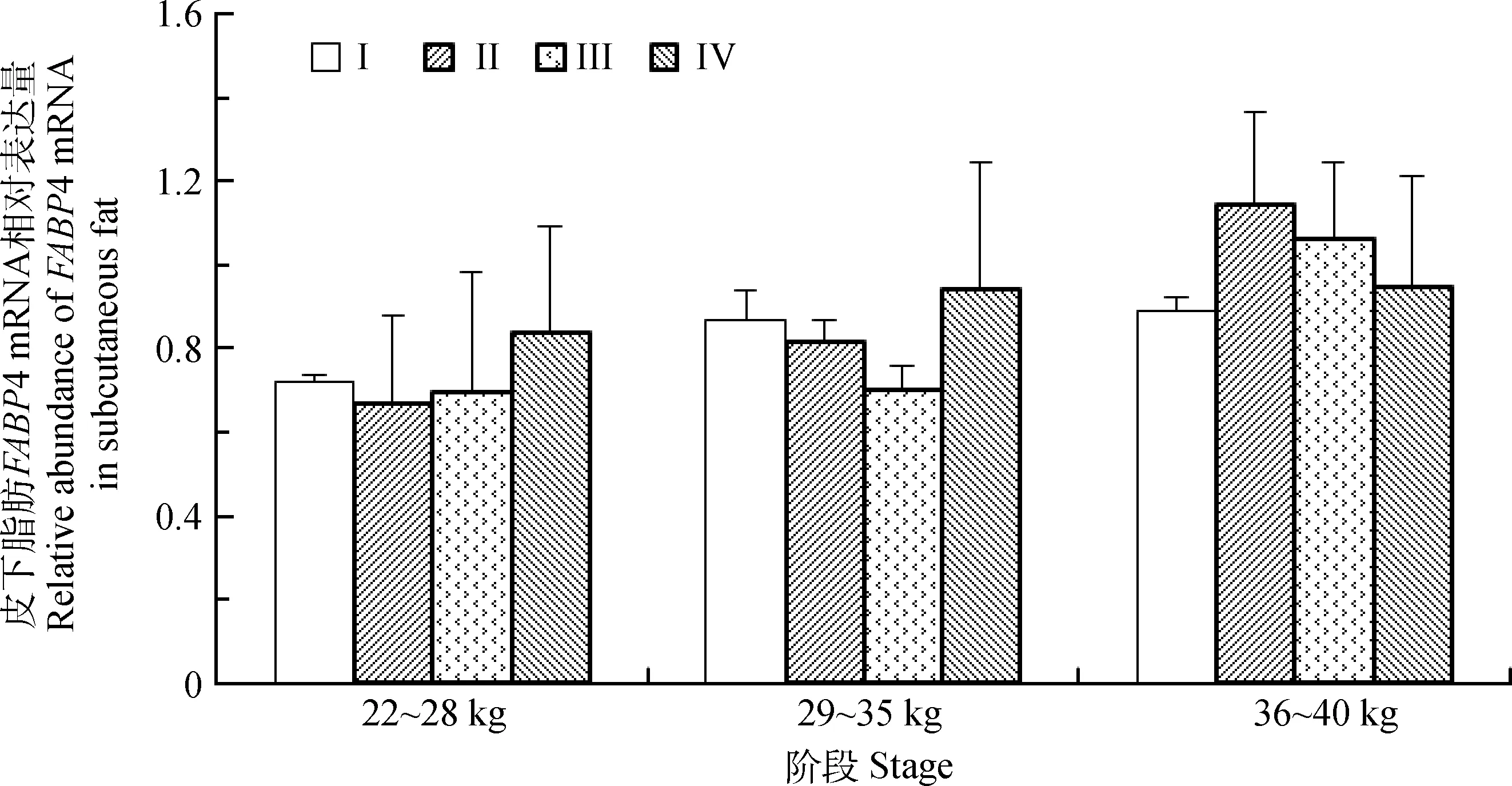
图6 不同营养水平对滩羊皮下脂肪FABP4 mRNA的影响Fig.6 The effect of different nutritional levels on FABP4 mRNA in subcutaneous fat of Tan sheep
3 讨 论
脂肪沉积参与动物营养代谢过程的稳态平衡调控,缓解营养摄入过度造成身体器官的超负荷,必要时脂肪的分解可作为能量供应的主要来源。脂肪组织的生长分为脂肪细胞的增殖(体积的增大)和分化(数量的增加)两方面,其形成是由多种基因参与调控的复杂过程,其中PPARγ和FABP4基因起着不可替代的作用[4-6]。脂尾型绵羊从出生开始就在尾部储存大量脂肪,尾部脂肪占全身脂肪的很大部分。近年来,人们对羊肉的消费观念发生了改变,大脂尾羊的优势在减小,生产者越来越倾向于通过增加整体经济效益来降低成本,而体脂和尾脂的过度沉积会影响羊只出售,因此尾脂尺寸的减小对生产者和消费者来说都是非常可取的[7]。
许多研究表明,日粮能量和蛋白水平影响动物的脂肪沉积。A.Y.Abdullah等[8]研究发现,随着能量水平的增加,黑山羊公羔的机体总脂肪含量和肌内脂肪含量均显著增加。R.M.Lewis等[9]在180只150日龄的绵羊中选择90只作为瘦肉系,未选择的作为对照组,分别饲喂高、中、低 3种蛋白水平日粮,结果显示,随着日粮蛋白质浓度的降低,胴体脂肪含量增加,瘦肉含量下降;且在高蛋白浓度水平,瘦肉系绵羊胴体脂肪含量增加了1.17倍,是对照组的1.10倍。M.Tahmoorespur等[10]研究表明,32日龄肉鸡腹脂率随蛋白水平降低而升高,42和56日龄肉鸡在相同蛋白水平下,腹脂率随能量水平升高而升高。Q.H.Peng等[11]对西门塔尔杂交牛(西门塔尔牛×本地黄牛)研究发现,随着日粮能量浓度的增加,相比于低能组,中能组和高能组肌内脂肪含量分别增加了47.5%(P<0.05)和100%(P<0.01)。H.B.Zhang等[12]对黄牛和西门塔尔牛的杂交品种研究发现,高能组和中能组的平均背膘厚和皮下脂肪百分比显著高于低能组。综上所述,动物的脂肪沉积随能量水平的升高而升高,随蛋白水平的升高而降低。
研究表明,PPARγ参与多条信号通路的调节,在脂肪细胞分化的转录调控网络中居于重要位置[7],PPARγ基因敲除小鼠较对照组的机体脂肪含量显著降低[5],且PPARγ基因在滩羊脂肪组织尤其是尾脂中高表达[3,13]。目前关于营养水平对畜禽PPARγmRNA的表达调控多集中在能量水平,H.B.Zhang等[12]认为,高能量水平能促进脂肪组织中PPARγmRNA的表达,关于蛋白质的影响报道较少,但高蛋白会提高动物机体的热增耗,导致能量的利用率下降,因此蛋白水平可能通过能量途径抑制PPARγmRNA的表达。Q.H.Peng等[11]研究发现,日粮能量浓度可显著上调西门塔尔杂交牛(西门塔尔牛×本地黄牛)脂肪组织中PPARγmRNA表达。S.Zhao等[14]研究发现,高蛋白日粮可显著降低100 kg乌金猪脂肪组织中PPARγmRNA表达水平,促进60 kg乌金猪脂肪组织中PPARγmRNA表达,这可能与乌金猪生长阶段的不同有关。本研究结果显示,随着能量和蛋白水平的升高,PPARγmRNA在滩羊尾脂和肾周脂肪中表达趋势一致,均呈先升高后降低的趋势,这是能量和蛋白共同作用的结果。当蛋白处于较低水平时,能量水平的升高可提高PPARγmRNA的相对表达量;但当蛋白处于较高水平时,会提高动物机体的热增耗,使得机体对能量的相对利用率降低,即使提高能量水平也不能提高PPARγmRNA的相对表达量,反而降低PPARγmRNA表达。FABP4基因敲除小鼠能有效降低血浆甘油三酯和胆固醇水平,从而改善脂质代谢[5]。FABP4基因在阿勒泰羊尾脂中高丰度表达[15]。研究表明,FABP4基因启动子上有PPARγ的反应元件PPRE,PPARγ对于哺乳动物FABP4在脂肪形成中的调节和脂肪组织特异性表达可能有很大作用。本研究中,FABP4 mRNA的表达趋势与PPARγmRNA相同,说明日粮能量和蛋白水平可能通过作用于PPARγ来调控FABP4 mRNA的表达。尾部脂肪和肾周脂肪的研究结果均显示,PPARγ和FABP4 mRNA的相对表达量均呈先升高后降低的趋势,在最接近标准日粮的II组达到最高值,说明能量蛋白的过高或过低都可能会造成机体营养物质的代谢异常,从而降低脂肪沉积的速率。
P.A.Lopes等[16]在对日粮不同蛋白水平下瘦肉型和脂肪型猪的脂肪沉积研究中发现,猪的皮下脂肪沉积很大程度上取决于猪的基因型,而并非日粮蛋白水平,在日粮蛋白减小的情况下,皮下脂肪中PPARγ和FABP4 mRNA的相对表达量差异不显著。本研究结果表明,不同生长阶段,PPARγ和FABP4 mRNA在滩羊皮下脂肪中相对表达量差异不显著,说明营养水平对滩羊皮下脂肪中PPARγ和FABP4 mRNA的表达影响较小。皮下脂肪属于浅层脂肪组织,相较于肾周脂肪(深层脂肪)沉积较早。可以认为动物的体脂沉积先在皮下脂肪中沉积饱和,之后过多的能量蛋白转换为脂肪沉积于动物腹部、内脏和肌间。张小丽[17]在对猪背部深层脂肪组织和浅层脂肪组织的研究中发现,与深层脂肪相比,浅层脂肪较致密,脂肪细胞直径长、体积大。吕刚[18]研究发现,营养和生长阶段对肉鸭腹脂的影响高于皮下脂肪。这说明深层和浅层脂肪组织在代谢活动中是存在明显差异的,所以本试验PPARγ和FABP4 mRNA在皮下脂肪与肾周脂肪中表达规律不同。而尾脂PPARγ和FABP4 mRNA的表达在不同能量和蛋白水平间存在差异,且受生长阶段、能量和蛋白互作的影响,说明尾脂具有可调控性,因此通过营养调控滩羊尾脂沉积是个潜在措施,具体机理有待进一步研究。
4 结 论
日粮能量和蛋白水平对滩羊尾部脂肪和肾周脂肪中PPARγ和FABP4 mRNA表达有显著影响,对皮下脂肪中PPARγ和FABP4 mRNA表达无显著影响。日粮能量和蛋白水平对滩羊深层脂肪组织(肾周脂肪)中PPARγ和FABP4 mRNA表达的影响大于浅层脂肪组织(皮下脂肪),对尾部脂肪组织中PPARγ和FABP4 mRNA的表达有影响。
[1] GARIN-SHKOLNIK T, RUDICH A, HOTAMISLIGIL G S, et al. FABP4 attenuates PPARgamma and adipogenesis and is inversely correlated with PPARgamma in adipose tissues[J].Diabetes, 2014, 63(3): 900-911.
[2] BAKHTIARIZADEH M R, MORADI-SHAHRBABAK M, EBRAHIMIE E. Underlying functional genomics of fat deposition in adipose tissue[J].Gene, 2013, 521(1): 122-128.
[3] XU X, WEI X, YANG Y, et al. PPAR gamma, FAS, HSL mRNA and protein expression during Tan sheep fat-tail development[J].ElectronJBiotechnol, 2015, 18(2): 122-127.
[4] UYSAL K T, SCHEJA L, WIESBROCK S M, et al. Improved glucose and lipid metabolism in genetically obese mice lacking aP2[J].Endocrinology, 2000, 141(9): 3388-3396.
[5] JONES J R, BARRICK C, KIM K A, et al. Deletion of PPARgamma in adipose tissues of mice protects against high fat diet-induced obesity and insulin resistance[J].ProcNatlAcadSciUSA, 2005, 102(17): 6207-6212.
[6] TONTONOZ P, SPIEGELMAN B M. Fat and beyond: The diverse biology of PPAR gamma[J].AnnuRevBiochem, 2008, 77: 289-312.
[7] MORADI M H, NEJATI-JAVAREMI A, MORADI-SHAHRBABAK M, et al. Genomic scan of selective sweeps in thin and fat tail sheep breeds for identifying of candidate regions associated with fat deposition[J].BMCGenet, 2012, 13: 10.
[8] ABDULLAH A Y, MUSALLAM H. Effect of different levels of energy on carcass composition and meat quality of male black goats kids[J].LivestSci, 2007, 107(1): 70-80.
[9] LEWIS R M, EMMANS G C, SIMM G. Effects of index selection on the performance and carcass composition of sheep given foods of different protein concentrations ad libitum[J].AnimSci, 2004, 78(2): 203-212.
[10] TAHMOORESPUR M, GHAZANFARI S, NOBARI K. Evaluation of adiponectin gene expression in the abdominal adipose tissue of broiler chickens: Feed restriction, dietary energy, and protein influences adiponectin messenger ribonucleic acid expression[J].PoultSci, 2010, 89(10): 2092-2100.
[11] PENG Q H, WANG Z S, TAN C, et al. Effects of different pomace and pulp dietary energy density on growth performance and intramuscular fat deposition relating mRNA expression in beef cattle[J].JFoodAgricEnviron, 2012, 10(1): 404-407.
[12] ZHANG H B, ZHANG X F, WANG Z S, et al. Effects of dietary energy level on lipid metabolism-related gene expression in subcutaneous adipose tissue of Yellow breed × Simmental cattle[J].AnimSciJ, 2015, 86(4): 392-400.
[13] XU X, WEI X, YANG Y, et al. mRNA transcription and protein expression of PPAR, FAS, and HSL in different parts of the carcass between fat-tailed and thin-tailed sheep[J].ElectronJBiotechnol, 2015, 18(3): 215-220.
[14] ZHAO S, WANG J, SONG X, et al. Impact of dietary protein on lipid metabolism-related gene expression in porcine adipose tissue[J].NutrMetab(Lond), 2010, 7: 6.
[15] 许瑞霞, 高 磊, 赵伟利, 等.FABP4基因在阿勒泰羊尾脂沉积与代谢模型中的表达变化规律[J]. 遗传, 2015,37(2): 174-182.
XU R X, GAO L, ZHAO W L, et al. Analysis ofFABP4 expression pattern in rump fat deposition and metabolism of Altay sheep[J].Hereditas(Beijing), 2015,37(2): 174-182.(in Chinese)
[16] LOPES P A, COSTA A S, COSTA P, et al. Contrasting cellularity on fat deposition in the subcutaneous adipose tissue and longissimus lumborum muscle from lean and fat pigs under dietary protein reduction[J].Animal, 2014, 8(4): 629-637.
[17] 张小丽. 猪背部浅层和背部深层脂肪组织全基因组甲基化研究[D]. 雅安:四川农业大学, 2013.
ZHANG X L. Genome-wide DNA methylation changes between the superficial and deep backfat tissues of the pig[D]. Ya’an:Sichuan Agricultural University, 2013. (in Chinese)
[18] 吕 刚. 不同饲喂方式下肉鸭体脂沉积规律及机制研究[D]. 雅安:四川农业大学, 2011.
LV G. The fat deposition of meat-type duck under different feeding forms and its mechanism[D]. Ya’an:Sichuan Agricultural University, 2011. (in Chinese)
(编辑 郭云雁)
Effects of Diet Energy and Protein Levels on the mRNA Expression ofPPARγandFABP4 in Adipose Tissues of Tan Sheep
WANG Xiao-fang, ZENG Jie, TIAN Chong-qi, WANG Xiao-long,YANG Yu-xin, CHEN Yu-lin,ZHANG En-ping*
(CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling712100,China)
The objective of this study was to research the effects of diet energy and protein levels on the mRNA expression of peroxisome proliferator-activated receptor γ(PPARγ) and fatty acid binding protein 4(FABP4) in the adipose tissues of Tan sheep. A total of 112(56♂,56♀) healthy Tan sheep with similar body weight were selected and allocated randomly to 4 groups(4 replicates in each group, and 7 sheep in each replicate). 3 stages(22-28, 29-35, 36-40 kg) was classified, and standard diets for each stage were designed according to body weight and expected daily gain in sheep feeding standard of NY/T(816-2004), 4 diets with energy and protein levels of 0.84×Standard(group I), 0.96×Standard(group II), 1.08×Standard(group III), 1.20×Standard(group IV) were assigned to feed sheep in each group, respectively. At the end of each stage, one sheep from each replicate was slaughtered, and samples of tail fat, perirenal fat and subcutaneous fat were collected for analyzing the mRNA expression ofPPARγandFABP4 by Real-time quantitative PCR. The results showed as follows: In tail fat,PPARγandFABP4 mRNA expression levels was significantly higher in group II than other groups at the end of stage 22-28 and 36-40 kg(P<0.05);FABP4 mRNA expression levels was highest in group II, and lowest in group IV at the end of stage 29-35 kg(P<0.05). In perirenal fat,PPARγmRNA expression levels was significnatly higher in group II, and significantly lower in group IV compared with group III at the end of 3 stages(P<0.05).FABP4 mRNA expression levels was higher in group II and III at the end of stage 22-28 kg(P<0.05);FABP4 mRNA expression levels was higher in group II compared with group IV at the end of stage 29-35 kg(P<0.05);FABP4 mRNA expression levels was higher in group I and II at the end of stage 36-40 kg(P<0.05). In subcutaneous fat, there was no significant difference between different groups at the end of 3 stages(P>0.05). These results indicated that the effect of diet energy and protein levels onPPARγandFABP4 mRNA expression was greater in deep fat tissue(perirenal fat) than that in superficial fat tissue(subcutaneous fat) in Tan sheep. The diets with different energy and protein levels had an effect onPPARγandFABP4 mRNA expression of tail fat in Tan sheep.
Tan sheep; energy and protein levels; adipose tissues;PPARγ;FABP4
10.11843/j.issn.0366-6964.2016.11.014
2016-01-27
国家自然科学基金(31072060);国家绒毛用羊产业技术体系(CARS-40-13)
王小芳(1991-),女,陕西渭南人,硕士生,主要从事动物营养与饲料科学研究,E-mail:15291849429@163.com
*通信作者:张恩平,教授,硕士生导师,主要从事动物营养与饲料科学研究,E-mail:zep126@126.com
S826;S816.4
A
0366-6964(2016)11-2266-08

