副猪嗜血杆菌potD基因缺失株的构建及其部分生物学特性
谨 瑾,张禄滑,文心田,李 英,代 科,周 鹏,2,赵玉佳,曹三杰,黄小波,伍 锐,赵 勤,文翼平*
(1.四川农业大学 动物医学院 猪病研究中心,成都 611130;2.四川省攀枝花市农牧局,攀枝花 617000)
副猪嗜血杆菌potD基因缺失株的构建及其部分生物学特性
谨 瑾1,张禄滑1,文心田1,李 英1,代 科1,周 鹏1,2,赵玉佳1,曹三杰1,黄小波1,伍 锐1,赵 勤1,文翼平1*
(1.四川农业大学 动物医学院 猪病研究中心,成都 611130;2.四川省攀枝花市农牧局,攀枝花 617000)
potD基因编码的蛋白质作为转运体蛋白,负责多胺的结合和转运,为细胞的正常生长提供必需因子,已在多种病原菌中鉴定为毒力相关因子,但在副猪嗜血杆菌中的作用还不清楚。利用自然转化法构建potD缺失株SC1401ΔpotD::kan,再比较亲本株和缺失株的生长特性、自凝集活性、生物被膜形成能力、抗血清杀菌能力以及对小鼠的致病力。结果显示potD基因的缺失不影响副猪嗜血杆菌的生长、自凝集活性和生物被膜形成能力,但导致该菌的抗血清杀菌能力和对小鼠的致病力显著降低。以上结果表明potD基因可能与副猪嗜血杆菌的毒力相关。
副猪嗜血杆菌;potD;毒力;自然转化;缺失株
副猪嗜血杆菌(Haemophilusparasuis,HPS)属于巴氏杆菌科(Pasteurellaceae),是Glässer’s病的病原,给我国乃至世界养猪业造成了巨大的经济损失[1]。目前,已报道该菌有15种血清型,不同血清型之间、甚至同一血清型的不同菌株之间,往往呈现出较大的毒力差异[2]。因此,区分毒力和非毒力菌株,并鉴定新的毒力因子对于副猪嗜血杆菌病的准确诊断和有效控制起着积极的作用。
多胺(如腐胺、亚精胺等)是细胞正常生长的必需因子,细菌主要通过转运体转运来获取该物质。目前研究较为清楚的是PotABCD转运体,其中PotD作为底物结合蛋白,负责多胺的结合和转运[3]。在小鼠感染模型中,肺炎链球菌potD基因的缺失导致该菌毒力显著降低[4]。在大肠杆菌中,potD基因编码的蛋白质具有促进生物被膜形成的功能[5]。在嗜肺军团菌中,potD基因的缺失导致该菌对Na+高度敏感,并且对宿主细胞的黏附性降低[6]。但是,potD基因在HPS致病过程中的作用还不清楚。
本试验通过自然转化法,构建HPS SC1401菌株的potD基因缺失株,并对其生长特性、自凝集状况、生物被膜形成能力、抗血清杀菌能力以及对小鼠的毒力进行研究,以确定potD基因在HPS致病过程中的作用。
1 材料与方法
1.1 菌株、质粒及试剂
副猪嗜血杆菌SC1401野毒株由四川农业大学动物医学院猪病研究中心分离、鉴定并保存;质粒pKD4购自耶鲁大学菌种保藏中心;胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)购自美国BD公司;小牛血清购自Gibco公司。兔抗PotD血清、Hucker结晶紫溶液、新鲜猪血清均为作者实验室制备或保存。
1.2 引物设计
根据GenBank (CP001321.1) 公布的HPS SH0165菌株基因组中potD序列,利用软件Primer Premier 5.0设计基因缺失及鉴定引物(表1)。potD-L1/L2用于扩增上游同源臂,potD-R1/R2用于扩增下游同源臂,Kan-L/R用于从质粒pKD4扩增卡那抗性基因,potD-L/R用于potD基因的检测。引物由成都擎科梓熙生物技术有限公司合成。
表1 本研究所用的引物序列
Table 1 Primers used in this study
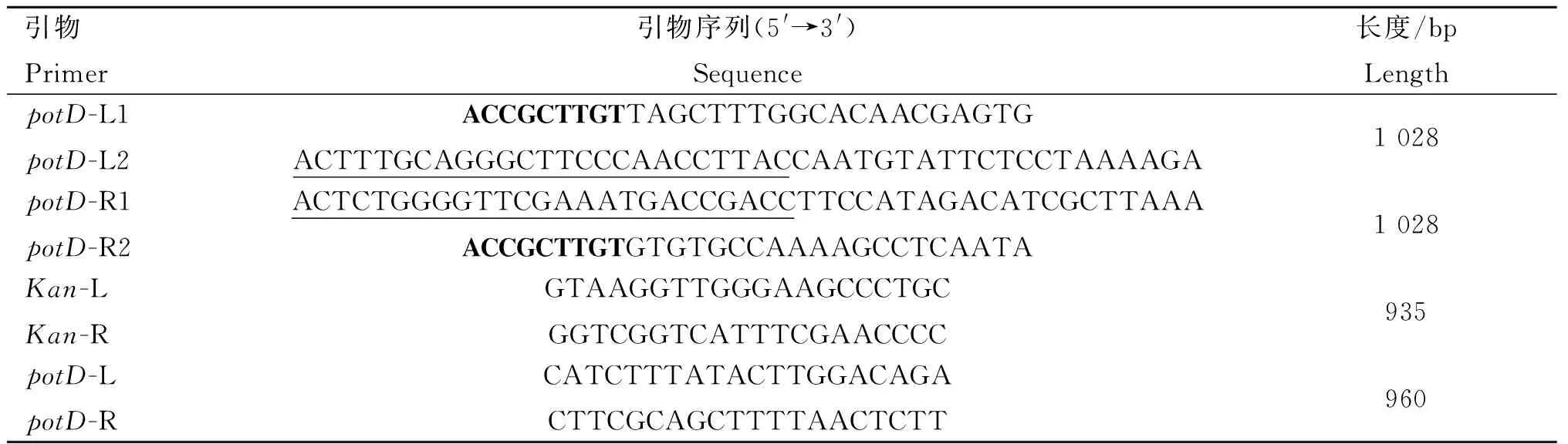
引物Primer引物序列(5'→3')Sequence长度/bpLengthpotD-L1potD-L2ACCGCTTGTTAGCTTTGGCACAACGAGTGACTTTGCAGGGCTTCCCAACCTTACCAATGTATTCTCCTAAAAGA1028potD-R1potD-R2ACTCTGGGGTTCGAAATGACCGACCTTCCATAGACATCGCTTAAAACCGCTTGTGTGTGCCAAAAGCCTCAATA1028Kan-LKan-RGTAAGGTTGGGAAGCCCTGCGGTCGGTCATTTCGAACCCC935potD-LpotD-RCATCTTTATACTTGGACAGACTTCGCAGCTTTTAACTCTT960
用于融合PCR扩增的25 bp重叠区域用下划线标识,HPS的USS序列用粗体字标识
The 25 bp extensions required for In-Fusion PCR are underlined. The USS ofH.parasuisis indicated in bold text
1.3 potD基因缺失融合片段的构建
提取菌株SC1401基因组,分别扩增potD基因上、下游同源臂和卡那霉素抗性基因,产物胶回收后,利用引物对potD-L1/potD-R2通过overlap-PCR将potD基因上、下游同源臂和卡那抗性基因融合,得到Up-Kan-Down片段,用于后续缺失株的构建。
1.4 potD缺失株的构建、筛选及鉴定
potD缺失株的构建参照已优化的自然转化方法[7]。从TSA平板挑取自然感受态菌株SC1401,重悬于TSB,调整菌液浓度为5×1010·mL-1。将20 μL菌液和1 μg Up-Kan-Down片段混匀后,点样于TSA平板,37 ℃孵育5 h。之后将细菌重悬于TSB中,适当稀释后涂布于含50 μg·mL-1卡那霉素的TSA平板,37 ℃培养2~3 d。在抗性平板上生长菌落通过PCR进行鉴定,PCR鉴定阳性菌再利用兔抗PotD血清做进一步的Western blot鉴定,最终获得缺失株SC1401ΔpotD::kan。
1.5 potD缺失株生长曲线的绘制
分别挑取亲本株和缺失株单菌落于5 mL TSB培养基中,37 ℃培养过夜。第2天,以1 ∶100倍稀释到新鲜TSB培养基中,在37 ℃ 200 r·min-1继续培养,每个样本设置3个重复。测定菌液OD600 nm值,将结果绘制成生长曲线。
1.6 细菌自凝集试验
根据已报道的自凝集试验方法[8],从TSA平板挑取单菌落接种于10 mL TSB培养液中,培养16 h。离心收集菌体并重悬于新鲜TSB培养液至OD600 nm为大约0.6,室温静置,每30 min测定一次悬浮液的吸光度,测定4 h。
1.7 生物被膜形成试验
取1 mL TSB培养液加入试管中,接种细菌后于37 ℃培养16 h,转速为150 r·min-1。之后吸出菌液,加入1.5 mL Hucker结晶紫溶液,室温染色5 min。吸出染液,并用水洗去多余染料。干燥后,用1 mL 33%的醋酸溶解,测定OD630 nm。以无菌TSB培养液试管的OD630 nm值为阴性对照,以2倍阴性对照OD值为截断值判断生物被膜的形成。每个样本至少进行3次重复。
1.8 抗血清杀菌试验
根据已报道的抗血清杀菌试验方法[9],取100 μL细菌菌液(约1×108CFU·mL-1),分别和100 μL新鲜猪血清(采集健康猪全血,4 ℃静置过夜,吸取析出的血清,4 000 r·min-1离心10 min以除去残留的红细胞,无菌条件分装后于-20 ℃保存备用)或56 ℃灭活(56 ℃,30 min,并随时摇晃均匀)的猪血清混合,在37 ℃下振荡培养1 h,之后10倍倍比稀释涂于TSA平板,进行细菌计数。细菌存活率为新鲜血清中细菌存活数除以灭活血清中细菌存活数。每个样本至少进行3次重复。
1.9 小鼠毒力试验
6~8周龄雌性BALB/c小白鼠购买于成都达硕公司,所有小鼠均提供充足的食物和水。将小白鼠随机分成3组,每组10只。1、2组分别腹腔注射亲本株和缺失株,剂量为1.4×109CFU·只-1。第3组为对照组,注射PBS。观察7 d内小鼠死亡情况。
1.10 数据分析
试验数据使用GraphPad PRISM 5.0软件分析,当两个试验组进行比较时使用t检验分析,当三个或更多试验组进行比较时使用ANOVA分析。P<0.05时判定为显著性差异。
2 结 果
2.1 potD基因上下同源臂、抗性基因的PCR扩增与融合
用potD-L1/L2与potD-R1/R2两对引物扩增副猪嗜血杆菌SC1401菌株的相应目的条带,大小均为1 028 bp;用Kan-L/R从质粒pKD4上扩增卡那霉素抗性基因,大小为935 bp;通过overlap-PCR获得potD基因上、下游同源臂和卡那霉素抗性基因融合片段,即Up-Kan-Down,大小为2 941 bp(图1)。
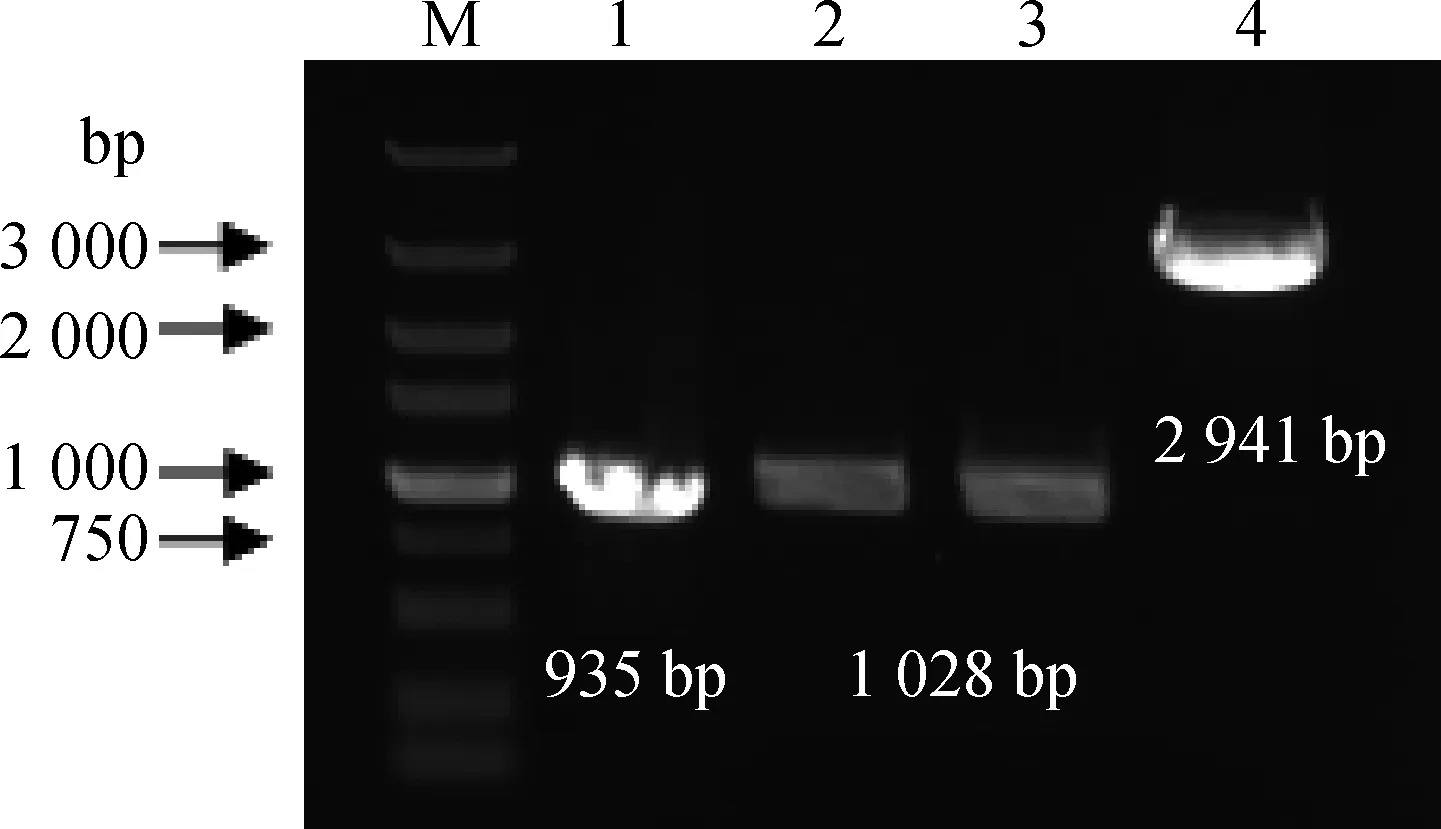
M.DNA相对分子质量标准;1.卡那霉素抗性基因片段;2.上游同源臂臂;3.下游同源臂;4.Up-Kan-Down片段M. DNA marker;1. Kan fragment;2. Upstream homologous arm;3. Downstream homologous arm; 4. Up-Kan-Down fragment图1 potD 同源臂的扩增与融合Fig.1 The amplification and overlap extension of homologous arm by PCR
2.2 缺失株SC1401ΔpotD::kan的鉴定
当使用引物potD-L/R检测时,亲本株产生条带,大小为960 bp,缺失株不产生条带,当使用引物Kan-L/R检测时,亲本株不产生条带,缺失株产生条带,大小为935 bp(图2A)。PCR鉴定正确后,再利用兔抗PotD血清进一步做Western blot鉴定,结果显示,亲本株菌体蛋白质可产生条带,缺失株无条带(图2B)。
2.3 缺失株SC1401ΔpotD::kan的生长特性
结果表明,在37 ℃条件下,亲本株SC1401和缺失株SC1401ΔpotD::kan的生长状况差异不显著(P>0.05),即potD基因对该菌的生长无明显调控作用(图3)。
2.4 亲本株和缺失株自凝集活性和生物被膜形成能力比较
自凝集试验结果显示,亲本株和缺失株自凝集现象均不明显,且彼此间差异不显著(P>0.05)(图4A)。生物被膜形成试验的结果显示,亲本株和缺失株均为强生物被膜形成菌株(其OD630 nm值均大于阴性对照OD630 nm值2倍以上),但二者生物被膜形成能力无显著差异(P>0.05)(图4B)。

A.PCR鉴定:M. DNA相对分子质量标准;1~3,引物potD-L/R鉴定;4~6.引物Kan-L/R鉴定;1、4.亲本菌;2、5.突变株;3、6.阴性对照。B.免疫印迹鉴定:1.亲本菌;2.突变株A. Identification by PCR: M. DNA marker; 1-3. Identification with primers potD-L/R; 4-6. Identification with primers Kan-L/R; 1, 4. SC1401; 2, 5. SC1401 ΔpotD::kan; 3, 6. Negative control; B. Identification by Western blot: 1. SC1401; 2. SC1401 ΔpotD::kan图2 potD缺失株的鉴定Fig.2 Identification of the mutant strain SC1401 ΔpotD::kan
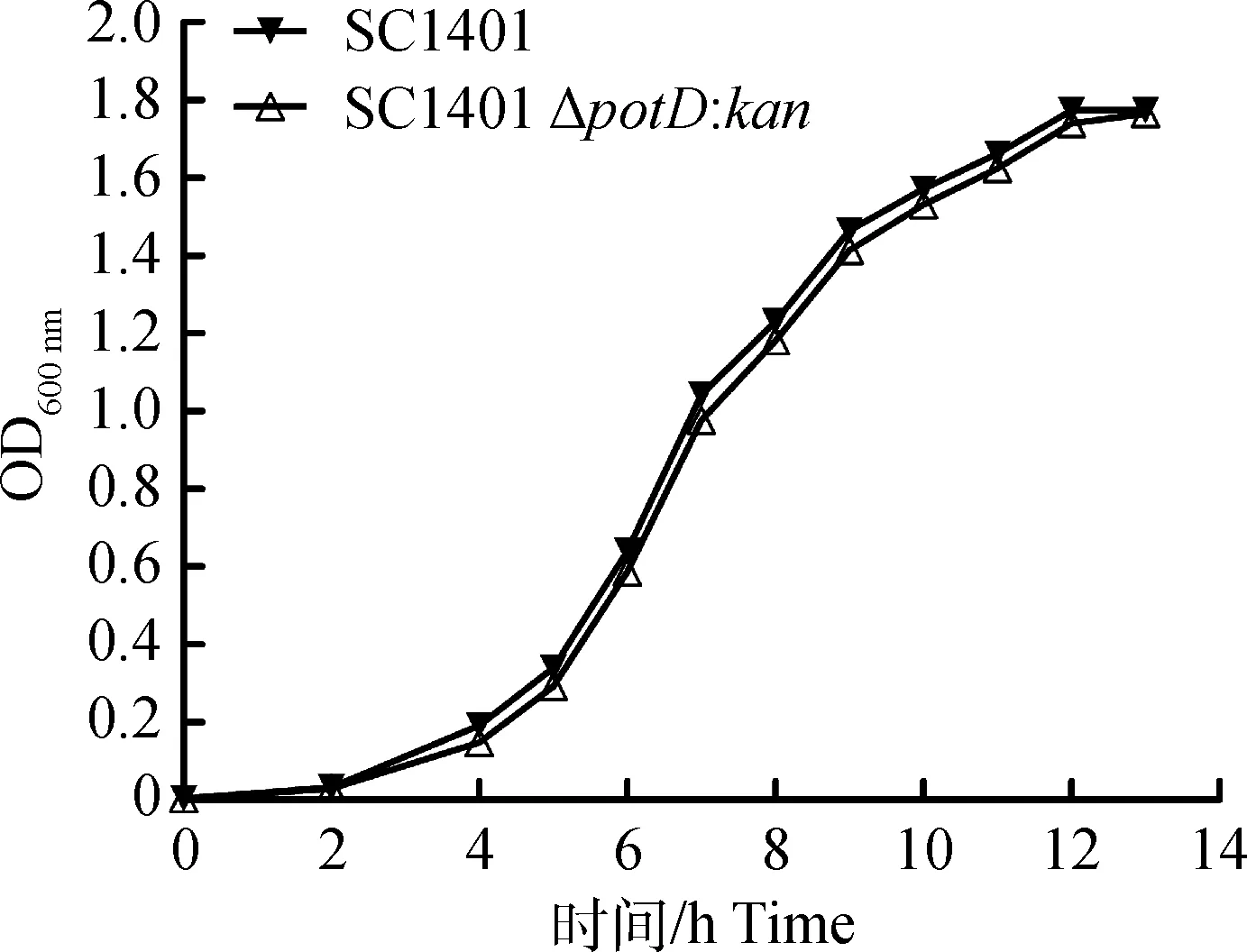
该试验进行3次重复,每次重复设3个平行组,生长曲线代表其中一次重复试验The experiments were performed three times independently in triplicates. The representative growth curve from one of three independent experiments is shown图3 SC1401和SC1401 ΔpotD::kan生长曲线Fig.3 The growth curves of SC1401 and SC1401 ΔpotD::kan
2.5 亲本株和缺失株抗血清杀菌能力比较
结果显示,在50%血清中,亲本株SC1401具有较高水平的抗血清杀菌能力,而缺失株SC1401ΔpotD::kan抗血清杀菌能力显著降低(P<0.05)(图5)。结果表明potD基因的缺失降低了HPS抗血清杀菌能力。
2.6 亲本株和缺失株对小鼠毒力的比较
小鼠毒力试验显示,亲本株攻毒后1 d,死亡率已达到70%,第2天全部死亡,而缺失株攻毒后7 d,死亡率仅为30%,表明potD基因的缺失导致HPS对小鼠的致病力减弱(图6)。
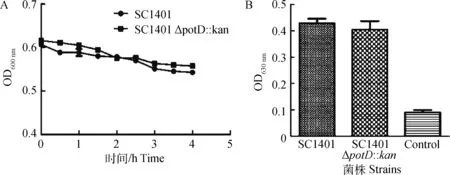
试验进行3次重复,每次重复设3个平行组。该结果代表其中一次重复(A)。误差线代表3次重复试验的标准差(B)The experiments were performed three times independently in triplicates. The representative result from one of three independent experiments is shown (A). Error bars represent the standard deviations of three independent experiments (B)图4 SC1401和SC1401 ΔpotD::kan自凝集活性及生物被膜的形成Fig.4 The autoagglutination and biofilm formation of SC1401 and SC1401 ΔpotD::kan

试验进行3次重复,每次重复设3个平行组,误差线代表3次重复试验的标准差The experiments were performed three times independently in triplicates. Error bars represent the standard deviations of three independent experiments图5 SC1401和SC1401 ΔpotD::kan在50%猪血清中的存活率Fig.5 Survival of SC1401 and SC1401 ΔpotD::kan treated with 50% porcine serum
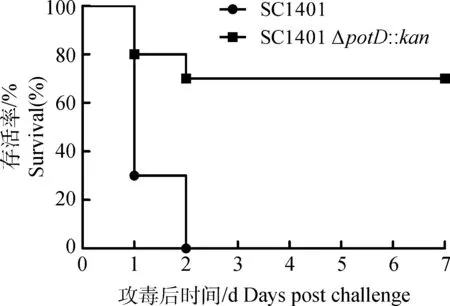
采用log-rank检验比较亲本株SC1401和缺失株SC1401 ΔpotD::kan对小鼠的毒力,差异显著(P<0.05)P<0.05 when comparing the mouse survival rate infected by SC1401 versus SC1401 ΔpotD::kan using the log-rank test图6 SC1401和SC1401 ΔpotD::kan对小鼠毒力的比较Fig.6 Survival rates of mice inoculated with either SC1401 or SC1401 ΔpotD::kan
3 讨 论
21世纪以来,利用同源重组的方法构建基因缺失株的应用越来越普遍,以同源重组为基础构建基因缺失株有几种不同的方法,应用最多的就是同源重组质粒的自然转化、电转化和接合转移[10]。自然转化(natural transformation)是指在自然条件下,细菌能够主动摄取外源DNA 并将其整合进自己的染色体中稳定遗传的过程[11-12]。自1928年首次发现肺炎链球菌转化以来,细菌自然遗传转化现象已在多种细菌中发现[13-14]。巴斯德菌属的很多细菌都被证实具有自然转化能力,副猪嗜血杆菌作为巴斯德菌属的一员也不例外[7]。在自然生长环境中,细菌通过自然转化获得新的遗传性状,如耐药性、致病性。2005年,A. Bigas等建立了副猪嗜血杆菌自然转化的试验方法作为HPS一种基因操作系统用以研究毒力相关基因的功能[15]。自此,自然转化在副猪嗜血杆菌上的应用越来越广泛,也使副猪嗜血杆菌基因功能的研究变得越来越便利。
为研究potD基因在HPS中的作用,作者首先采用自然转化法敲除potD基因。目前,自然转化法作为一种有效的基因缺失方法在HPS中得到普遍采用。该方法首先将目的基因左、右同源臂和抗性基因进行融合,再与自杀性质粒连接,重组质粒再进行自然转化,达到基因缺失的目的[16-17]。连接自杀质粒的主要目的在于保护同源臂免受宿主酶系统剪切。因此,为简化步骤,作者延长同源臂长度至1 000 bp,但不连接自杀质粒,直接用融合片段进行自然转化,最终成功获得了缺失株。该试验结果证实了之前的猜想。
亲本株和potD缺失株的生长状况无显著变化,表明potD基因的缺失对HPS的生长未造成影响,这和之前的报道一致[4]。生物被膜是病原微生物产生耐药性、免疫逃逸和持续感染的重要原因之一。研究发现potD基因的缺失对HPS生物被膜的形成未产生影响,这与之前的研究结果有所不同[5]。通过生物信息学分析发现,在HPS基因组中,还存在另一个可能具有与potD类似功能的基因,该基因所编码蛋白功能的发挥补充了potD基因缺失所带来的影响。抗血清杀菌作用作为病原菌的一种免疫逃逸机制,是病原菌借以抵抗宿主杀伤,并引起全身性感染的有力工具。本研究显示potD基因的缺失引起HPS抗血清杀菌能力显著降低,并导致HPS对小鼠致病力减弱,但该影响机制还有待进一步研究。
4 结 论
PotD基因的缺失不影响HPS的生长状况、自凝集活性和生物被膜形成能力,但导致该菌的抗血清杀菌能力和对小鼠的致病力降低。PotD基因可能与HPS的毒力相关。
[1] XU Z, YUE M, ZHOU R, et al. Genomic characterization ofHaemophilusparasuisSH0165,a highly virulent strain of serovar 5 prevalent in China[J].PLoSOne, 2011, 6(5): e19631.
[2] TURNI C, BLACKALL J. Comparison of the indirect haemagglutination and gel diffusion test for serotypingHaemophilusparasuis[J].VetMicrobiol, 2005, 106(1-2): 145-151.
[3] ZHANG L H, WEN Y P, LI Y, et al. Comparative proteomic analysis of the membrane proteins of twoHaemophilusparasuisstrains to identify proteins that may help in habitat adaptation and pathogenesis[J].ProteomeSci, 2014, 12: 38.
[4] WARE D, JIANG Y, LIN W, et al. Involvement ofpotDinStreptococcuspneumoniaepolyamine transport and pathogenesis[J].InfectImmun, 2006, 74(1): 352-361.
[5] ZHANG X, ZHANG Y, LIU J, et al. PotD protein stimulates biofilm formation byEscherichiacoli[J].BiotechnolLett, 2013, 35(7): 1099-1106.
[6] NASRALLAH G K, ABDELHADY H, TOMPKINS N P, et al. Deletion ofpotD, encoding a putative spermidine-binding protein, results in a complex phenotype inLegionellapneumophila[J].IntJMedMicrobiol, 2014, 304(5-6): 703-716.
[7] ZHANG L H, LI Y, DAI K, et al. Establishment of a successive markerless mutation system inHaemophilusparasuisthrough natural transformation[J].PLoSOne, 2015, 10(5): E0127393.
[8] ZOU Y, FENG S, XU C, et al. The role ofgalUandgalEofHaemophilusparasuisSC096 in serum resistance and biofilm formation[J].VetMicrobiol, 2013, 162(1): 278-284.
[9] ZHANG B, FENG S, XU C, et al. Serum resistance inHaemophilusparasuisSC096 strain requires outer membrane protein P2 expression[J].FEMSMicrobiolLett, 2012, 326(2): 109-115.
[10] JOHNSBORG O, ELDHOLM V, HÅVARSTEIN L S. Natural genetic transformation: prevalence, mechanisms and function[J].ResMicrobiol, 2007, 158(10): 767-778.
[11] MERCIER A, BERTOLLA F, PASSELGUE-ROBE E, et al. Influence of DNA conformation and role ofcomAandrecAon natural transformation inRalstoniasolanacearum[J].CanJMicrobiol, 2009, 55(6): 762-770.
[12] REDFIELD R J, FINDLAY W A, BOSSé J, et al. Evolution of competence and DNA uptake specificity in thePasteurellaceae[J].BMCEvolBiol, 2006, 6: 82.
[13] 孙东昌,张衍梅,施跃峰. 细菌自然转化的分子机制研究进展[J]. 微生物学报, 2012, 52(1): 6-11.
SUN D C, ZHANG Y M, SHI Y F. Advances in the molecular mechanism of natural bacterial transformation[J].ActaMicrobiologicaSinica, 2012, 52(1): 6-11. (in Chinese)
[14] BOSSÉ J T, SINHA S, SCHIPPERS T, et al. Natural competence in strains ofActinobacilluspleuropneumoniae[J].FEMSMicrobiolLett, 2009, 298(1): 124-130.
[15] BIGAS A, GARRIDO M E, DE ROZAS A M , et al. Development of a genetic manipulation system forHaemophilusparasuis[J].VetMicrobiol, 2005, 105(3-4): 223-228.
[16] HE L Q, WEN X T, YAN X F, et al. Effect ofcheYdeletion on growth and colonization in aHaemophilusparasuisserovar 13 clinical strain EP3[J].Gene, 2015, 577(1): 96-100.
[17] 曾 泽,何 欢,岳 华,等. 副猪嗜血杆菌lgtF基因缺失株的构建及其部分生物学特性[J]. 畜牧兽医学报, 2015, 46(11): 2056-2062.
ZENG Z, HE H, YUE H, et al. Construction and characterization of aHaemophilusparasuisSC096 ΔlgtFmutant strain.[J].ActaVeterinariaetZootechnicaSinica, 2015, 46(11): 2056-2062. (in Chinese)
(编辑 白永平)
Construction and Characterization of aHaemophilusparasuispotDMutant Strain
JIN Jin1, ZHANG Lu-hua1, WEN Xin-tian1,LI Ying1, DAI Ke1, ZHOU Peng1,2, ZHAO Yu-jia1,CAO San-jie1, HUANG Xiao-bo1, WU Rui1, ZHAO Qin1, WEN Yi-ping1*
(1.ResearchCenterofSwineDisease,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China; 2.PanzhihuaBureauofAgricultureandAnimalHusbandry,Panzhihua617000,China)
As a transporter, protein encoded bypotDis involved in the binding and transportation of polyamine, which is necessary for the growth of cells. In some pathogens, the protein is identified as a virulence-associated factor, but of which the function is still unclear inHaemophilusparasuis. ApotDmutant strain SC1401ΔpotD::kanwas constructed by the natural transformation method. The growth curve, the ability of autoagglutination and biofilm formation, serum resistance ability and the virulence to mice of the parental strain SC1401 andpotDmutant strain were measured. No significant difference was observed between the parental and mutant strains in the growth curve and the ability of autoagglutination and biofilm formation. However thepotDmutant strain showed an obvious decrease in serum resistance ability and the virulence to mice. The findings above suggested thatpotDgene may be associated with virulence inH.parasuis.
Haemophilusparasuis;potD; virulence; natural transformation; mutant
10.11843/j.issn.0366-6964.2016.11.015
2016-06-27
公益性行业(农业)科研专项(201303034)
谨 瑾(1993-),女,山西运城人,硕士,主要从事动物传染病的研究工作,E-mail:JIN109JIN@163.com;张禄滑(1986-),男,四川内江人,博士,主要从事动物传染病的研究工作,E-mail:zhangluhua520@126.com。二人同为第一作者
*通信作者:文翼平,博士,E-mail:yueliang5189@163.com
S852.613
A
0366-6964(2016)11-2274-06
——紫 苏

