老年男性糖代谢异常患者骨代谢标志物探析
郭南京 李 津 陈庆福 朱雨霏
老年男性糖代谢异常患者骨代谢标志物探析
郭南京 李 津 陈庆福 朱雨霏
目的 通过对我科住院的120例老年男性糖代谢异常患者骨代谢标志物水平的检测,分析探讨此类患者骨代谢标志物的变化。方法收集2013年1月~2016年6月我科收治的年龄≥60岁男性2型糖尿病和糖调节受损患者各60例,另选取60例年龄≥60岁男性糖代谢正常者作为对照组,分别检测β-胶原特殊系列(CTX)、骨钙素(BGP)、总I型胶原氨基端延长肽(TPINP)、全段甲状腺旁腺激素(IPT)、25-羟基维生素D3[25-(OH)VD3]、硫酸去氢表雄酮(DHS)、睾酮(TSTO)、血钙(Ca)、血磷(P)、血碱性磷酸酶(ALP)的浓度。结果 三组之间血钙、磷、碱性磷酸酶、DHS及TSTO含量的差异无统计学意义。与对照组相比,糖代谢异常组患者的CTX、BGP、TPINP、IPT及25-(OH)VD3含量均降低(P<0.05)。结论 测定血清中的CTX、BGP、TPINP、IPT及25-(OH)VD3可在一定程度上了解老年男性糖代谢异常患者体内骨代谢情况,有利于对骨质疏松症的早期防治提供理论依据。
老年男性;2型糖尿病;糖调节受损;骨代谢标志物
随着社会的进步、人类生活水平的提高,人类寿命逐渐延长,我国已经步入老龄化社会,是世界上60岁以上老龄人口数量最多的国家,多达1.73亿。老年性骨质疏松症严重威胁老年人身心健康,已逐渐成为突出的社会公共卫生问题[1]。骨质疏松症(OP,Osteoporosis)是一种以骨量减少、骨微结构破坏为病理特征的全身性、代谢性骨骼系统疾病,导致骨脆性增加,骨强度下降,极易发生骨折。流行病学显示,我国50岁以上人群中骨质疏松症男女患病率分别为14.4%和20.7%[1]。骨折是骨质疏松症最严重的后果,老年男性骨质疏松症患者更易发生骨折,其死亡率及致残率高于女性。糖尿病是一种慢性代谢性疾病,由于高血糖、胰岛素抵抗、胰岛素样生长因子缺乏及糖尿病慢性并发症等多种因素的作用,糖尿病人群并发骨质疏松症的发病率高于普通人群,骨折危险性也升高[2-3]。骨代谢标志物能够早期反映骨代谢改变,及时反映骨转换率,可应用于预测骨折风险、评价骨代谢状态及抗骨质疏松质量疗效评价等。但老年男性糖代谢异常与骨代谢标志物的关系,尚不明确。为研究老年男性糖代谢异常患者骨代谢标志物的变化,笔者对2型糖尿病、糖调节受损及糖代谢正常的老年男性患者进行比较研究,探索此类患者骨代谢标志物的改变,为临床防治老年男性糖代谢异常患者骨质疏松提供理论依据。
1 研究对象与方法
1.1研究对象
选取2013年1月~2016年6月在我院保健病房住院的年龄≥60岁男性糖代谢异常患者,其中2型糖尿病60例(DM组),年龄60~94岁,平均(81.42±8.26)岁;糖调节受损(IGR,Impaired Glucose Regulation)60例(IGR组),年龄61~95岁,平均(83.52±8.48)岁,另选取同年龄段老年男性糖代谢正常者60例作为对照组,年龄60~95岁,平均(83.7±7.18)岁。糖代谢异常诊断参照世界卫生组织(WHO)1999年标准:空腹血糖≥7.0 mmol/L或口服葡萄糖耐量试验(OGTT)2 h血糖≥11.1 mmol/L,诊断为糖尿病;空腹血糖6.1~7.0 mmol/L为空腹血糖受损(IFG,Impaired Fasting Glucose);OGTT 2 h血糖7.8~11.1 mmol/L为糖耐量减低(IGT,Impaired Glucose Tolerance)。后两者统称为糖调节受损。
排除标准:(1)1型糖尿病及其他特殊类型糖尿病;(2)甲亢、甲减及甲旁亢等内分泌代谢性疾病;(3)风湿、类风湿等结缔组织病;(4)6个月内有骨折、成骨不全、骨髓纤维化、骨肿瘤、多发性骨髓瘤等;(5)严重肝肾功能衰竭、胃肠道切除术、营养不良及其它恶性肿瘤患者;(6)6个月内使用甲状腺激素、糖皮质激素、降钙素、维生素D类似物、钙剂及抗癫痫药物等影响骨代谢水平的药物。
1.2方法
所有受试者均于清晨空腹8 h后抽取静脉血,利用雅培Aeroset全自动生化分析仪测定生化指标血钙(Ca)、血磷(P)、血碱性磷酸酶(ALP)水平。应用罗氏Cobase e 601电化学发光全自动免疫分析系统测定β-胶原特殊系列(CTX)、骨钙素(BGP)、总1型胶原氨基端延长肽(TPINP)、全段甲状腺旁腺激素(IPT)、25-羟基维生素D3[25-(OH)VD3]、硫酸去氢表雄酮(DHS)、睾酮(TSTO)水平。
1.3统计学方法
2 结果
2.1年龄及生化指标
三组之间年龄、血钙、磷及碱性磷酸酶水平差异均无统计学意义。见表1。
2.2骨代谢标志物
2型糖尿病及糖调节受损组患者的CTX、BGP、TPINP、IPT及25-(OH)VD3含量均低于对照组(P<0.05);而DHS和TSTO水平高于对照组,但差异无统计学意义(P>0.05)。见表2。
3 讨论
骨质疏松症是一种以骨量低下,骨微结构破坏,骨脆性增加,导致易发生骨折为特征的全身性骨病。骨质疏松性骨折是骨质疏松症最严重的后果,导致病残率和死亡率的增加。双能X线吸收骨密度仪(DEXA,Dual Energy X Ray Absorptiometry)检测骨矿密度(BMD,Bone Mass Density)被认为是诊断OP的金标准[1],但骨矿密度并不能全面反映骨强度,一方面检测部位骨质增生、硬化或异位骨化等可能导致测量结果产生偏差,另一方面骨微结构损伤蓄积、骨代谢改变及骨基质等变化能够导致骨强度下降,从而发生OP[4]。再者,骨密度需要相对长时间改变,大量骨丢失时才能检测到变化,而骨代谢指标能够更加敏感反映骨代谢动态变化水平。因此,检测血清骨代谢标志物能够在一定程度上早期预测骨强度及OP。本研究选择老年男性2型糖尿病和糖调节受损人群,结果表明糖代谢异常组骨代谢指标CTX、BGP、TPINP、 IPT及25-(OH)VD3 较糖代谢正常组降低。
大量研究显示,1型糖尿病患者骨密度下降和骨折风险性增加,相关机制相对明确[5-6],而2型糖尿病的骨密度变化仍存在争议,但大多数研究认为2型糖尿病患者的骨密度无变化或增加,并且骨折风险同样是增高的[2,6]。一般认为2型糖尿病骨折风险性增加可能与其并发症如神经病变、视网膜病变、血管病变、低血糖或体位性低血压等引起的跌倒相关,或者与其服用药物如噻唑烷二酮类有关,但前者已被证实两者无因果关系[7]。骨代谢或骨转换是机体成骨细胞生成新骨和破骨细胞对旧骨进行吸收的过程,通常情况下,骨形成和骨吸收随时间变化而改变,两者形成动态平衡,维持骨的相对稳态[8]。在平衡被打破情况下,骨形成不足或骨吸收大于骨形成时,则导致骨质疏松的发生。吴少英等[9]测定了50例老年男性2型糖尿病合并骨质疏松患者的骨代谢指标,结果显示相对于对照组,观察组患者甲状旁腺激素和尿中脱氧吡啶啉的浓度升高,血清骨钙素含量降低,提示观察组患者骨形成能力降低,骨吸收功能亢进。冯缨缨等[10]同样观察老年男性2型糖尿病合并骨质疏松患者骨形成和骨吸收生化指标,显示OP组的骨形成指标(BAP、BGP、PINP)含量低于非OP组,而骨吸收指标(CTX)水平高于非OP组。阚全娥等[11]观察了116例绝经后2型糖尿病患者的骨代谢标志物,结果显示骨质疏松组较骨量正常组骨钙素及TPINP水平降低,CTX升高。而本研究显示,2型糖尿病及糖调节受损组的CTX、BGP、TPINP、IPT及25-(OH)VD3含量均低于对照组(P<0.05),与其他国内外研究相一致[12-13],提示糖代谢异常患者的骨转换能力低下或受抑制。虽然骨转换能力降低能够减少骨量丢失,但是同时也使得骨结构微损伤不能得到及时修复,导致骨质量下降和骨折风险性增加[12]。
综上所述,本研究表明老年男性糖代谢异常患者骨转换能力低下,可能导致其骨质量下降和骨折风险增加,通过检测血清中CTX、BGP、TPINP、IPT及25-(OH)VD3的含量,可在一定程度上了解其体内骨代谢情况,有利于对骨质疏松症的早期诊治提供理论依据。
表1 三组之间年龄及生化指标比较()
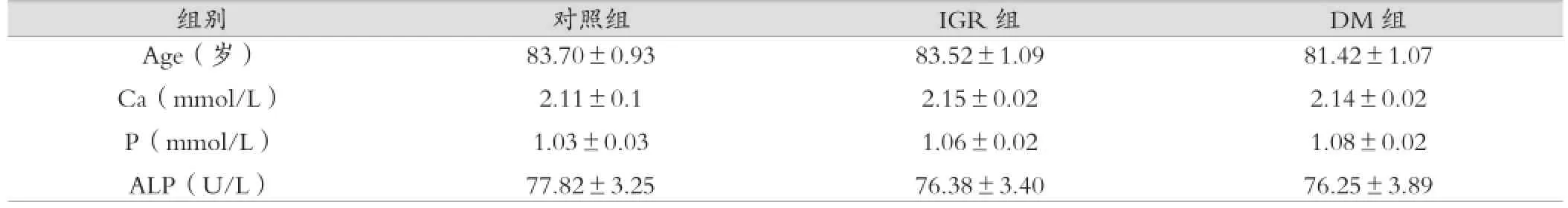
表1 三组之间年龄及生化指标比较()
组别 对照组 IGR组 DM组Age(岁)Ca(mmol/L)P(mmol/L)ALP(U/L)83.70±0.93 2.11±0.1 1.03±0.03 77.82±3.25 83.52±1.09 2.15±0.02 1.06±0.02 76.38±3.40 81.42±1.07 2.14±0.02 1.08±0.02 76.25±3.89
表2 三组之间骨代谢标志物比较()
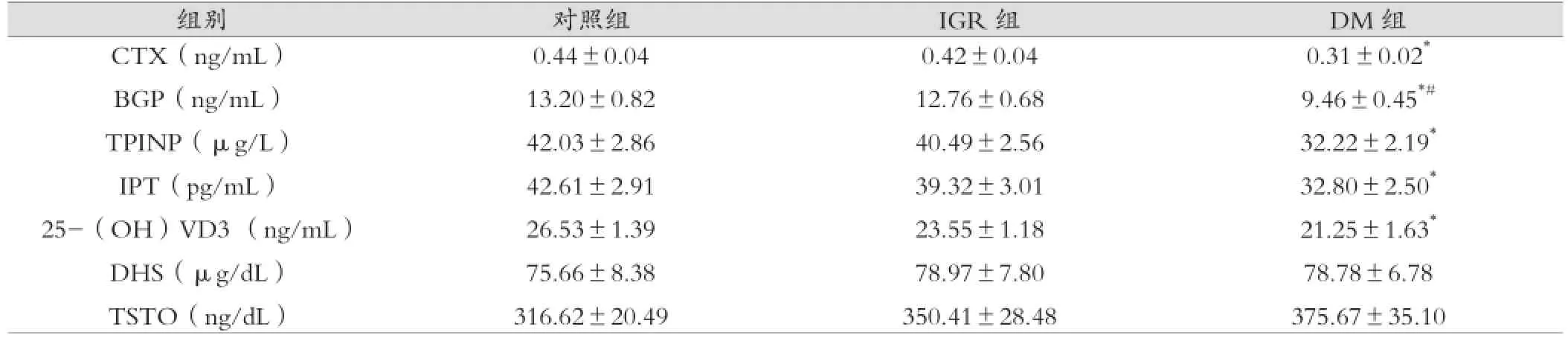
表2 三组之间骨代谢标志物比较()
注:*与对照组比较P<0.05;#与IGR组比较P<0.05
0.31±0.02*9.46±0.45*#32.22±2.19*32.80±2.50*21.25±1.63*78.78±6.78 375.67±35.10组别 对照组 IGR组 DM组CTX(ng/mL)BGP(ng/mL)TPINP(µg/L)IPT(pg/mL)25-(OH)VD3 (ng/mL)DHS(µg/dL)TSTO(ng/dL)0.44±0.04 13.20±0.82 42.03±2.86 42.61±2.91 26.53±1.39 75.66±8.38 316.62±20.49 0.42±0.04 12.76±0.68 40.49±2.56 39.32±3.01 23.55±1.18 78.97±7.80 350.41±28.48
[1] 中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊治指南(2011年)[J]. 中华骨质疏松和骨矿盐疾病杂志,2011,4(1): 2-17.
[2] Lipscombe LL,Jamal SA,Booth GL,et al. The risk of hip fractures in older individuals with diabetes: a population-based study[J]. Diabetes Care,2007,30(4): 835-841.
[3] 胡玲萍,吴雪华. 老年男性2型糖尿病并发骨质疏松相关危险因素研究现状[J]. 中国临床保健杂志,2014,17(1): 107-109.
[4] 陈伟,张红梅,张静,等. 骨质疏松症骨生化指标检测分析[J].医学综述,2016,22(14): 2846-2848,2852.
[5] Hough FS,Pierroz DD,Cooper C,et al. MECHANISMS IN ENDOCRINOLOGY: Mechanisms and evaluation of bone fragility in type 1 diabetes mellitus[J]. Eur J Endocrinol,2016,174(4): R127-R138.
[6] Vestergaard P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes--a meta-analysis[J]. Osteoporos Int,2007,18(4): 427-444.
[7] Shu A,Yin MT,Stein E,et al. Bone structure and turnover in type 2 diabetes mellitus[J]. Osteoporos Int,2012,23(2):635-641.
[8] Ljunggren O,Bolinder J,Johansson L,et al. Dapagliflozin has no effect on markers of bone formation and resorption or bone mineral density in patients with inadequately controlled type 2 diabetes mellitus on metformin[J]. Diabetes Obes Metab,2012,14(11):990-999.
[9] 吴少英,张铭,李玮,等. 老年男性2型糖尿病合并骨质疏松患者骨代谢生化指标探析[J]. 临床合理用药杂志,2015,8(20): 7-8.
[10] 冯缨缨,钟远,金俊. 老年男性2型糖尿病合并骨质疏松症患者骨代谢生化指标分析[J]. 实用老年医学,2011,25(6):510-512.
[11] 阚全娥,杨慧慧. 绝经后2型糖尿病患者骨密度与骨代谢标志物的相关分析[J]. 中华老年医学杂志,2013,32(11):1206-1208.
[12] Jiajue R,Jiang Y,Wang O,et al. Suppressed bone turnover was associated with increased osteoporotic fracture risks in non-obese postmenopausal Chinese women with type 2 diabetes mellitus[J]. Osteoporos Int,2014,25(8): 1999-2005.
[13] Yamamoto M,Yamaguchi T,Nawata K,et al. Decreased PTH levels accompanied by low bone formation are associated with vertebral fractures in postmenopausal women with type 2 diabetes[J]. J Clin Endocrinol Metab,2012,97(4): 1277-1284.
Bone Turnover Markers of the Aged Male Patients With Abnormal Glucose Metabolism
GUO Nanjing LI Jin CHEN Qingfu ZHU Yufei Department of Cadre Sanitarian,First Affiliated Hospital of Xiamen University,Xiamen Fujian 361003,China
Objective To investigate the bone turnover markers of 120 aged male patients with abnormal glucose metabolism,who were hospitalized in our department. Methods Sixty cases of aged male patients with type 2 diabetes mellitus and impaired glucose regulation were selected as observation group,and 60 cases of aged male patients with normal glucose metabolism were selected as control group in our department from January 2013 to June 2016. Serum bone turnover makers such as type I collagen carboxy-terminal peptide(CTX),bone glaprotein(BGP),total type I collagen amino-terminal extension of peptides(TPINP),intact parathyroid hormone(IPT),25-hydroxyvitamin D3[25-(OH)VD3],dehydroepiandrosterone sulfate(DHS),testosterone (TSTO),blood calcium(Ca),phosphorus(P)and blood alkaline phosphatase(ALP)were measured.Results There were no significant differences in calcium,phosphorus,ALP,DHS and TSTO among the three groups. The levels of serum CTX,BGP,TPINP and 25-(OH)VD3 in observation groups were lower than those in control group(P<0.05). Conclusion The determination of serum CTX,BGP,TPINP,IPT and 25-(OH)VD3 may contribute to understand the bone metabolism contion of patients with abnormal glucose metabolism,and it can be regarded as the prevention and treatment index of osteoporosis.
Aged men,Type 2 diabetes mellitus,Impaired glucose regulation,Bone turnover markers
R587
A
1674-9316(2016)21-0019-03
10.3969/j.issn.1674-9316.2016.21.012
福建省卫生厅青年科研课题(编号:2013-2-87)
厦门大学附属第一医院保健病房,福建 厦门 361003
郭南京,E-mail:drnjguo@126.com

