HSPC238对HMOX1、RPS27a、MT2A、UBB调节的初步研究①
谭家余 黄 湘 陈敬林 钟裕恒
(南方医科大学第三临床医学院 南方医科大学附属中山博爱医院,中山528403)
·生物治疗·
HSPC238对HMOX1、RPS27a、MT2A、UBB调节的初步研究①
谭家余 黄 湘 陈敬林 钟裕恒
(南方医科大学第三临床医学院 南方医科大学附属中山博爱医院,中山528403)
目的:探讨HSPC238过表达或低表达对目标蛋白(HMOX1、MT2A、UBB、RPS27a)的调节作用及其调节途径。方法:分别构建HSPC238的干扰载体及高表达载体,脂质体法转染HEPG2细胞株,RT-PCR、Western blot检测HSPC238及目标蛋白的mRNA、蛋白的表达量;进一步用目标蛋白的高表达质粒分别转染低表达及高表达HSPC238的HEPG2细胞株,实验组另以蛋白酶体抑制剂MG132处理细胞,镍柱纯化目标蛋白,以HSPC238做免疫印迹,检测目标蛋白累积情况。结果:外源性干扰HSPC238后HMOX1、MT2A、RPS27a表达下调较明显,外源性过表达HSPC238后MT2A、UBB、RPS27a表达水平明显上调;目标蛋白的高表达质粒分别转染低表达及高表达HSPC238的HEPG2细胞株,实验组以蛋白酶体抑制剂MG132处理细胞后,与对照组比较,泛素化的目标蛋白条带明显增加。结论:过表达HSPC238可上调MT2A、UBB、RPS27a的表达,干扰HSPC238可下调HMOX1、MT2A、RPS27a的表达;HSPC238可能通过泛素蛋白酶体途径(Ubiquitin-proteasome pathway,UPP)对目标蛋白发挥调节作用。
HSPC238;泛素蛋白酶体途径;目标蛋白
HSPC238蛋白(hypothetical protein LOC51255,ring finger protein 181,NP_057578)是由LOC51255基因(NM_016494)编码的含153个氨基酸的,包含RING指(RING-type zinc finger)结构域的蛋白质,属于C3HC4型锌指蛋白,其特殊的结构提示该蛋白可能参与泛素蛋白酶体途径。本课题组在前期研究中发现,HSPC238蛋白在体内外均可明显抑制肝癌细胞的生长[1],并进一步通过酵母双杂交的方法筛选到了与HSPC238相互作用的目标蛋白(HMOX1、MT2A、UBB、RPS27a)[2]。本研究拟进一步探讨HSPC238对目标蛋白的调节及其调节途径,为深入研究HSPC238在肝癌发生中的作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒及细胞株 pCDNA3.1-HSPC238-Flag;pCDNA3.1-HMOX1-His;pCDNA3.1-MT2A-His;pC-DNA3.1-RPL5-His;pCDNA3.1-UBB-His;pCDNA-3.1-RPS27A-His、HEPG2细胞株等由本课题组前期已合成。
1.1.2 抗体 HSPC238、HMOX、RPS27A、MT2A、UBB、Goat-anti-mouse-HRP、Goat-anti-Rabbit-HRP、mouse anti-Flag mAb、兔抗Ubiquitin B、兔抗MT2A、兔抗RPS27、兔抗HMOX1均购自ABCLONAL;mouse anti-actin(Epitomics);羊抗鼠和羊抗兔二抗(Abmart)。
1.1.3 基础试剂 细胞基础培养基、FBS胎牛血清、双抗、Lipfecti mine 2000转染试剂、MG132、Ni-NTA sefinose Resin(生工生物工程);Tricine Lipofecta mine 2000、PMSCV-puro、嘌呤霉素、DMEM/高糖基础培养基,FBS。逆转录酶,Real-time PCR试剂盒、TRIZOL购自钟鼎生物;氯仿、异丙醇(分析纯);RNA溶解液(全式金);DEPC(PMSF Amresco);引物合成(上海生工),cocktail(上海源叶生物科技有限公司);PBS(pH7.0,自配);脱脂奶粉(伊利),DMEM/高糖培养基,购自Gibco公司;FBS、Penicillin和Streptomycin购自Hyclone公司;Trypsogen购自Worthington公司。
1.2 方法
1.2.1 稳定过表达及低表达HSPC238蛋白细胞株的筛选 转染前24 h,将细胞接种于5 ml不含抗生素的H-DMEM培养基中,使其在转染时长至70%~80%融合。参照Lipofecta mineTM2000产品说明书,分别将目的质粒转染至六孔板培养基,37℃、5% CO2孵育6 h后,换用新鲜完全培养基继续培养48 h后加入2 μg/ml嘌呤霉素筛选。初期每天更换新鲜含有2 μg/ml培养基,5 d后视培养基颜色变化来换液,当出现克隆后挑出克隆,扩增培养,并细胞冻存以便后续实验。
1.2.2 总RNA提取及RT-PCR实验 收集扩增培养72 h后的各组细胞(分成两份,一份用于RT-PCR、一份用于WB),按照总RNA提取试剂盒说明书提取细胞总RNA。采用SYBR Green法进行RT-PCR实验,各个目的基因引物序列及产物大小见下表。
反应程序:95℃,3 min;95℃,30 s;55℃,20 s;72℃,20 s;72℃,10 min;共35个循环,同一实验重复3次,统计学分析采用的是相对定量,采用RQ=2-△CT计算相对表达量,EXCLE分析数据,Graphpad prism 5软件作图。
1.2.3 蛋白提取及WB实验 收集扩增培养72 h后的各组细胞(分成两份,一份用于RT-PCR、一份用于WB),加入细胞裂解液提取总蛋白,采用BCA法测定蛋白浓度。加入SDS上样缓冲液100℃,处理5 min;每孔上样100 μg,70 V恒压SDS-Page电泳,100 V冰水混浴,电转至PVDF膜,5%的脱脂牛奶室温封闭1 h,加入一抗(六种抗体分别稀释为1∶500;β-actin为1∶1 000),4℃冰箱过夜,次日TBST漂洗10 min×3次,加入HRP标记的二抗(羊抗鼠1∶5 000,羊抗兔1∶2 000),室温孵育1 h,TBST漂洗10 min×3次,ECL化学发光显影。
1.2.4 HSPC238对目标蛋白的泛素化调节 接种步骤1.2.1中的HepG2稳转细胞株,0.25%胰酶消化至细胞密度为60%~70%。参照Lipofecta mineTM2000产品说明书,将目标质粒(pcDNA3.1/HMOX1/MT2A/RPS27A/UBB)分别转染至细胞,37℃吸附5 h,更换新鲜完全培养基。继续培养48 h后,加入MG132浓度10 μmol/L,孵育3 h。裂解细胞提取总蛋白,采用BCA法测定蛋白浓度。镍柱纯化,收集洗脱液。BCA法测定洗液、洗脱液各组分蛋白浓度,加入5×SDS上样缓冲液100℃,处理5 min;每孔上样100 μg,15 mA恒流SDS-PAGE电泳,电转至PVDF膜,丽春红染色5 min,预留目标蛋白所在范围,剪膜水洗使得条带消失。5%的脱脂牛奶+TBST室温封闭1 h,加入一抗(六种抗体分别稀释为1∶500;β-actin为1∶1 000),4℃冰箱过夜,次日TBST漂洗10 min×3次,加入HRP标记的二抗(羊抗鼠1∶5 000,羊抗兔1∶2 000),室温孵育1 h,TBST漂洗10 min×3次,ECL化学发光显影。
表1 目的基因的引物序列及产物大小
Tab.1 Primer sequence and product size of target gene

PrimerSequenceProductsizehHSPC238_FTGCCAAGACTGTGGTTGAGA95bphHSPC238_RCAAAAGACACACGGGGCACThActin_FGATGAGATTGGCATGGCTTT105bphActin_RGTCACCTTCACCGTTCCAGThUBB_FAGCCTTTCTTACGGCTATGAGG136bphUBB_RGTTGCGTCACTTATCACCCChMT2A_FAAAGAACGCGACTTCCACAA70bphMT2A_RAGGAATATAGCAAACGGTCACGhHMOX1_FCGAGCATAAATGTGACCGGC139bphHMOX1_RTGCTGTCGGGTTGCGGAhRPS27a_FTGTGAAATGCCCAGGATGCTA78bphRPS27a_RGAGCAGCCAACACACAAAACT
2 结果
2.1 过表达及干扰HSPC238对HEPG2细胞内HSPC238及目标蛋白的影响 HEPG2细胞过表达HSPC238及干扰HSPC238后,分别通过RT-PCR和WB检测内源性HSPC238及目标蛋白的mRNA和蛋白表达水平。内源性HSPC238、RPS27、UBB、HMOX1在HEPG2细胞中表达量相对较高,MT2A的表达水平较低;外源性干扰HSPC238后HMOX1、MT2A、RPS27表达下调较明显,外源性过表达HSPC238后MT2A、UBB、RPS27表达水平也随之上调,见图1。
2.2 过表达目标蛋白对稳定高表达HSPC238细胞株内目标蛋白的影响 分别转染pcDNA3.1/HMOX-1/RPS27A/MT2A/UBB各实验组于稳定高表达HSPC238细胞株,镍柱纯化目标蛋白,以HSPC238做免疫印迹,结果表明约20 kD左右有正确大小条带,即HSPC238与各目的蛋白结合,另外以MG132(10 μmol/L)处理细胞,较未处理细胞组条带增加,表明泛素化的目标蛋白在MG132抑制蛋白酶体活性后大量累积,见图2。
2.3 过表达目标蛋白对稳定低表达HSPC238细胞株内目标蛋白的影响 分别转染pcDNA3.1/HMOX-1/RPS27A/MT2A/UBB各实验组于稳定低表达HSPC238细胞株,镍柱纯化目标蛋白,以HSPC238做免疫印迹,结果表明约20 kD有正确大小微弱条带,另外以MG132(10 μmol/L)处理细胞,较未处理细胞组条带增加,显示被泛素化的蛋白累积增加,见图3。
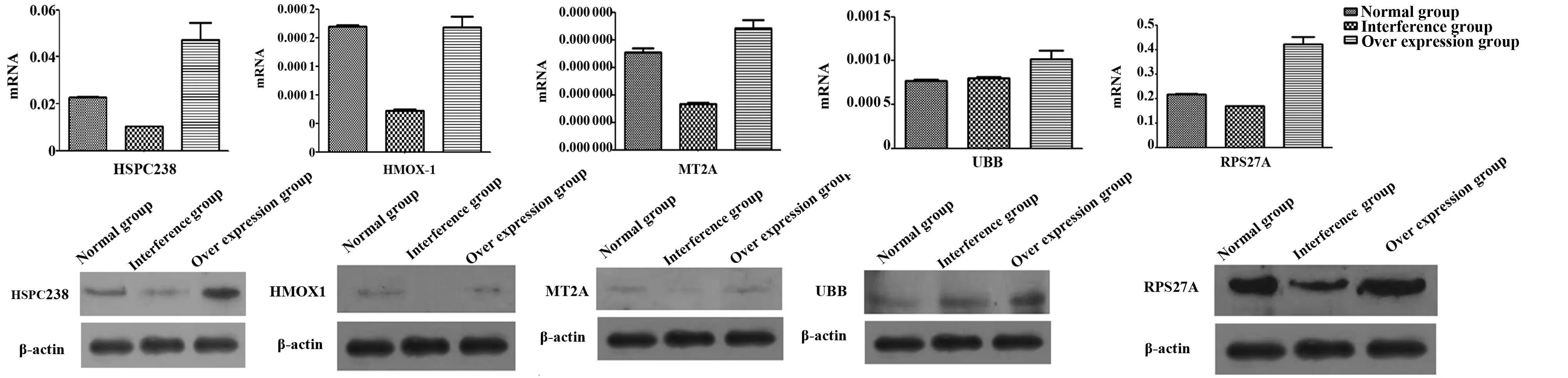
图1 外源干扰或过表达HSPC238后HEPG2细胞株内HSPC238及目标蛋白的mRNA和蛋白表达变化的影响Fig.1 Effect on expression of mRNA and protein of HSPC238 and target proteins in HEPG2 cell lines after interference or over expression of HSPC238 exogenous

图2 转染过表达目标蛋白的质粒于高表达HSPC238的HEPG2细胞株内,MG132处理后,观察目标蛋白的代谢变化Fig.2 Transfect overexpression plasmid of target proteins into HEPG2 cell lines which was high expression of HSPC238,after MG132 treatment,observe metabolic changes of target protein
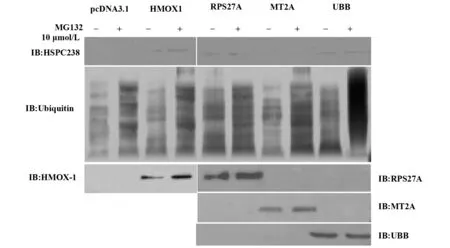
图3 转染过表达目标蛋白的质粒于低表达HSPC238的HEPG2细胞株内,MG132处理后,观察目标蛋白的表达变化Fig.3 Transfect overexpression plasmid of target proteins into HEPG2 cell lines which was low expression of HSPC238,after MG132 treatment,observe metabolic changes of target protein
3 讨论
本课题组在前期研究中已经证实,HSPC238在体内外均可以抑制肝癌细胞的生长[1],进一步通过酵母双杂交、免疫共沉淀、pull-down等系列实验筛选到与其相互作用的目标蛋白(HMOX-1、RPS27A、MT2A、UBB)[2],在此研究基础上,本实验初步探讨HSPC238对上述四种目标蛋的调节作用及其调节途径。
为明确HSPC238及其目标蛋白的内源性表达水平,本研究检测了HEPG2细胞株内HSPC238及目标蛋白的mRNA和蛋白表达水平,结果表明HSPC238、HMOX1、RPS27a、UBB在HEPG2细胞中的内源性表达量相对较高,而MT2A蛋白的内源性表达水平较低;有研究表明,在肝细胞肝癌组织中HMOX1表达水平较高[3],而RPS27a、MT2A表达水平较低[4,5],目前尚未见UBB蛋白在肝癌组织中的表达及其与肝癌关系的相关研究报道。
为初步探讨HSPC238对目标蛋白是否存在调节作用,本研究分别将HSPC238的过表达及干扰载体转染入HEPG2细胞株,结果发现,当HEPG2细胞株转染HSPC238干扰载体后HMOX1、MT2A、RPS27a表达下调较明显,而转染HSPC238过表达载体后MT2A、UBB、RPS27a表达水平也随之上调。表明HSPC238对目标蛋白存在某种调节作用。
为探讨HSPC238对目标蛋白的调节机制,本研究分别将目标蛋白的高表达质粒转染于稳定高(低)表达HSPC238的细胞株,镍柱纯化目标蛋白,以HSPC238做免疫印迹,均有目标条带出现,表明HSPC238与目标蛋白存在结合。再以蛋白酶体抑制剂MG132处理细胞,继续培养一段时间后进一步裂解细胞做免疫印迹,结果表明,MG132处理组与未处理细胞组比较,条带明显增加,表明被泛素化的蛋白累积增加,即目标蛋白通过UPP途径代谢。
UPP途径是体内多数蛋白质的代谢通路,主要降解胞内蛋白,我们的前期研究已经证实目标蛋白均存在于胞质中[6,7],而又有学者研究发现HSPC238蛋白具有E3酶活性,且HMOX1、RPS27a、UBB、MT2A四种目标蛋白均与肿瘤存在密切关系[8-16]。因此我们推测HSPC238蛋白扮演E3角色通过UPP途径来调节目标蛋白的代谢,其具体代谢及调节作用机制,有待进一步研究证实。
[1] Wang S,Huang X,Li Y,etal.RN181 suppresses hepatocellular carcinoma growth by inhibition of the ERK/MAPK pathway[J].Hepatology,2011,53(6):1932-1942.
[2] Tan JY,Chen JL,Huang X,etal.Screening and verification of proteins that interact with HSPC238[J].Oncol Rep,2015,34(6),3097-3103.
[3] 周开良,黄凌敏,罗满生,等.HO-1在原发性肝癌中的表达及意义[J].江西医药,2012,47(4):305-307.
[4] Fatima G,Mathan G,Kumar V.The HBx protein of hepatitis B virus regulates the expression,intracellular distribution and functions of ribosomal protein S27a[J].J Gen Virol,2012,93(Pt 4):706-715.
[5] Tao X,Zheng JM,Xu AM,etal.Downregulated expression of metallothionein and its clinicopathological significance in hepatocellular carcinoma[J].Hepatol Res,2007,37(10):820-827.
[6] 谭家余,陈敬林,黄 湘,等.pCDNA3.1-MT2A真核表达载体的构建及亚细胞定位[J].中国免疫学杂志,2014,30(11):1504-1507.
[7] 陈敬林,黄 湘,谭家余,等.pcDNA3.1-HMOX1重组质粒载体的构建与鉴定[J].广东医学,2015,36(2):189-191.
[8] Brophy TM,Raab M,Daxecker H,etal.RN181,a novel ubiquitin E3 ligase that interacts with the KVGFFKR motif of platelet integrin alpha(IIb)beta3[J].Biochem Biophys Res Commun,2008,369(4):1088-1093.
[9] Seo GS,Jiang WY,Chi JH,etal.Heme oxygenase-1 promotes tumor progression and metastasis of colorectal carcinoma cells by inhibiting antitumor immunity[J].Oncotarget,2015,6(23):19792-19806.
[10] Lin X,Fang Q,Chen S,etal.Heme oxygenase-1 suppresses the apoptosis of acute myeloid leukemia cells via the JNK/c-JUN signaling pathway[J].Leuk Res,2015,39(5):544-552.
[11] Nosrati N,Kapoor NR,Kumar V.Combinatorial action of transcription factors orchestrates cell cycle-dependent expression of the ribosomal protein genes and ribosome biogenesis[J].FEBS J,2014,281(10):2339-2352.
[12] Wang H,Yu J,Zhang L,etal.RPS27a promotes proliferation,regulates cell cycle progression and inhibits apoptosis of leukemia cells[J].Biochem Biophys Res Commun,2014,446(4):1204-1210.
[13] Oh C,Park S,Lee EK,etal.Downregulation of ubiquitin level via knockdown of polyubiquitin gene Ubb as potential cancer therapeutic intervention[J].Sci Rep,2013,3:2623.
[14] Tian Y,Ding W,Wang Y,etal.Ubiquitin B in cervical cancer:critical for the maintenance of cancer stem-like cell characters[J].PLoS One,2013,8(12):e84457.
[15] Pan Y,Huang J,Xing R,etal.Metallothionein 2a inhibits NF-κB pathway activation and predicts clinical outcome segregated with TNM stage in gastric cancer patients following radical resection[J].J Transl Med,2013,11:173.
[16] Rezk NA,Zidan HE,Riad M,etal.Metallothionein 2a expression and its relation to different clinical stages and grades of breast cancer in Egyptian patients[J].Gene,2015,571(1):17-22.
[收稿2015-10-01 修回2015-11-05]
(编辑 张晓舟)
A preliminary study on regulation of HMOX1,RPS27a,MT2A and UBB by HSPC238
TAN Jia-Yu,HUANG Xiang,CHEN Jing-Lin,ZHONG Yu-Heng.The Third Clinical College of Southern Medical University,Boai Hospital Affiliated to Southern Medical University ,Zhongshan 528403,China
Objective:To investigate the effect of HSPC238 overexpression or low expression on the regulation of the target protein (HMOX1,MT2A,UBB,RPS27a) and the regulation pathways.Methods: To construct the interference vector and overexpression vector of HSPC238 respectively,transfected the HEPG2 cell lines by the liposome method,detect the expression of mRNA and protein of the HSPC238 and the target proteins by the RT-PCR and Western blot,further to transfer the overexpression plasmids of the target proteins into the HEPG2 cell lines which had been transfected with interference vector and overexpression vector of HSPC238,the experimental group cell lines were treated with proteasome inhibitor MG132,to purify the target proteins with nickel column,do immunoblotting with HSPC238 to detect the accumulation situation of the target proteins.Results: The HMOX1,MT2A,RPS27a were downregulated obviously when the HSPC238 was interfered exogenous;and the MT2A,UBB,RPS27a were up-regulated after the HSPC238 overexpressed.The overexpression plasmid of target proteins were transfected into the HEPG2 cell lines which have been transfected with interference vector and overexpression vector of HSPC238,compared with the control group,the target protein band in the experimental group was significantly increased after treatment with the proteasome inhibitor MG132.Conclusion: The HSPC238 overexpression can upregulate the expression of MT2A,UBB and RPS27a,and interfering HSPC238 can downregulate the expression of HMOX1,MT2A and RPS27a;the HSPC238 target protein may play a regulatory role through the UPP pathway;the HSPC238 may play a regulatory role on the target proteins through the UPP pathway.
HSPC238;Ubiquitin-proteasome pathway;Target protein
10.3969/j.issn.1000-484X.2016.04.013
①本文受国家自然科学基金(81101534)、广东省自然科学基金(S2012010010824)和广东省医学科研基金(A2013875)项目资助。
谭家余(1969年-),男,博士,主要从事肿瘤免疫学相关研究,E-mail:842630809@qq.com。
及指导教师:黄 湘(1971年-),女,博士,主任技师,硕士生导师,主要从事肿瘤免疫学相关研究,E-mail:340382761@qq.com。
R392.1
A
1000-484X(2016)04-0509-04