miRNA-126基因敲减小鼠脾脏中免疫细胞的组成变化①
雷良玉 胡 燕 郭萌萌 卢 佳 郑 文 徐华林 陈 超 徐 林
(贵州省遵义医学院免疫学教研室,遵义563000)
·基础免疫学·
miRNA-126基因敲减小鼠脾脏中免疫细胞的组成变化①
雷良玉 胡 燕 郭萌萌 卢 佳 郑 文 徐华林 陈 超 徐 林
(贵州省遵义医学院免疫学教研室,遵义563000)
目的:观察miRNA-126基因敲减(Knock down,KD)小鼠脾脏中免疫细胞组成比例变化并探讨其意义。方法:Realtime PCR探针法检测miR-126KD小鼠脾脏中miR-126表达水平,计算脾脏总细胞数;HE染色观察脾脏组织的病理学变化;流式细胞术(FACS)分别检测脾脏中DCs细胞、巨噬细胞、γδT细胞、NKT细胞,CD3+T细胞和其亚群以及CD19+B细胞的比例并计算细胞绝对数;免疫印迹法(Western blot,WB)检测脾脏组织中磷酸化NF-κB和磷酸化Akt的表达水平。结果:与野生型(WT)小鼠相比,miR-126KD脾组织中miR-126表达水平明显降低(P<0.05),细胞总数明显增加(P<0.05),且发生明显病理学改变;固有免疫细胞中NK细胞的比例和细胞绝对数显著增加(P<0.05),但巨噬细胞的比例显著降低(P<0.05);适应性免疫细胞中CD3+T细胞和CD4+T细胞的比例和绝对细胞数都显著增加(P<0.05),而CD19+B细胞仅绝对数显著增加(P<0.05);最后miRNA-126KD小鼠脾脏组织的磷酸化NF-κB和磷酸化Akt水平明显增加(P<0.05)。结论:miRNA-126敲减小鼠脾脏中各免疫细胞亚群的组成发生明显改变,可能与NF-κB和Akt信号通路传递变化有关,为后续探讨miR-126在机体免疫应答中的作用提供了前期实验基础。
miRNA-126;基因敲减;免疫细胞;组成
脾脏(Spleen,Sp)是哺乳动物最大的外周免疫器官,是免疫应答的重要部位。脾脏中含有丰富的T细胞、B细胞、树突细胞(DC)及巨噬细胞、NK细胞等细胞亚群,它们的组成比例和数量的维持对于机体免疫应答功能的发挥至关重要,且与多种临床疾病的发生密切相关[1-3]。微小RNAs(microRNAs,miRNAs)广泛存在于多种生命体中,并在机体多种组织器官的发育及功能中具有关键的调控作用。MicroRNA-126(miR-126)是miRNAs 家族中重要的一员,位于人表皮生长因子样结构域蛋白7(Human epidermal growth factor like domain protein multiple 7,EGFL7)基因7号内含子中,其在血管和心脏、肺等组织器官的内皮细胞中高表达,并参与组织细胞的发育和功能调控过程[4,5]。新近研究报道miR-126也参与了机体多种免疫细胞的发育和功能的调控[6,7]。我们新近发现miRNA-126参与维持小鼠肠系膜淋巴结中T淋巴细胞的组成比例[8,9],然而其是否也参与脾脏中各固有免疫细胞和适应性免疫细胞组成比例的维持,以及相关分子机制仍未有研究探讨。因此,本研究中我们拟利用前期构建的miR-126基因敲减(Knock down,KD)小鼠模型[10],初步检测分析miR-126敲减后脾脏中各免疫细胞的组成比例变化,为后续深入探讨miR-126在机体免疫应答及相关疾病发生中的作用提供前期实验基础。
1 材料与方法
1.1 材料 雌性FVB小鼠和miR-126KD小鼠(广州赛业生物科技有限公司)饲养于我校生物医学中心动物室(SPF级);苏木精-伊红(HE)染色液(泰康医疗);流式细胞仪(BeckmanCoulter); 荧光显微镜(Olympus); R-Phycoerythrin(PE)标记抗鼠CD4、CD19、CD3单克隆抗体,Percp-Cy5.5标记抗鼠CD8、F4/80、CD11c单克隆抗体,Allophycocyain(APC)标记抗鼠NK1.1、γδT单克隆抗体均购自 ebioscience公司;Rabbit NF-κB、Rabbit p-NF-κB、Rabbit p-Akt、GAPDH及Anti-Rabbit IgG HRP-linked(Cell Signaling公司);BeyoECL Plus A、B液(碧云天公司);Western blot化学发光成像仪(Carestream Health公司);RNA提取试剂盒(TaKaRa);Taqman 探针(ABI)。
1.2 方法
1.2.1 miR-126KD小鼠脾脏细胞数目的检测 取出miR-126KD小鼠和WT小鼠脾脏;然后放入加有PBS平皿中,用玻片的糙面轻轻研磨制成单细胞悬液,并利用细胞计数板计取细胞总数。
1.2.2 HE染色观察脾脏的形态学改变 取miR-126KD小鼠和WT小鼠脾脏,置于4%的多聚甲醛中固定24 h,然后用石蜡包埋,制成3 μm切片并做HE染色,最后在倒置显微镜下观察脾脏的病理形态学变化。
1.2.3 流式细胞术(FACS)检测脾脏细胞的比例变化 将取出的miR-126KD小鼠和WT小鼠脾脏置于冰上放有PBS的平皿中,然后用玻片的糙面轻轻研磨成单细胞悬液,加PBS洗涤,1 200 r/min 10 min,弃掉上清液,将余下细胞弹散,加入适量PBS,经筛网过滤后分别加入荧光素标记抗鼠CD4、CD19、CD3单抗,Percp-Cy5.5标记抗鼠CD8、F4/80、CD11c荧光抗体,APC标记抗鼠NK1.1、γδT荧光抗体各1 μl,冰上避光孵育30 min,PBS洗涤2遍,然后利用流式细胞仪进行检测。
1.2.4 小鼠脾细胞总蛋白提取 制备脾细胞悬液(方法同1.2.1),1 200 r/min 10 min,弃上清,加入含有蛋白酶抑制(PMSF)和磷酸化蛋白酶抑制剂的RIPA裂解液裂解30 min,4℃ 12 000 r/min 15 min。取上清,蛋白样品利用BCA方法定量。加入蛋白上样缓冲液煮沸10 min,分装-20℃保存。
1.2.5 Western blot检测磷酸化Akt和磷酸化NF-κB蛋白的表达变化 取蛋白上样,经SDS-PAGE电泳并PVDF膜转膜,5%BSA封闭2 h,PBST洗膜3次,每次10 min。分别加入1∶500稀释的Rabbit来源抗鼠的磷酸化Akt和磷酸化NF-κB抗体,4℃孵育过夜。PBST洗膜3次,每次10 min。加入1∶1 000稀释的Anti-Rabbit IgG HRP-linked孵育1~2 h,增强型ECL发光试剂法检测蛋白表达情况。经Gel-Pro Analyzer 4.0软件进行灰度值测定与分析。
2 结果
2.1miR-126KD小鼠脾脏细胞总数、miR-126的表达及病理形态学变化 如图所示,野生型(Wildtype)小鼠和miR-126KD小鼠脾脏相比,miR-126KD组脾脏的细胞总数明显增加(P<0.001,图1A),miR-126表达水平明显降低(P<0.001,图1B)。HE染色结果显示(图1C),与WT小鼠相比,miR-126KD小鼠脾脏中浅层皮质区淋巴小结过度增生,且在副皮质区脾细胞明显增加(P<0.05)。
2.2miR-126KD小鼠脾脏中γδT细胞、NK细胞、巨噬细胞、DCs细胞比例和细胞总数变化FACS检测结果显示(图2A),miR-126KD小鼠较WT小鼠脾脏中巨噬细胞的比例显著降低(P<0.05),NK细胞的比例显著增加(P<0.05),而γδT细胞、DCs的比例无统计学差异(P>0.05,图2B);同时,NK细胞的细胞总数显著增加(P<0.01),而γδT细胞、NK细胞、巨噬细胞的细胞总数无统计学差异(P>0.05,图2C)。
2.3miR-126KD小鼠脾脏中CD19+B细胞、CD3+T细胞比例和绝对数变化 用FACS检测CD19+B细胞、CD3+T细胞的比例和细胞总数的变化,结果显示(图3A),与WT小鼠相比,miR-126KD小鼠脾脏中CD3+T细胞的比例显著增加(P<0.05),而CD19+B+细胞的比例无统计学差异(P<0.05,图3B);同时,CD19+B细胞、CD3+T细胞的细胞总数都显著增加(P<0.05,图3C)。
2.4miR-126KD小鼠脾脏中CD4+T细胞、CD8+T细胞比例和绝对数变化 我们进一步用FACS检测CD4+T细胞、CD8+T细胞的比例。如图4A所示,miR-126KD小鼠脾脏中CD4+T细胞比例和绝对数都显著增加(P<0.05),CD8+T细胞比例及绝对数均无统计学差异(图4B、C)。
2.5miR-126KD小鼠脾脏中磷酸化NF-κB和磷酸化Akt水平明显改变 进一步Westernblot结果显示(图5A),与WT小鼠相比,miR-126KD小鼠脾脏中磷酸化NF-κB和磷酸化Akt表达水平明显增加(P<0.05,图5B)。

图1 miR-126KD小鼠脾脏细胞总数、miR-126的表达及病理形态学观察(HE染色)Fig.1 Change on total cells number,expression of miR-126,and pathologic morphology of spleens in miR-126KD mice(HE staining)Note: A.Total cells number;B.Expression of miR-126;C.The pathologic morphology of spleens in miR-126KD mice *.P<0.001 compared with WT mice.

图2 miR-126KD 小鼠脾脏γδT细胞、NK细胞、巨噬细胞、DCs细胞比例和绝对数的变化Fig.2 Change on proportion and cell counts of γδT cells,NK cells,Mφ cells,DCs in spleens in miR-126KD miceNote: Flow cytometry;B.Comparison of percentage;C.Absolute numbers.*.P<0.05,**.P<0.01 compared with WT mice.
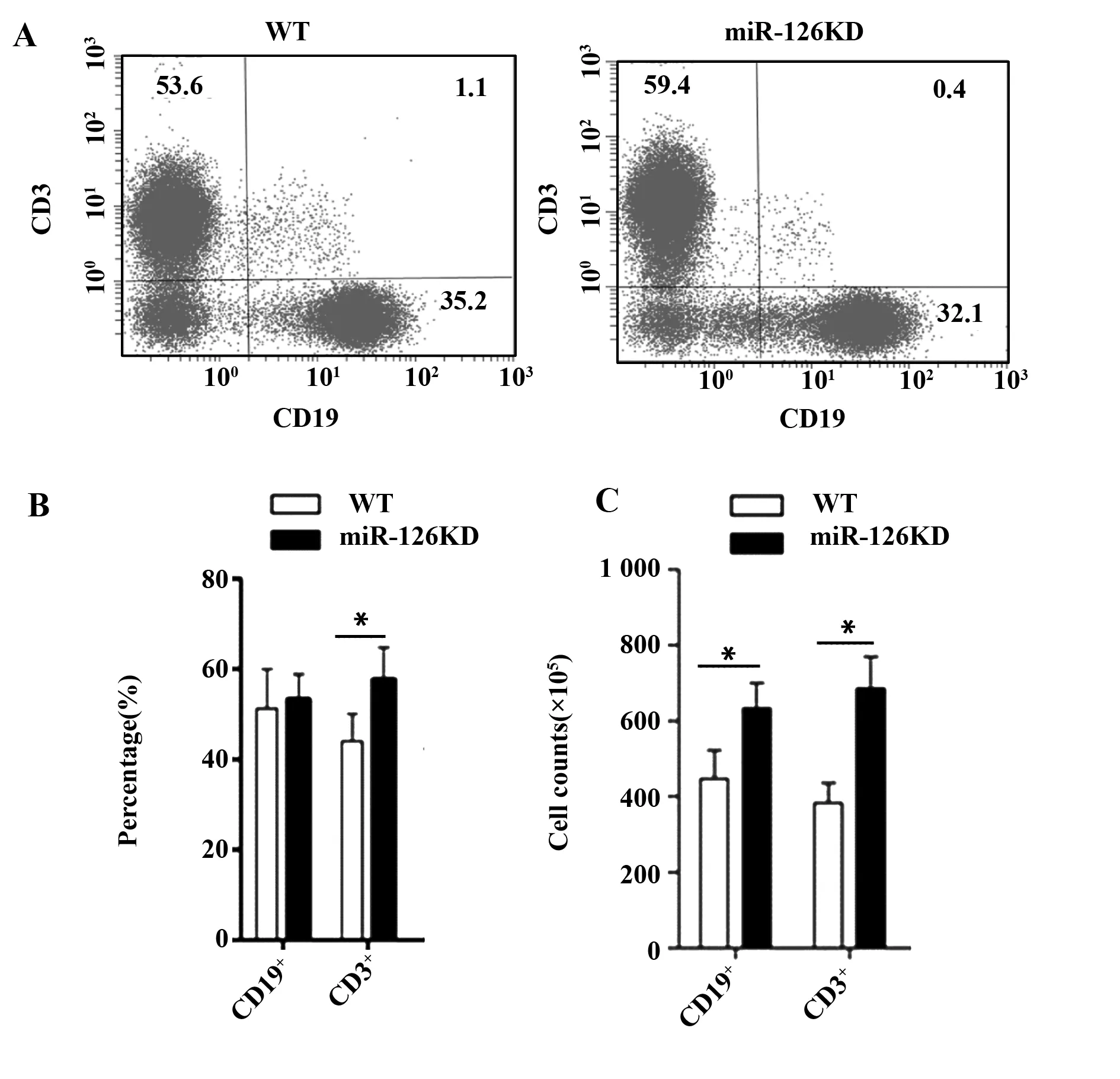
图3 miR-126KD小鼠脾脏中CD19+B细胞和CD3+T细胞比例和绝对数的变化Fig.3 Change on proportion and cell counts of CD19+B cells and CD3+T cells in spleens in miR-126KD miceNote: A.CD19+B cells and CD3+T cells were measured by Flow cytometry;B.Comparison of percentage;C.Absolute numbers.*.P<0.05 compared with WT mice.

图4 miR-126KD小鼠脾脏中CD4+T细胞、CD8+T细胞比例和绝对数变化Fig.4 Change on proportion and cell counts of CD4+T cells and CD8+T cells in spleens in miR-126KD miceNote: A.CD4+T cells and CD8+T cells were measured by Flow cytometry;B.Comparison of percentage;C.Absolute numbers.*.P<0.05 compared with WT mice.

图5 miR-126KD小鼠脾脏中磷酸化NF-κB和磷酸化Akt的变化Fig.5 Expression of p-Akt and p-NF-κB in spleen of miR-126KD miceNote: A.Western blot;B.Relative expression.*.P<0.05.
3 讨论
近年来,随着区域免疫(Regionalimmunity)的相关研究得到人们越来越多的关注,机体各免疫器官中相关免疫细胞的组成比例及其维持机制也受到了重视。免疫器官中各免疫细胞亚群组成比例的变化不仅反映了特定区域的免疫应答状态,并且对于相关疾病发生机制的认识均具有积极意义。新近的研究提示,多种miRNAs分子在机体免疫器官中免疫细胞组成比例的维持和功能发挥中具有重要调控作用。如:Kohlhaas等[11]发现,miR-155敲除后,脾和肠系膜淋巴结调节性T细胞的比例和数量均显著下降。在疾病机制发生中,Henao等[12]发现miR-146a可通过上调脾脏中CD4+T淋巴细胞比例,来增强机体清除B型肝炎病毒的能力。类似地,课题组前期研究发现miRNA-126敲减后可显著影响肠系膜淋巴结中T淋巴细胞亚群的比例和数量,提示其对肠系膜淋巴结中淋巴细胞的组成维持具有重要的调控作用[8]。
本研究发现miR-126KD小鼠脾脏中miR-126的表达水平下调,这与我们前期结果一致[10]。重要的是,我们发现脾脏中细胞总数明显增加,且脾脏中淋巴小结增生,皮质区淋巴细胞活跃,提示miR-126敲减后可显著影响脾脏中各免疫细胞的组成。进一步的检测显示,miR-126KD小鼠脾脏中γδT细胞和DCs细胞的比例和数量未改变。然而,NKT细胞的比例、细胞总数均明显增加,而巨噬细胞的比例下降,这提示miR-126KD敲减可影响脾脏中特定固有免疫细胞的组成。类似的,Muljo等[13]发现敲除Dicer酶后,小鼠胸腺中miRNA的表达锐减,导致T细胞的发育受阻,外周CD4+T细胞和CD8+T细胞的比例显著减少;且还有研究显示,Dicer酶敲除后还可影响胸腺调节性T细胞(RegulatoryTcells,Tregs)、NK、NKT细胞的发育[14,15]。此外,Bezman等[16]还研究发现敲除miRNA的Ly49H+NK细胞在巨噬细胞病毒(CMV)感染过程中,尽管其细胞数量显著增加,但均在功能成熟前死亡,以致机体不能产生有效免疫应答,提示miRNAs表达改变还会影响特定免疫细胞的功能。对于适应性免疫应答细胞,本研究发现miR-126KD小鼠脾脏中,不仅CD3+T细胞的比例和细胞数目明显增加,且CD4+T细胞的比例及绝对细胞数均显著增加;CD19+B细胞比例虽无明显变化,但CD19+B细胞的细胞总数却显著增加,提示miR-126敲减后可显著影响到脾脏中T、B细胞的组成变化。类似地,Henao等[17]研究发现miR-181敲除后小鼠胸腺中T细胞的比例显著下调,并且脾脏、肝脏中NKT细胞的绝对数也显著降低,且功能明显发生异常。此外,课题组前期研究发现miR-126敲减后可显著影响肠系膜淋巴结中T淋巴细胞的组成比例变化,提示其对肠系膜淋巴结中淋巴细胞的组成和功能具有重要的调控作用[8]。这些研究表明,特定的miRNAs分子可能对特定区域免疫器官中免疫细胞的组成或功能具有重要调控作用。
核因子-κB(Nuclearfactor-κB,NF-κB)和蛋白激酶B(ProteinkinaseB,PKB又称Akt)分别是Toll和PI3K/Akt信号通路的关键分子,同时在机体免疫细胞的组成及比例变化中发挥重要调控作用。研究发现在转基因小鼠中,通过活化AKT信号通路,导致小鼠体内T、B淋巴细胞在免疫和组织器官中的比例和数量均显著上调[18]。类似地,本研究中我们发现miRNA-126KD小鼠脾脏中磷酸化NF-κB和磷酸化Akt的表达均明显增加。已有的研究显示miR-126是Akt和NF-κB信号途径的重要调控分子[19,20]。我们前期也发现miR-126可通过对Akt信号途径的调控影响CD4+T细胞亚群CD4+CD25+调节性T细胞的外周诱导[21]。因此,我们推测miR-126可能通过NF-κB和Akt两条信号途径的调节来影响脾脏中特定免疫细胞亚群的组成及比例变化。然而,其相关具体分子机制还有待后续进一步研究阐明。
总之,本研究发现miR-126敲减后小鼠脾脏中免疫细胞的组成存在变化,这为后续深入探讨miR-126 在机体特定区域免疫应答中的作用提供了重要的前期实验依据。
[1] Vincenzo Bronte,Mikael J Pittet.The spleen in local and systemic regulation of immunity[J].Immunity,2013 ,39(5):806-818.
[2] Mebius RE,Kraal G.Structure and function of the spleen[J].Nat Rev Immunol,2005,5(8):606-616.
[3] Wu L,Dakic A.Development of dendritic cell system[J].Cell Mol Immunol,2004,1(2):112-118.
[4] Saito Y,Friedman JM,Chihara Y,etal.Epigenetic therapy upregulates the tumor suppressor microRNA-126 and its host gene EGFL7 in human cancer cells[J].Biochem Biophys Res Commun,2009,379(3):726-731.
[5] Zhang T,Li L,Shang Q,etal.Circulating miR-126 is a potential biomarker to predict the onset of type 2 diabetes mellitus in susceptible individuals[J].Biochem Biophys Res Commun,2015 ,463(1-2):60-63.
[6] Zhao S,Wang Y,Liang Y,etal.MicroRNA-126 regulates DNA methylation in CD4+T cells and contributes to systemic lupus erythematosus by targeting DNA methyltransferase 1[J].Arthritis Rheum,2011,63(5):1376-1386.
[7] Okuyama K,Ikawa T,Gentner B,etal.MicroRNA-126-mediated control of cell fate in B-cell myeloidprogenitors as a potential alternative to transcriptional factors[J].Proc Natl Acad Sci USA,2013,110(33):13410-13415.
[8] 张忆雄,胡 燕,郭萌萌,等.miRNA-126 基因敲减小鼠肠系膜淋巴结T淋巴细胞比例的变化[J].中国免疫学杂志,2014,30(9):1157-1160.
[9] 胡 燕,廖珍媛,李永菊,等.真核表达载体pEGFP-C2-miR-126-sponge的构建及其表达活性研究[J].第三军医大学学报,2014,36(01):33-37.
[10] 胡 燕,李永菊,陈 超,等.microRNA-126 基因敲减小鼠的鉴定及其血糖水平变化[J].J Cent South Univ(Med Sci),2015,40(1):12-17.
[11] Kohlhaas S,Garden OA,Scudamore C,etal.Cutting edge:the Foxp3 target miR-155 contributes to the development of regulatory T cells[J].J Immunol,2009,182(5):2578-2582.
[12] Henao-Mejia J,Williams A,Goff LA,etal.The microRNA miR-181 is a critical cellular metabolic rheostat essential for NKT cell ontogenesis and lymphocyte development and homeostasis [J].Immunity,2013 ,38(5):984-997.
[13] Muljo SA,Ansel KM,Kanellopoulou C,etal.Aberrant T cell differentiation in the absence of Dicer[J].J Exp Med,2005,202(2):261-269.
[14] Devasthanam AS,Tomasi TB.Dicer in immune cell development and function[J].Immunol Invest,2014,43(2):182-195.
[15] Cobb BS,Hertweck A,Smith J,etal.A role for Dicer in immune regulation[J].J Exp Med,2006,203(11):2519-2527.
[16] Bezman NA,Cedars E,Steiner D F,etal.Distinct requirements of microRNAs in NK cell activation,survival,and function[J].J Immunol,2010,185(7):3835-3846.
[17] Henao-Mejia J,Williams A,Goff LA,etal.The microRNA miR-181 is a critical cellular metabolic rheostat essential for NKT cell ontogenesis and lymphocyte development and homeostasis[J].Immunity,2013,38(5):984-997.
[18] Parsons MJ,Jones RG,Tsao MS,etal.Expression of active protein kinase B in T cells perturbs both T and B cell homeostasis and promotes inflammation[J].J Immunol,2001,167(1):42-48.
[19] Huang F,Fang ZF,Hu XQ,etal.Overexpression of miR-126 promotes the differentiation of mesenchymal stem cells toward endothelial cells via activation of PI3K/Akt and MAPK/ERK pathways and release of paracrine factors[J].Biol Chem,2013,394(9):1223-1233.
[20] Lin Fu,Jinlong Shi,Kai Hu,etal.Mitogen-activated protein kinase binding protein 1 (MAPKBP1)is an unfavorable prognostic biomarker in cytogenetically normal acute myeloid leukemia[J].Oncotarget,2015,6(10):8144-8154.
[21] Qin A,Wen Z,Zhou Y,etal.MicroRNA-126 regulates the induction and function of CD4(+) Foxp3(+)regulatory T cellsthrough PI3K/AKT pathway [J].J Cell Mol Med,2013,17(2):252-264.
[收稿2015-07-15 修回2015-08-03]
(编辑 张晓舟)
Change on composition of immune cells in spleen of miRNA-126 knockdown mice
LEI Liang-Yu,HU Yan,GUO Meng-Meng,LU Jia,ZHENG Wen,XU Hua-Lin,CHEN Chao,XU Lin.Department of Immunology,Zunyi Medical College,Zunyi 563000,China
Objective:To detect the change of composition of immune cells in the spleen of miR-126 knockdown(miR-126KD)mice and preliminarily explore its significance.Methods: The expression level of miR-126 in spleens of miR-126KD mice was deter-mined by Realtime PCR.And the total number of splenocytes was calculated.The pathologic morphology change of the spleen was observed by HE staining.And the changes on proportion of DCs,macrophages cells ,γδ T cells and NK T cells,CD3+T cells and its subgroup ,as well as CD19+B cells in spleens of miR-126KD mice were analyzed by Flow cytometry and calculated respectively.The level of phosphorylated AKt and NF-κB was analyzed by Western blot assay.Results: Compared with those of WT mice,the expression level of miR-126 decreased obviously(P<0.05)and the total number of cells increased obviously in spleen of miR-126KD mice(P<0.05).Moreover,the pathologic morphology of miR-126KD mice was significantly changed.The proportion and number of NK T cells in the inherent cells were significantly increased(P<0.05),but the proportion of Mφ cells were significantly decreased(P<0.05).Meanwhile,the proportion and number of CD3+T cells and CD4+T cells in the adaptive immune cells were significantly increased(P<0.05),while the total number of CD19+B cells were significantly decreased(P<0.05).Last,the level of phosphorylation Akt and NF-κB increased obviously in spleen of miRNA-126 knockdown mice.Conclusion: Change obviously on the composition of immune cells subsets in the spleen of miRNA-126 knockdown mice,which it may be related to the altered level of phosphorylated AKt and NF-κB and provides a preliminary experimental basis for the further exploring the roles of miR-126 in immune response.
miR-126;Knockdown;Immune cells;Composition
10.3969/j.issn.1000-484X.2016.04.002
①本文受国家自然科学基金(No. 31370918)和教育部新世纪优秀人才计划(NCET-12-0661)资助。
雷良玉(1989年-),女,在读硕士,主要从事肿瘤方面研究,E-mail:llymay@126.com。
及指导教师:徐 林(1977年-),男,博士,教授,主要从事肿瘤免疫学和分子免疫学研究,E-mail:xulinzhouya@163.com。
R392
A
1000-484X(2016)04-0460-05