两种蒽衍生物类深蓝光材料的合成与发光性能
王志强, 孙晓娟, 绪连彩, 张智强
(1. 洛阳师范学院化学化工学院 功能导向多孔材料河南省重点实验室, 河南 洛阳 471934;2. 郑州轻工业学院 材料与化学工程学院, 河南 郑州 450001)
两种蒽衍生物类深蓝光材料的合成与发光性能
王志强1*, 孙晓娟1,2, 绪连彩2*, 张智强2
(1. 洛阳师范学院化学化工学院 功能导向多孔材料河南省重点实验室, 河南 洛阳 471934;2. 郑州轻工业学院 材料与化学工程学院, 河南 郑州 450001)
利用Suzuki偶合反应合成了两种新的蒽衍生物9,10-二(2-联苯基)蒽(BBPA)和9,10-二[2-(α-萘基)苯基]蒽(BNPA),化合物结构通过核磁、质谱及元素分析进行了表征。量子化学计算结果显示,这两种化合物都具有非共面的分子结构,光物理性能主要决定于分子中的蒽结构单元。这两种化合物在二氯甲烷溶液中均可发射高效率的蓝光。BBPA在固态薄膜状态下的发射光谱相对其二氯甲烷溶液的发射光谱明显变宽,而BNPA的固态薄膜并未发生光谱变宽现象。分别利用化合物BBPA和BNPA作为发光层材料,制备出了非掺杂的深蓝光电致发光器件。发光层为BBPA的电致发光器件的最大外量子效率和CIE色坐标分别为2.48%和(0.16,0.09);基于BNPA的电致发光器件的最大外量子效率为2.68%,CIE色坐标为(0.15,0.07)。所制备的这两种器件均表现出了较低的开启电压和良好的稳定性。
电致发光; 深蓝光材料; 蒽衍生物; 非掺杂器件
1 引 言
作为下一代平板显示技术,有机电致发光二极管(Organic light-emitting diodes, OLEDs)具有主动发光、驱动电压低、响应速度快、视角宽、器件轻薄、可实现柔性显示等优点,近年来一直受到学术界和产业界的广泛关注[1-3]。若要实现OLEDs的全彩显示,红、绿、蓝三基色发光材料必不可少。其中,蓝光材料尤为重要,它不仅可以提供必要的蓝色发射光,还可以通过能量转移获得绿光和红光;而且,蓝光材料也是有效降低全彩OLEDs能耗的关键[4]。但由于蓝光材料能隙较宽,其电子轨道能级与载流子注入/传输材料的能级匹配性较差,较高的激发态能级也会降低材料的工作稳定性,使得开发高性能蓝光材料和电致发光器件非常困难[4]。目前,对红光和绿光材料的研究比较成熟,其器件的性能已达到了实际应用的水平,而蓝光OLEDs的性能仍需进一步提高。
发光色纯度是评价OLEDs性能的一项重要指标。根据美国国家电视标准委员会(NTSC)制定的标准,蓝光的CIE色坐标值应为(x=0.14,y=0.08),在CIE色度图中位于深蓝光区域。近年来,深蓝光OLEDs一直是有机电致发光领域的研究热点,已有多种类型的深蓝光材料被报道,如蒽衍生物、芘衍生物、芴衍生物以及D-π-A型分子内电荷转移化合物等[5-20]。为了提高深蓝光OLEDs的效率,器件的发光层可采用主/客体掺杂结构。如最近Xiao课题组将一种苣衍生物BPCC以20%的浓度掺杂于主体材料tCP中,制备出了外量子效率最高可达到4.9%的深蓝光器件[21]。然而,主/客体结构OLEDs的发光层在工作过程中容易发生相分离现象,器件稳定性较差;而且,主/客体结构掺杂型器件的制备工艺较为复杂,将会增加规模化制备的成本。与之相比,发光层采用单一材料的非掺杂深蓝光OLEDs更加符合实际应用的要求,也是深蓝光OLEDs的重点研究方向。
众所周知,9,10-二苯基蒽(DPA)可以发射深蓝光,且发光效率高。但其并不适合作为发光材料在OLEDs中应用,因为该化合物容易结晶,难以形成稳定的非晶态薄膜,而且DPA在固态下荧光猝灭严重。通过在DPA的两个苯取代基上引入较大的功能基团,能有效改善材料的成膜性、光物理性能以及热稳定性等性能,从而可获得优秀的深蓝光电致发光材料[5]。
基于以上原因,我们设计、合成了两种新的深蓝光材料9,10-二(2-联苯基)蒽(BBPA)和9,10-二[2-(α-萘基)苯基]蒽(BNPA)。在BBPA和BNPA分子中,引入的苯基和α-萘基均位于DPA母体中苯取代基的2位,可通过位阻效应提高材料分子结构的非共面性,从而降低材料的发光波长,使其更加接近深蓝光区,提高发光色纯度。量子化学计算和光物理性能研究结果均证明了这种结构设计的合理性。我们分别用BBPA和BNPA作为发光层材料制备出了非掺杂的深蓝光电致发光器件。尤其是基于BNPA的器件,表现出了较为理想的性能,器件最大外量子效率为2.68%,CIE色坐标为(0.15,0.07)。
2 实 验
2.1 仪器和试剂
实验所用化学试剂均为分析纯,分别从北京百灵威科技有限公司、北京偶合科技有限公司、郑州通广生物化工科技有限公司、洛阳昊华化学试剂有限公司购买。实验中使用的仪器主要有Bruker Avance 400核磁共振仪、Bruker APEX IV质谱仪、Vario EL Ⅲ元素分析仪、CHI620C电化学工作站、U-3010紫外-可见光谱仪、F-4500荧光光谱仪以及Gaussian 03计算软件。
2.2 化合物的合成
化合物BBPA的合成方法如图1所示。将9,10-二溴蒽1(0.67 g,2 mmol)、2-联苯硼酸2(0.87 g,4.4 mmol)和催化剂四(三苯基膦)钯(80 mg)加入50 mL两口烧瓶中,搭建回流反应装置。抽真空,充氮气,反复3次。然后向烧瓶中依次注入甲苯(15 mL)、无水乙醇(5 mL)和浓度为2 mol/L的碳酸钠水溶液(5 mL)。在氮气保护条件下,110 ℃回流反应24 h。冷却至室温,用二氯甲烷萃取反应液3次,合并萃取液,减压蒸干溶剂得到粗产品。柱层析法提纯粗产品,淋洗剂为石油醚-二氯甲烷混合溶液(体积比10∶1),得到白色粉末状固体0.53 g,产率为55%。1H NMR(400 MHz,CDCl3)δ:7.59~7.56(9H,m),7.38~7.36(2H,d,J=7.2),7.32~7.30(1H,d,J=8.0),7.22~7.19(4H,m),6.96~6.77(10H,m)。ESI-MSm/z:483.22 [M+H+]。Anal. Calcd. for C38H26:C,94.57, H, 5.43; Found:C,94.45, H,5.38。
化合物BNPA的合成方法与BBPA类似(图1)。将9,10-二溴蒽1(0.67 g,2 mmol)、2-(α-萘基)苯硼酸3(1.09 g,4.4 mmol)和催化剂四(三苯基膦)钯(80 mg)加入50 mL两口烧瓶中,搭建回流反应装置。抽真空,充氮气,反复3次。然后向烧瓶中依次注入甲苯(15 mL)、无水乙醇(5 mL)和浓度为2 mol/L的碳酸钠水溶液(5 mL)。在氮气保护条件下,110 ℃回流反应24 h。冷却至室温,过滤,收集沉淀。滤液用二氯甲烷萃取3次,合并萃取液,减压蒸干溶剂,得到的固体与过滤收集的沉淀合并,即为粗产品。柱层析法提纯粗产品,淋洗剂为石油醚-二氯甲烷混合溶液(体积比8∶1),得到白色粉末状固体0.56 g,产率为48%。1H NMR (400 MHz,CDCl3)δ:8.25(2H,d,J=8.0),8.15~7.87(6H,m),7.83~7.61(8H,m),7.56~7.43(6H,m),7.39~7.31(4H,m),7.25~7.18(4H,m)。ESI-MSm/z:583.25 [M + H+]。Anal. Calcd. for C46H30:C,94.81,H,5.19; Found:C,94.68,H,5.12。
2.3 器件的制备与性能表征
电致发光器件的制备过程如下:将ITO玻璃基板分别用丙酮、无水乙醇和去离子水超声清洗,在烘箱中120 ℃烘干,然后用紫外-臭氧(UV-ozone)处理。真空条件下(5×10-4Pa),在处理后的ITO基板上依次蒸镀各有机层、LiF和金属电极层,器件发光面积为2 mm×2 mm。器件的电致发光光谱和CIE色坐标采用PR650光谱仪测定,电流-电压-亮度特性用multimeter 2000(Keithley)电流计、R6145(Advantest)电压计和LS-110(Minolta)亮度计测定。所有测量均由计算机系统自动控制,在室温、常压、空气环境下进行。

图1 化合物BBPA和BNPA的合成
Fig.1 Synthesis of BBPA and BNPA
3 结果与讨论
3.1 量子化学计算
用Gaussion 03软件采用B3LYP/6-31G(d)方法,对化合物BBPA和BNPA的立体结构和前沿分子轨道进行了量子化学计算。计算结果显示,这两种化合物的分子结构均具有高度的非共面性(图2)。在化合物BBPA中,蒽结构单元与其9、10位上苯环间的夹角为89.5°,两个相邻苯环间的夹角为88.9°;在化合物BNPA中,蒽结构单元与其9、10位上苯环间的夹角为80.0°,苯环与萘环间的夹角为62.3°。这种高度非共面的分子结构可以有效抑制分子间的相互作用,有利于材料形成稳定的非晶态薄膜。如图2所示,两种化合物的最高电子占据轨道(HOMO)和最低电子未占轨道(LUMO)主要集中在蒽结构单元上,只有很少量分布在苯结构单元上,说明BBPA和BNPA的光物理性能主要取决于蒽结构单元。
3.2 光物理性能
BBPA在二氯甲烷溶液中的紫外-可见(UV-Vis)吸收光谱与光致发光(PL)光谱如图3所示。在吸收光谱中, 343,360,379,400 nm处的吸收峰为蒽结构单元的特征吸收[6-7]。用任一吸收峰对应波长的光作为激发光,BBPA二氯甲烷溶液均可发射蓝光,PL光谱在416 nm和437 nm有两个发射峰。如图4所示,BNPA在二氯甲烷溶液中的吸收光谱也显示了蒽结构单元的特征吸收,吸收峰分别位于344,361,380,401 nm处。BNPA二氯甲烷溶液在420 nm和440 nm有两个发射峰(图4),为蓝色发射光。与BBPA相比,BNPA的吸收光谱和PL光谱均有少量红移。根据量子化学计算结果可知,在BNPA分子中蒽结构单元与相邻苯环间的夹角较小,故它们之间的共轭程度相对较大,这应该是其光谱红移的原因。两种化合物在二氯甲烷溶液中都表现出了高发光效率,用DPA作为参比,测得BBPA和BNPA的荧光量子产率(Φ)分别为0.86和0.79。
图3 化合物BBPA的吸收和光致发光光谱(λex=379 nm)
Fig.3 Absorption and PL (λex=379 nm) spectra of BBPA
为了考察BBPA和BNPA非晶态薄膜的光物理性能,我们以石英片作为衬底,用真空蒸镀法制备了这两种化合物的薄膜(厚度为10 nm)。如图3所示,BBPA薄膜在420 nm和438 nm有两个发射峰,与BBPA二氯甲烷溶液的PL光谱相比,薄膜的PL光谱明显变宽。BNPA薄膜的最大发射峰出现在427 nm,并在445 nm有一肩峰(图4),BNPA薄膜的PL光谱相对于该化合物二氯甲烷溶液的PL光谱并没有明显变宽,只是发生了约7 nm的红移。量子化学计算结果显示,这两种化合物的光物理性能主要决定于分子中的蒽结构单元。因此,BBPA薄膜的PL光谱变宽应该是由分子中蒽结构单元间较强的相互作用引起的。由于在BNPA分子中引入了较大的萘基团,薄膜状态下分子中蒽结构单元间的相互作用能够得到有效抑制,故BNPA薄膜的PL光谱只是发生了少量的红移,并未变宽。
图4 化合物BNPA的吸收和光致发光光谱(λex=380 nm)
Fig.4 Absorption and PL (λex=380 nm) spectra of BNPA
3.3 电致发光性能

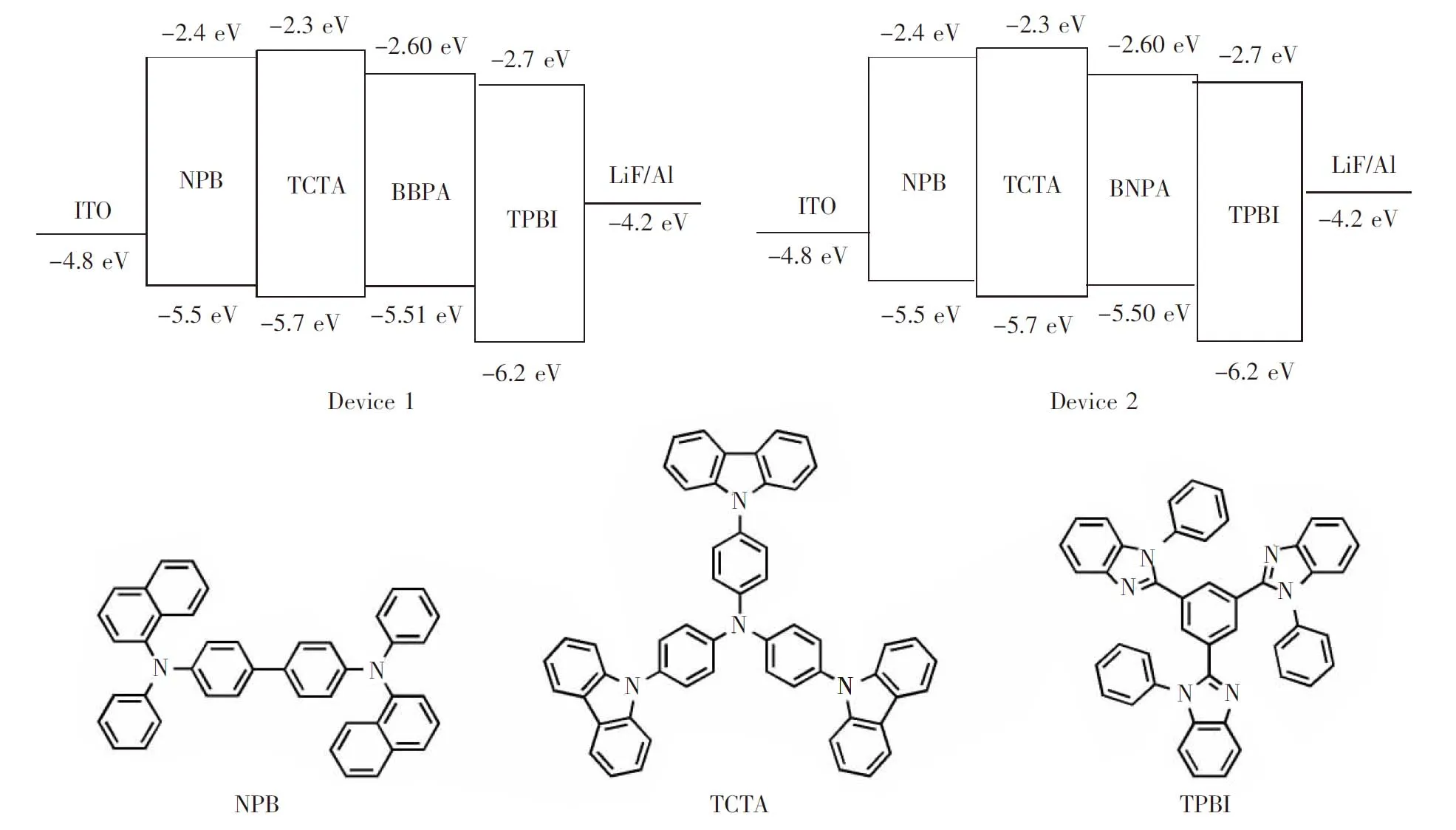
图5 器件1和2中材料的分子结构和能级
Fig.5 Energy level diagrams and molecular structures of materials in Devices 1 and 2
图6、7分别为器件1和2在不同亮度下的电致发光(EL)光谱。器件1的最大发射峰位于444 nm,并分别在424 nm和467 nm处有两个肩峰;器件2的EL光谱在428 nm和448 nm处有两个发射峰。这两个器件的EL光谱中均未出现激基复合物的发射峰。在10~1 000 cd/m2亮度范围内,这两个器件的EL光谱和CIE色坐标几乎没有改变,说明器件具有较高的稳定性。器件1和2的CIE色坐标分别为(0.16,0.09)和(0.15,0.07),均为深蓝光,尤其是器件2的CIE色坐标非常接近NTSC的蓝光标准值。
Fig.6 EL spectra of Device 1 under different luminance
图8为器件1和2的电流密度-电压-亮度(I-V-L)曲线。这两个器件的电流密度-电压(I-V)曲线具有明显的二极管特征。器件1和2在发光亮度为1 cd/m2时的电压(开启电压)均为3.8 V。如图5所示,在这两个器件中,发光层材料BBPA、BNPA与相邻的激子阻挡层材料TCTA间的HOMO能级差均在0.2 eV以内,而BBPA、BNPA与相邻的电子传输层材料TPBI间的LUMO能级差更小,仅为0.1 eV,这应当是器件开启电压较低的主要原因。器件1和2的最大发光亮度分别为2 299 cd/m2和3 127 cd/m2,此时的电流密度分别为527.3 mA/cm2和538.5 mA/cm2。
Fig.8 Current density-voltage-luminance characteristics of Devices 1 and 2
Fig.9 Luminance-external quantum efficiency characteristics of Devices 1 and 2
图9为这两个器件的外量子效率(EQE)-亮度曲线。器件1在亮度为83 cd/m2时,EQE达到最大值2.48%,对应的电压、电流密度分别为5 V和6.6 mA/cm2;器件2的EQE在亮度为93 cd/m2时达到最大值2.68%,此时的电压和电流密度分别为5 V和8.2 mA/cm2。而且,随着亮度的增加,这两个器件的EQE都没有出现严重的下降,特别是器件2,在发光亮度为1 000 cd/m2时,EQE仍可达到2.15%,为最大EQE的80%。
4 结 论
合成了两种新的蒽衍生物类深蓝光电致发光材料BBPA和BNPA。这两种材料在二氯甲烷溶液中均能发射高效率的深蓝光。由于在BBPA分子中引入的苯取代基较小,所以固态薄膜状态下,该化合物中的蒽结构单元间存在较强的相互作用,导致薄膜的PL光谱变宽。而由于在BNPA分子中引入了较大的萘取代基,所以该化合物薄膜没有发生PL光谱变宽的现象。分别用这两种化合物作为发光层制备出了非掺杂的深蓝光电致发光器件。基于BNPA的器件表现出了更高的性能,开启电压为3.8 V,CIE色坐标为(0.15,0.07),最大外量子效率为2.68%,而且该器件具有良好的稳定性。本文不仅提供了两种高效率深蓝光电致发光材料,研究结果也对蒽衍生物类深蓝光材料的设计具有较高的参考价值。
[1] TANG C W, VANSLYKE S A. Organic electroluminescent diodes [J].Appl.Phys.Lett., 1987, 51(12):913-915.
[2] ZHU X H, PENG J B, CAO Y,etal.. Solution-processable single-material molecular emitters for organic light-emitting devices [J].Chem.Soc.Rev., 2011, 40(7):3509-3524.
[3] BESSETTE A, HANAN G S. Design, synthesis and photophysical studies of dipyrromethene-based materials: insights into their applications in organic photovoltaic devices [J].Chem.Soc.Rev., 2014, 43(10):3342-3405.
[4] YANG X L, XU X B, ZHOU G J. Recent advances of the emitters for high performance deep-blue organic light-emitting diodes [J].J.Mater.Chem. C, 2015, 3(5):913-944.
[5] HUANG J H, SU J H, TIAN H. The development of anthracene derivatives for organic light-emitting diodes [J].J.Mater.Chem., 2012, 22(22):10977-10989.
[6] KIM R, LEE S, KIM K H,etal.. Extremely deep blue and highly efficient non-doped organic light emitting diodes using an asymmetric anthracene derivative with a xylene unit [J].Chem.Commun., 2013, 49(41):4664-4666.
[7] WANG J, LOU X, LIU Y Q,etal.. Controllable molecular configuration for significant improvement of blue OLEDs based on novel twisted anthracene derivatives [J].DyesPigm., 2015, 118:137-144.
[8] JOU J H, KUMAR S, FANG P H,etal.. Highly efficient ultra-deep blue organic light-emitting diodes with a wet- and dry-process feasible cyanofluorene acetylene based emitter [J].J.Mater.Chem. C, 2015, 3(10):2182-2194.
[9] WANG C F, HUNG W Y, CHENG M H,etal.. Functionalized terfluorene for solution-processed high efficiency blue fluorescence OLED and electrophosphorescent devices [J].Org.Electron., 2013, 14(8):1958-1965.
[10] LEE S B, PARK K H, JOO C W,etal.. Highly twisted pyrene derivatives for non-doped blue OLEDs [J].DyesPigm., 2016, 128:19-25.
[11] WANG Z Q, LIU C L, ZHENG C J,etal.. Efficient violet non-doped organic light-emitting device based on a pyrene derivative with novel molecular structure [J].Org.Electron., 2015, 23:179-185.
[12] KAAFARANI B R, EL-BALLOULI A O, TRATTNIG R,etal.. Bis(carbazolyl) derivatives of pyrene and tetrahydropyrene: synthesis, structures, optical properties, electrochemistry, and electroluminescence [J].J.Mater.Chem. C, 2013, 1(8):1638-1650.
[13] ZHANG Y, LAI S L, TONG Q X,etal.. High efficiency nondoped deep-blue organic light emitting devices based on imidazole-π-triphenylamine derivatives [J].Chem.Mater., 2012, 24(1):61-70.
[14] YE J, CHEN Z, FUNG M K,etal.. Carbazole/sulfone hybrid D-π-A-structured bipolar fluorophores for high-efficiency blue-violet electroluminescence [J].Chem.Mater., 2013, 25(13):2630-2637.
[15] HU J Y, PU Y J, SATOH F,etal.. Bisanthracene-based donor-acceptor-type light-emitting dopants: highly efficient deep-blue emission in organic light-emitting devices [J].Adv.Funct.Mater., 2014, 24(14):2064-2071.
[16] CHEN W C, WU G F, YUAN Y,etal.. A meta-molecular tailoring strategy towards an efficient violet-blue organic electroluminescent material [J].RSCAdv., 2015, 5(23):18067-18074.
[17] LIU X K, ZHENG C J, LO M F,etal.. A multifunctional phosphine oxide-diphenylamine hybrid compound as a high performance deep-blue fluorescent emitter and green phosphorescent host [J].Chem.Commun., 2014, 50(16):2027-2029.
[18] HE C Y, GUO H Q, PENG Q M,etal.. Asymmetrically twisted anthracene derivatives as highly efficient deep-blue emitters for organic light-emitting diodes [J].J.Mater.Chem. C, 2015, 3(38):9942-9947.
[19] LI L, JIAO B, YU Y,etal.. Fluorinated anthracene derivatives as deep-blue emitters and host materials for highly efficient organic light-emitting devices [J].RSCAdv., 2015, 5(73):59027-59036.
[20] 胡俊涛,宗艳凤,邓亚飞,等. 溶液法制备SimCP∶FIrpic掺杂的蓝色磷光器件 [J]. 液晶与显示, 2015, 30(2):240-245. HU J T, ZONG Y F, DENG Y F,etal.. Solution processible SimCP∶FIrpic doped blue phosphorescent devices [J].Chin.J.Liq.Cryst.Disp., 2015, 30(2):240-245. (in Chinese)
[21] CHUNG Y H, SHENG L, XING X,etal.. A pure blue emitter (CIEy≈0.08) of chrysene derivative with high thermal stability for OLED [J].J.Mater.Chem. C, 2015, 3(8):1794-1798.
王志强(1978-),男,河南睢县人,博士,副教授,2007年于中国科学院理化技术研究所获得博士学位,主要从事有机电致发光材料的研究。E-mail: wzq197811@163.com
Synthesis and Luminescence of Two Deep-blue Emitting Anthracene Derivatives
WANG Zhi-qiang1*, SUN Xiao-juan1,2, XU Lian-cai2*, ZHANG Zhi-qiang2
(1. College of Chemistry and Chemical Engineering and Henan Key Laboratory of Function-OrientedPorousMaterials,LuoyangNormalUniversity,Luoyang471934,China;2.DepartmentofMaterialandChemicalEngineering,ZhengzhouUniversityofLightIndustry,Zhengzhou450001,China)*CorrespondingAuthors,E-mail:wzq197811@163.com;xulc@zzuli.edu.cn
Two new anthracene derivatives 9,10-bis(2-biphenyl)anthracene (BBPA) and 9,10-bis[2-(α-naphthyl]phenyl] anthracene (BNPA) were synthesized by Suzuki coupling reaction and characterized by1H NMR, mass spectrum and elemental analysis. The quantum chemistry calculations show that these compounds have non-coplanar structures and their photophysical properties are controlled by the anthracene unit. Both of these compounds exhibit high-efficiency blue emission in CH2Cl2solutions. The emission spectrum of BBPA as solid film is obviously broader than that measured from CH2Cl2solution, while the emission spectrum of BNPA as solid film does not broaden compared to that acquired from CH2Cl2solution. Two deep-blue non-doped electroluminescent devices were fabricated employing BBPA or BNPA as emitting layer. The device based on BBPA exhibits a maximum external quantum efficiency of 2.48% and CIE coordinate of (0.16, 0.09). The device based on BNPA acquires a maximum external quantum efficiency of 2.68% and CIE coordinate of (0.15, 0.07). In addition, both of these devices show low turn-on voltage and high stability.
electroluminescence; deep-blue materials; anthracene derivatives; non-doped devices
1000-7032(2016)12-1451-07
2016-07-09;
2016-09-05
国家自然科学基金(U1404209); 河南省教育厅科学技术研究重点项目(13A150804)资助
TN383+.1
A
10.3788/fgxb20163712.1451

