ITC研究达卡巴嗪与DNA反应动力学
王 欢, 王 姣, 李宗孝, 赵微微, 蒲小华, 程花蕾
(宝鸡文理学院 化学化工学院, 陕西省植物化学重点实验室, 陕西 宝鸡 721013)
ITC研究达卡巴嗪与DNA反应动力学
王 欢, 王 姣, 李宗孝, 赵微微*, 蒲小华, 程花蕾
(宝鸡文理学院 化学化工学院, 陕西省植物化学重点实验室, 陕西 宝鸡 721013)
利用等温滴定量热(ITC)、光谱、粘度测量等方法,研究了小牛胸腺DNA与抗癌药物达卡巴嗪的相互作用。结果表明:达卡巴嗪与DNA作用后,吸收光谱会出现增色、蓝移和粘度减小等现象。采用ITC法得到了结合常数以及结合位点数,发现达卡巴嗪与DNA以非经典嵌插式及表面作用两种方式结合。对于嵌插式,ΔH1<0,ΔS1>0,K1=5.63×104,结合位点数0.10;对于药物分子仅与DNA表面发生作用而并未嵌入到DNA分子的疏水部分的结合方式,ΔH2>0,ΔS2>0,K2=1.00×103,结合位点数9.99。同时发现紫外法得到的结合常数是Ka=6.70×104,与ITC的嵌插式吻合。
DNA; 达卡巴嗪; 光谱法; 作用机理; 等温滴定量热
1 引 言
生物大分子包括蛋白质、核酸、脂类、糖类等,它们参与了生命活动的所有过程[1-3]。DNA是生物体内最重要的生物大分子,是绝大多数生物遗传信息的载体,对生物的遗传进化起着重要的作用。许多外源性的小分子可以与DNA结合,这种相互作用能引起DNA的断裂,或者改变DNA的结构,破坏其作为核酸模板的功能,影响DNA复制和转录等功能,导致细胞癌变、突变或者死亡[4-8]。近年来,许多学者对于小分子与DNA的相互作用做了研究:刘振佳等[9]利用圆二色谱技术研究了DNA 与小分子化合物的相互作用;龙泉鑫等[10]对喹诺酮类药物断裂复合体与DNA复制的抑制进行了研究;钟文英等[11]探讨了巴罗沙星与DNA的相互作用及Mg2+的影响。但广谱抗肿瘤药物达卡巴嗪 (Dacarbazine,DAC)与DNA的作用尚未见报道。本文利用ITC法检测探讨了DAC导致癌细胞死亡的作用机制及抗癌原理,阐述了反应的驱动力。
2 实 验
2.1 仪器与试剂
实验中使用的仪器主要有NANO 等温滴定量热仪(美国TA)、UV-2550紫外-可见分光光度计(日本岛津)和Advantage A10超纯水处理系统(美国Millipore Q)。
实验中使用的试剂主要有达卡巴嗪(DAC)、小牛胸腺DNA、三羟甲基氨基甲烷(AR,Tris)和盐酸(AR,HCl)。所需溶液均用Tris-HCl缓冲溶液(0.05 mol·L-1,pH=7.40)溶解,用DNA 在260 nm处的吸光度与280 nm处的吸光度比值检验其纯度(A260/A280>1.80)。DNA浓度利用ε260=6 600 L·(mol·cm)-1来确定。溶液均于4 ℃的冰箱中储备。实验用水均为超纯水(18.2 MΩ·cm,25 ℃)。
2.2 实验方法
采用等温滴定量热法、粘度法、紫外吸收法对DNA与DAC的相互作用进行测试和分析。
3 结果与讨论
3.1 DNA-DAC的吸收光谱
在常压及25 ℃下,以Tris-HCl作缓冲液(0.05 mol·L-1,pH=7.40),CDNA=5.82×10-5mol·L-1,CDAC=5.81×10-5mol·L-1,分别绘制吸收光谱,如图1所示。
图1分别为DNA、DAC及DNA与DAC作用后的紫外吸收曲线。其中DNA和DAC吸收值的和不完全等于DNA-DAC的吸收值,二者相差0.049。这可能是因为药物DAC与DNA作用形成了复合物,从而导致DNA紫外吸收性质的改变,使得特征峰强度增大,最终导致单纯的DNA、DAC线的叠加不等于DNA-DAC线之值。
图1 DNA、DAC及DNA-DAC在Tries-HCl ( 0.05 mol·L-1, pH =7.40)中的紫外吸收光谱。
Fig.1 UV absorption spectra of DNA, DAC and DNA-DAC in Tris-HCl ( 0.05 mol·L-1, pH=7.4 ), respectively.
3.2 DAC与DNA的作用方式推断
按3.1的方法,固定DNA浓度(2.05×10-4mol·L-1),将DAC浓度由5.53×10-6mol·L-1增加到3.73×10-5mol·L-1,获得紫外光谱如图2 所示。
图2 室温下达卡巴嗪与DNA相互作用的紫外-可见吸收光谱
Fig.2 UV-Vis absorption spectra of the interaction between DNA and DAC at room temperature
一般而言,DNA的碱基在250~270 nm之间有吸收,其特征吸收峰在260 nm处,该特征峰常用于确定DNA 的浓度。通过DNA 和小分子药物作用的增色/减色效应或者吸收带的红移/蓝移等现象[12-13],可以确定药物分子和DNA 作用的方式。
图2显示, DNA在300~360 nm区间没有吸收峰,但随着DAC的逐渐加入,在330 nm附近出现新的吸收峰,该吸收峰是DAC的特征吸收;同时,在260 nm处的DNA特征吸收峰随着DAC浓度的增加出现增色效应,并伴随微小的吸收带蓝移。这表明药物DAC没有插入到DNA碱基对之间的平面中,说明DAC与DNA并不是以经典的嵌插结合模式结合,而是以其他方式结合。
若以CDNA表示DNA的浓度,εf、εa和εb分别代表自由态、部分结合和完全结合的化合物的摩尔消光系数,按照公式[14]
(1)
并以CDNA/(εa-εf)对CDNA作图,得到图3。
由截距1/Ka(εb-εf) 得该体系的结合常数Ka为6.70×104L·mol-1。
3.3 利用DNA的熔点特征确定结合方式
常压下,分别将DNA、DNA-DAC置于恒温水浴槽中,从25 ℃开始每间隔5 ℃测定DNA、DNA- DAC两种体系在260 nm处的吸光度。以fss=(A-A0)/(Af-A0)对温度T作热变性曲线(其中,A0和Af分别为25 ℃和 100 ℃时体系260 nm处的吸光度。A为温度变化时体系260 nm对应的吸光度)。当fss=0.5时,对应的温度即为熔点Tm,得图4。
通常情况下,DNA的双螺旋结构在加热或碱性条件下会遭到破坏,导致双链间氢键断裂,形成两条单链结构。Sun等[15]证明:当DNA与小分子药物相互作用时,Tm会发生变化。若Tm上升了5~8 ℃,表明DNA双螺旋会更加稳定,二者的结合为嵌插结合,而静电结合或沟槽结合对Tm无明显影响。如图4所示,游离 DNA 的Tm为85.54 ℃,DNA-DAC体系的Tm为86.02 ℃,显然Tm无明显变化,表明DAC与DNA不是以嵌插方式结合。这也证明3.2的推断是正确的。
Fig.4 Thermal melting profiles of DNA(■) and its complexes with DAC(●)
3.4 粘度法的再利用
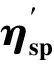
(2)
由图5可以看出,随着DAC浓度的增加,DNA溶液的相对粘度逐渐减小。这是因为药物DAC以部分、非经典嵌插方式与DNA结合[17],使得DNA螺旋结构扭曲,因而有效长度减小,从而导致DNA溶液的相对粘度降低。
3.5 反应驱动力的确定
等温滴定量热技术是近年来发展起来的新兴技术,用于生物热力学与动力学研究,其优点为原位、快速、无损伤,已成为鉴定生物分子间相互作用的首选方法。它可直接定量监测反应过程的热量变化,确定反应过程的热动力学参数,诸如结合常数Ka、结合位点数n、反应焓变ΔH、熵变ΔS等,用以表征分子间的相互作用[18-21]。
在25 ℃下将DAC加入250 μL的注射器中注入装有DNA溶液的样品池并持续搅拌,每次滴加5 μL共50次,每次间隔300 s。采用上面同样的设置以DAC溶液滴定缓冲溶液作为对照试验,扣除稀释热的作用。图6 为达卡巴嗪滴定DNA的等温滴定曲线。使用NanoAnalyze软件的所有数据进行分析,得到DAC滴定DNA的热力学参数于表1。
由表1可知,虽然n2比n1大,但结合常数K1却大于K2,显示出第一类结合要比第二类结合稳定牢靠。这是因为在第二类结合中,药物分子仅与DNA表面发生作用而并未嵌到DNA分子的疏水部分。由于作用物之间相互作用于表面,所以容易形成较大的结合位点数,但作用力分散,亲合力较弱。然而当药物小分子以非经典嵌入到DNA双螺旋结构并与碱基对相结合时,则能成为较稳定的第一类结合。

SitenKa/(10-3L·moL-1)ΔH/(kJ·moL-1)ΔG/(kJ·moL-1)TΔS/(kJ·moL-1)First0.1056.33-12.33-27.1114.78Second9.991.001.57-17.1218.69
第一类结合时,ΔH1<0,ΔS1>0,结合常数为5.63×104,显然,该过程放热,且热熵为正。其原因有二:药物小分子的疏水部分深深地陷入了DNA分子的疏水局部,导致体系能量降低而放热;药物分子的陷入,促使疏水空腔部分溶剂水分子进入溶液本体,转变为自由水分子。以上两个过程都有一定的热量放出,进而使体系混乱度增加。但在考虑作用过程时,药物分子靠近DNA时本身的去水化作用和结合位点周围水化层的被破坏所引起的吸热效应也必须予以考虑,不过这种吸热效应明显小于上述两因素导致的放热效应,因此,第一类结合表现为放热熵增现象,导致该过程的ΔG1<0,该过程的主要驱动力为疏水作用力。
第二类结合时,ΔH2>0,ΔS2>0 ,结合常数为1.00×103,该过程吸热,且热熵为正,结合常数比第一类小。这是由于药物分子在接近DNA表面时发生了去水化作用并且DNA表面水化层被破坏,药物分子并没有进入DNA分子内部,而是在表面进行。因为TΔS2>|ΔH2|熵增效应较大并决定着该过程的ΔG2<0,故表现为熵驱动过程,静电作用力是其驱动力。
以上两类结合的ΔG均小于0,说明均可自发进行,都可形成稳定的化合物。
4 结 论
通过紫外滴定、熔点以及粘度实验证明DNA与DAC结合方式为非经典、部分嵌插式。等温滴定量热实验结果表明,DNA与DAC反应有两类结合位点,反应均可自发进行。第一类发生在DNA分子内部,结合稳定,为熵驱动为主的焓熵协同驱动过程,疏水作用是其主要驱动力;第二类发生在DNA分子表面,为熵驱动过程,静电相互作用是其主要推驱力。
[1] DOYLE M L. Characterization of binding interactions by isothermal titration calorimetry [J].Curr.Opin.Biotech., 1997, 8(1):31-35.
[2] NGUYEN B, HAMELBERG D, BAILLY C,etal.. Characterization of a novel DNA minor-groove complex [J].Biophys.J., 2004, 86(2):1028-1041.
[3] 陆从文,兰秀风,张林,等. 依巴斯汀与牛血清蛋白相互作用的荧光光谱研究 [J]. 光子学报, 2015, 44(10):1030004-1-6. LU C W, LAN X F, ZHANG L,etal.. Interaction between ebastine and bovine serum albumin by fluorescence spectroscopy [J].ActaPhoton.Sinica, 2015, 44(10):1030004-1-6. (in Chinese)
[4] LUCK A N, MASON A B. Structure and dynamics of drug carriers and their interaction with cellular receptors: focus on serum transferring [J].Adv.DrugDeliv.Rev., 2013, 65(8):1012-1019.
[5]司芳瑞,苗艳明,杨茂青,等. 基于MPA包覆的Mn掺杂ZnS量子点/米托蒽醌复合体系对DNA的检测 [J]. 发光学报, 2016, 37(1):13-21. SI F R, MIAO Y M, YANG M Q,etal.. Detection of DNA based on manganese-doped ZnS quantum dots/MTX composite system [J].Chin.J.Lumin., 2016, 37(1):13-21. (in Chinese)
[6] WHITTAKER J, MCFADYEN W D, BAGULEY B C,etal.. The interaction of DNA-targeted platinum phenanthridinium complexes with DNA in human cells [J].Anti-CancerDrugDes., 2001, 16(2-3):81-89.
[7] YARNELL A T, OH S, REINBERG D,etal.. Interaction of FACT, SSRP1, and the high mobility group (HMG) domain of SSRP1 with DNA damaged by the anticancer drug cisplatin [J].J.Biol.Chem., 2001, 276(28):25736-25741.
[8] ZHANG J, YU J, GU J,etal.. A novel protein-DNA interaction involved with the CpG dinucleotide at-30 upstream is linked to the DNA methylation mediated transcription silencing of the MAGE-A1 gene [J].CellRes., 2004, 14(4):283-294.
[9] 刘振佳,司伊康,陈晓光. 圆二色谱测定技术在小分子化合物与DNA相互作用研究中的应用 [J]. 药学学报, 2010, 45(12):1478-1484. LIU Z J, SI Y K, CHEN X G. Application of circular dichroism to the study of interactions between small molecular compounds and DNA [J].ActaPharm.Sinica., 2010, 45(12):1478-1484. (in Chinese)
[10] 龙泉鑫,何颖,谢建平. 喹诺酮类药物作用的生理和遗传的分子机制 [J]. 药学学报, 2012, 47(8):969-977. LONG Q X, HE Y, XIE J P. The molecular physiological and genetic mechanisms underlying the superb efficacy of quinolones [J].ActaPharm.Sinica, 2012, 47(8):969-977. (in Chinese)
[11] 钟文英,黄琦,王丹丹,等. 巴罗沙星与DNA的相互作用及Mg2+的影响 [J]. 药学学报, 2005, 40(7):663-667. ZHONG W Y, HUANG Q, WANG D D,etal.. Interaction between balofloxacin and DNA and the influence of Mg2+on the interaction [J].ActaPharm.Sinica, 2005, 40(7):663-667. (in Chinese)
[12] ROSU F, GABELICA V, DE PAUW E,etal.. UV spectroscopy of DNA duplex and quadruplex structures in the gas phase [J].J.Phys.Chem. A, 2012, 116(22):5383-5391.
[13] ZHANG G W, HU X, FU P. Spectroscopic studies on the interaction between carbaryl and calf thymus DNA with the use of ethidium bromide as a fluorescence probe [J].J.Photochem.Photobiol. B, 2012, 108:53-61.
[14] PYLE A M, REHMANN J P, MESHOYRER R,etal.. Mixed-ligand complexes of ruthenium (Ⅱ): factors governing binding to DNA [J].J.Am.Chem.Soc., 1989, 111(8):3051-3058.
[15] SUN Y T, ZHANG H Q, BI S Y,etal.. Studies on the arctiin and its interaction with DNA by spectral methods [J].J.Lumin., 2011, 131(11):2299-2306.
[16] BI S Y, SONG D Q, KAN Y H,etal.. Spectroscopic characterization of effective components anthraquinones in Chinese medicinal herbs binding with serum albumins [J].Spectrochim.ActaPart A:Mol.Biomol.Spectrosc., 2005, 62(1-3):203-212.
[17]GAO E J, LIU L, ZHU M C,etal.. Synthesis, characterization, interaction with DNA, and cytotoxic effectinvitroof new mono- and dinuclear Pd(Ⅱ) and Pt(Ⅱ) complexes with Benzo[d]thiazol-2-amine as the primary ligand [J].Inorg.Chem., 2011, 50(11):4732-4741.
[18] FOTTICCHIA I, FOTTICCHIA T, MATTIA C A,etal.. Thermodynamic signature of secondary nano-emulsion formation by isothermal titration calorimetry [J].Langmuir, 2014, 30(48):14427-14433.
[19] GRÜNER S, NEEB M, BARANDUN L J,etal.. Impact of protein and ligand impurities on ITC-derived protein-ligand thermodynamics [J].Biochim.Biophys.Acta:Gen.Subjects, 2014, 1840(9):2843-2850.
[20] JELESAROV I, BOSSHARD H R. Isothermal titration calorimetry and differential scanning calorimetry as complementary tools to investigate the energetics of biomolecular recognition [J].J.Mol.Recognit., 1999, 12(1):3-18.
[21] DRAGAN A I, LI Z L, MAKEYEVA E N,etal.. Forces driving the binding of homeodomains to DNA [J].Biochemistry, 2006, 45(1):141-151.
王欢(1991-),男,陕西宝鸡人,硕士研究生,2014年于宝鸡文理学院获得学士学位,主要从事天然产物、抗癌药物与生物大分子的相互作用的研究。E-mail: 15829499347@163.com
赵微微(1984-),女,陕西渭南人,博士,助教,2016年于西北大学获得博士学位,主要从事多功能纳米载体的制备及其可控释放药物的研究。E-mail: gengts@163.com
Interaction Dynamics Between Dacarbazine and DNA
WANG Huan, WANG Jiao, LI Zong-xiao, ZHAO Wei-wei*, PU Xiao-hua, CHENG Hua-lei
(Department of Chemistry and Chemical Engineering, Baoji University of Arts and Sciences,ShannxiKeyLaboratoryofPhytochemistry,Baoji721013,China)*CorrespondingAuthor,E-mail:gengts@163.com
The interaction between calf thymus DNA and anti-cancer drug dacarbazine was investigated using isothermal titration calorimetry(ITC), spectroscopy, viscosity and other methods. The hyperchromic effect and blue shift in the absorption spectra as well as viscosity decline are observed clearly after the interaction between dacarbazine and DNA. Furthermore, the binding constant and number of binding sites are also recorded by ITC, presenting that the interactions of the dacarbazine with DNA can be categorized for two modes: a non-classical intercalation type and surface binding effect. In former, ΔH1<0, ΔS1>0,K1=5.63 × 104, the binding site is 0.10. In latter, only surficial interaction during the combination of the drug molecule with DNA occurs, not embedding into the hydrophobic part of the DNA molecule, due to ΔH2> 0 , ΔS2> 0,K2=1.00 × 103, and the binding site of 9.99. Meanwhile, UV method is also employed to find the binding constant ofKa=6.70×104, which is consistence with ITC observation.
DNA; dacarbazine; spectroscopy; interaction mechanism; isothermal titration calorimetry
1000-7032(2016)12-1560-06
2016-07-03;
2016-10-09
国家自然科学青年科学基金(21501007); 陕西省自然科学基金(2012Jm2019); 陕西省教育厅项目(14JK1045)资助
O657.3
A
10.3788/fgxb20163712.1560

