彗星电泳法测定双酚A对雄性幼龄小鼠脑细胞的DNA损伤
周苑秀,李敏杰,钟伟红,范瑞芳
华南师范大学生命科学学院 广州市亚热带生物多样性与环境生物监测重点实验室, 广州 510631
彗星电泳法测定双酚A对雄性幼龄小鼠脑细胞的DNA损伤
周苑秀,李敏杰,钟伟红,范瑞芳*
华南师范大学生命科学学院 广州市亚热带生物多样性与环境生物监测重点实验室, 广州 510631
双酚A是一种日常生活中无处不在的环境雌激素,具有生殖和神经毒性,但低剂量长期暴露对发育期青少年的危害性常常被低估或忽视。本研究以4周龄雄性清洁级小鼠为实验对象,以茶油作为溶媒对照,分别以双酚A浓度为0 μg·mL-1、0.1 μg·mL-1、10 μg·mL-1和1 000 μg·mL-1的茶油灌胃小鼠8周,然后利用彗星电泳法检测各组小鼠脑细胞的DNA损伤。结果显示,不同浓度双酚A暴露8周后,彗星电泳图像显示小鼠脑细胞DNA出现不同程度的损伤,随着暴露剂量的增加,带有彗尾的脑细胞比率从对照组小鼠的9.5%分别升高到暴露组小鼠的34.5%、36.0%和50.5%,细胞总体的尾部DNA含量、尾长和尾矩也都逐渐增加,而且各双酚A暴露组小鼠与溶媒对照组小鼠脑细胞都具有显著性差异(P < 0.01),这说明中长期双酚A暴露(包括低浓度环境暴露)会导致雄性幼龄小鼠脑细胞的DNA损伤。
双酚A;小鼠;脑细胞;DNA损伤;雄性;幼龄
双酚A(bisphenol A, BPA)是一种分子量为228、白色晶体、具有低等毒性的烷基酚类环境雌激素,学名为2,2-双(4-羟基苯基)丙烷(简称二酚基丙烷)。它是工业上生产聚碳酸酯和环氧树脂的重要原料,广泛存在于热敏纸、塑料制品、罐头食品的内层涂料、牙齿固封剂以及汽车仪表盘等日用百货中,是人类接触最为频繁的环境污染物之一[1],可通过饮食、皮肤接触和呼吸等途径进入人体。
研究发现BPA是一种内分泌干扰素,与雌激素竞争雌激素受体或拮抗雄激素[1,2],引起机体激素水平紊乱,扰乱机体生殖系统,阻碍神经发育,甚至导致恶性肿瘤的发生,具有生殖、免疫、内分泌和神经发育毒性[3]。发育中的大脑是BPA的靶器官之一。体外细胞培养实验表明,经BPA暴露后,大鼠海马HT-22细胞系凋亡率增加,细胞活力降低[4],大鼠胚胎中脑细胞增殖受到抑制,凋亡率增加[5]。动物实验表明,BPA影响大鼠海马发育期的髓鞘形成[6],围生期母鼠BPA暴露可影响子代小鼠的下丘脑早期性别分化[7],还会造成子代雄鼠腹侧中脑区的多巴胺神经元数目减少,凋亡细胞明显增加[8],原因可能是BPA作用于线粒体上的电子传递链,导致活性氧增多,抗氧化酶表达量下调,从而使细胞氧化损伤增加,累积后引起凋亡。研究还显示,围生期BPA暴露使得子代雄鼠脑内的神经营养因子-3(NT-3)表达量下调[9],而NT-3起滋养、保护和修复神经元细胞的作用,能促进神经干细胞的分化[10-11],若其表达下调会引起大脑发育延迟等一系列生理效应。非洲爪蟾胚胎BPA暴露后,中枢神经细胞凋亡率增加,脑部形态畸形率提高[12]。动物行为学实验表明,BPA可有性别地引起小鼠的焦虑、抑郁、蔗糖嗜好倾向,改变空间记忆行为和被动回避行为[13-15]。
彗星电泳法是一种简单,易操作,常用于单细胞的DNA损伤的监测方法。Onur等[16]用该法发现,经高剂量BPA染毒4周后,大鼠外周血细胞的DNA损伤显著。BPA暴露会妨碍脑部发育、改变暴露对象的行为方式,但这些研究大部分主要采用体外细胞培养实验,无法模拟人类实际的内环境暴露情况;部分动物实验,采用的暴露浓度远高于环境暴露水平,无法反映普通环境BPA暴露下可能带来的毒性效应;另外,BPA暴露对于处于神经发育阶段的动物造成的影响不可逆转。因此,本研究拟以4周龄的幼鼠为实验对象,持续8周灌胃给药后,通过彗星电泳法监测小鼠脑细胞的DNA损伤,模拟不同浓度BPA暴露情况,评价BPA对儿童及青少年神经系统的毒性效应,以便更好地评估日常生活模式下儿童由于双酚A环境暴露可能带来的危害。
1 材料与方法 (Materials and methods)
1.1 实验动物
实验动物为昆明品系SPF级雄性小鼠(许可证号:SCXK(粤)2011-0029),初始体重(20±2) g,每批每组小鼠为5只,具体分组见实验方法。小鼠饲养环境为(25±1) ℃,自然光照,给予充足的饮水与摄食(饮用水和食物中的BPA含量均低于检测限),每隔3天换一次垫料。
1.2 实验药品、试剂和仪器
双酚A购自美国sigma公司;琼脂糖购自上海伯奥生物科技有限公司;Na2EDTA、NaCl、NaOH、Na2HPO4、NaH2PO4、溴化乙锭和DMSO均来自广州化学试剂厂(AR纯度);Tris-base购自上海聚源生物科技有限公司(AR);Triton-X 100购自江苏强盛化工有限公司(AR)。
实验中所用的仪器包括:荧光倒置相差显微镜(DMI3000B,Leica);电泳槽(DYCPZ型,北京市六一仪器厂);电泳仪(DYY-IB型,北京市六一仪器厂);离心机(800型,上海手术器械厂);电热恒温水浴锅(黄石市恒丰医疗器械有限公司)等。
1.3 实验方法
1.3.1 分组与给药
将20只实验小鼠平均随机分为溶媒对照组、环境暴露组(低浓度组)、安全剂量暴露组(中浓度组)和高浓度暴露组4个组别,每天上午9:00~11:00之间,分别以双酚A浓度为0、0.1 μg·mL-1、10 μg·mL-1和1 000 μg·mL-1的茶油灌胃1次,每次0.1 mL,连续灌胃8周。
1.3.2 彗星电泳法
灌胃期结束后次日即进行彗星电泳实验。首先,将小鼠脊椎脱臼法处死,取全脑,剪成糜状,用pH 7.5的PBS淋洗,并去残渣,1 000 r·min-1离心8 min后,取上清液,用血球计数板调节细胞液浓度为105~106个·mL-1(即血球计数板中5个中方格内的总细胞数为2~20个)。然后,在载玻片制成的微电泳槽上铺胶制片,第一层铺1%的正常熔点琼脂糖,置于4 ℃固化30 min后铺第二层,第二层铺上述制备的细胞悬液融合0.75%的低熔点琼脂糖。将制备好的载玻片置于4 ℃固定30 min后,浸没于4 ℃预冷的裂解液中裂解2 h。在4 ℃预冷的碱性电泳缓冲液静置20 min,使DNA解旋,然后在25 V电压,300 mA电流下电泳20 min。以4 ℃预冷的Tris-HCl缓冲液中和至中性后,滴加溴化乙锭(EB)溶液染色30 s~1 min,最后用蒸馏水洗涤。在荧光显微镜下用515~560 nm的激发光观察单细胞电泳图像,每个样本中随机挑选40个细胞进行拍照。
1.3.3 数据分析与统计
用CASP彗星分析软件分析各个细胞,得到各组细胞的tail DNA%(尾部DNA含量)、tail length(尾长)和tail moment(尾矩)值。根据彗尾的DNA含量,将采集的细胞图像分为5级:彗星尾部荧光强度占总强度为0%~6%是0级;6.1%~17.0%为1级;17.1%~35.0%为2级;35.1%~60.0%为3级;60.1%~100.0%为4级[17]。除0级以外的细胞数目占总细胞数目的百分比即为彗星率。每一级细胞的百分比乘以其级别号,相加在一起即为任意值。最后,采用tail DNA%、tail length、tail moment、彗星率和任意值5个指标综合分析比较细胞的DNA损伤。
采用SPSS17.0统计软件处理数据,用平均值±标准误(mean ± SED)表示DNA的损伤。运用Mann-Whitney U test法检验两组样本的差异性,其中P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果(Results)
2.1 不同浓度BPA暴露后小鼠的生长发育情况
不同浓度BPA暴露数周后,部分暴露组小鼠出现烦躁不安、易兴奋、多动、好斗的情况。个别小鼠因打斗咬伤而发炎,经隔离饲养后,很快恢复正常,其他各暴露组小鼠在BPA暴露期间生长发育良好,皮毛紧实,毛色正常,体重持续稳定增加,与溶媒对照组均无显著性差异(T-test,P > 0.05)。
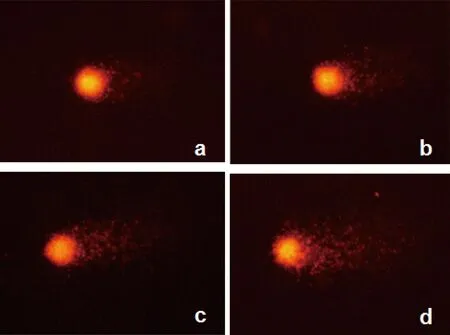
图1 不同浓度BPA暴露后的小鼠脑细胞彗星电泳图像注:a,溶媒对照组(0 μg·mL-1);b,低浓度暴露组(0.1 μg·mL-1);c,中浓度暴露组(10 μg·mL-1);d,高浓度暴露组(1 000 μg·mL-1)。Fig. 1 Comet assay images of brain cells in the mice after exposure to different levels of BPANote: a, the control group (0 μg·mL-1); b, the low-exposure group (0.1 μg·mL-1); c, the medium-exposure group (10 μg·mL-1); d, the high-exposure group (1 000 μg·mL-1).

图2 不同浓度BPA暴露后小鼠脑细胞的尾部DNA含量、尾长和尾矩值(n=5)注:a表示该组细胞DNA损伤程度相对于溶媒对照组(0 μg·mL-1),P < 0.01;b表示该组细胞的DNA损伤程度相对于低浓度组(0.1 μg·mL-1),P < 0.01;c表示该组细胞的DNA损伤程度相对于中浓度组(10 μg·mL-1),P < 0.01;d表示该组细胞的DNA损伤程度相对于高浓度组(1 000 μg·mL-1),P < 0.01;各组别细胞数均为200个。Fig. 2 Tail DNA%, tail length and tail moment of brain cells in the mice after exposure to different levels of BPA (n=5)Note:There are 200 cells in each group. The letters in the figures denote significant differences (P < 0.01) from: a, the control group (0 μg·mL-1); b, the low-exposure group (0.1 μg·mL-1); c, the medium-exposure group (10 μg·mL-1); d, the high-exposure group (1 000 μg·mL-1).
2.2 不同浓度BPA暴露后小鼠脑细胞的彗星电泳图谱
如图1所示,正常喂养的溶媒对照组小鼠的脑细胞头部DNA致密,无明显尾部或尾部很短;而BPA暴露组小鼠脑细胞头部DNA亮度较强,出现不同程度彗星状拖尾现象;且随着暴露剂量的增加,含彗尾的细胞比例逐渐增加,彗尾也逐渐加长、变亮。
2.3 不同浓度BPA暴露对小鼠脑细胞的DNA损伤作用
如图2所示,从彗星尾部DNA含量、尾长、尾矩3个指标来看,暴露组小鼠脑细胞均显著高于溶媒对照组(T-test,P < 0.01);随着染毒剂量的增加,彗星尾部DNA含量逐渐上升(分别为2.28 ± 0.22、5.90 ± 0.54、6.75 ± 0.59和10.08 ± 0.78),尾长(分别为9.48 ± 0.64、16.65 ± 1.20、19.22 ± 1.22和25.01 ± 1.60)和尾矩(分别为0.47 ± 0.09、2.21 ± 0.34、2.62 ± 0.41和4.83 ± 0.63)依次增加,除了低浓度组与中浓度组之间无显著性差异,其他各暴露组之间均有明显的显著性差异(T-test,P < 0.01)。
表1显示,溶媒对照组小鼠脑细胞彗星率仅有9.5%,而不同浓度BPA暴露后,即使是0.1 μg·mL-1的暴露剂量,其彗星率也提高到34.5%。中浓度组BPA暴露小鼠脑细胞彗星率与低浓度组比较接近,为36.0%,而高浓度组小鼠脑细胞的彗星率则达到50.5%。其次,任意值是一个能体现细胞DNA损伤彗星等级比例的综合指标,可以综合反映细胞的DNA损伤情况。溶媒对照组小鼠脑细胞的任意值为0.100,暴露组小鼠则随BPA暴露浓度由低到高依次为0.430、0.465和0.750,说明BPA暴露确实能诱发小鼠脑细胞DNA的单链断裂,产生彗星电泳阳性现象。另外,低浓度组,即模拟儿童日常BPA暴露的组别,彗星实验各指标均高于溶媒对照组,且具有显著性差异(P <0.05),说明即使是低浓度的BPA长期暴露,也会对脑细胞产生损伤。
3 讨论(Discussion)
本实验中BPA暴露组小鼠浓度设置分别依据文献报道的普通人群尿日常暴露生物监测值(0.1~2.4 μg·kg-1·bw)[1]、EPA公布的日安全剂量值(50 μg·kg-1·bw)[18]以及100倍安全剂量值制定。根据小鼠的初始体重(20 g),分别设置0.1(取普通人群暴露的中间值0.5 μg·kg-1·bw得到)、10和1 000 μg·mL-1三个浓度。8周时长的BPA暴露,相当于小鼠的2~3 y寿命的1/12~1/13。假设人类寿命为70岁,那么小鼠的8周大概相当于人类的5.3~5.8 y左右,这样的暴露时长可以模拟人类中-长期BPA环境暴露的情况。
人们通常认为日摄入50 μg·kg-1·bw BPA是安全的。大鼠口服C14-BPA同位素示踪实验显示,口服药物第7天后放射性BPA大多通过尿和粪便排泄,在血液中的含量较少,表明BPA体内代谢速度较快并且不会大量累积于体内,由此认为BPA的遗传毒性相对较小[19],其产生的各种毒理学效应可以忽略不计。但也有一些学者根据实验结果提出质疑,比如张婧等[20]的研究显示,若将母鼠从妊娠期第7天到子鼠出生第21天持续进行BPA染毒,即使是日安全剂量(50 μg·kg-1·bw)组小鼠,也会有性别差异地引起子鼠的多种神经行为异常。而且,对于成年期BPA暴露的动物,只要取消BPA暴露一段时间就可以一定程度地缓解由其引发的行为学异常现象,而发育期动物BPA暴露对成年后行为的不利影响却不可逆转[21]。这是因为胎儿脑内特异性的α-甲胎蛋白,和BPA结合后会产生更大的生物毒性效应[22]。
由于BPA在日用品中的应用广泛,人们可通过膳食以及皮肤接触等多种渠道摄入BPA。对广州市食品中的BPA污染调查研究显示,广州市动、植物性食品双酚A含量在0.17 ng·g-1~7 ng·g-1之间,平均每标准人每天经食品暴露BPA的量达1 531.16 ng(25.52 ng·kg-1bw·d-1) ,危害率为0.51×10-3[23];对广州、深圳各种纸张中的BPA研究也显示,超市小票以及各种书籍、报纸、打印纸张中含有大量BPA,超市小票中含量高达26.75 mg·g-1纸,可通过皮肤接触的方式进入体内[24, 25]。另外,从行为特点上说,幼龄儿童相较于成人,常常具有典型的手-口行为,大大增加了BPA通过口摄入的可能性,且青少年儿童喜欢瓶装饮料和罐装零食,由于义务教育而必须长期触摸书本纸张,这些行为特点均增加了BPA暴露的几率。尿中BPA的暴露监测也证实了儿童/青少年会因为生活习惯增加BPA暴露的强度[26]。由于人类根本无法避免BPA的长期、被动摄入,体内BPA的水平始终处于动态进程中,每天都有一定的BPA摄入量和代谢排出量,因此不能轻易忽视/低估BPA日常暴露的遗传毒性,特别是对于处于大脑发育关键期的婴幼儿/青少年。本实验中,低剂量和安全剂量BPA中长期暴露均对雄性幼龄小鼠的脑细胞产生了DNA损伤效应,印证了BPA日常暴露的潜在危害性,提示我们应关注儿童/青少年的日常BPA暴露问题,重新评估中长期、低浓度BPA暴露可能带来的毒理效应。即使是安全剂量(50 μg·kg-1·bw)BPA摄入,经一段时间累计后,也有可能会对婴幼儿和青少年的脑细胞产生不良影响。
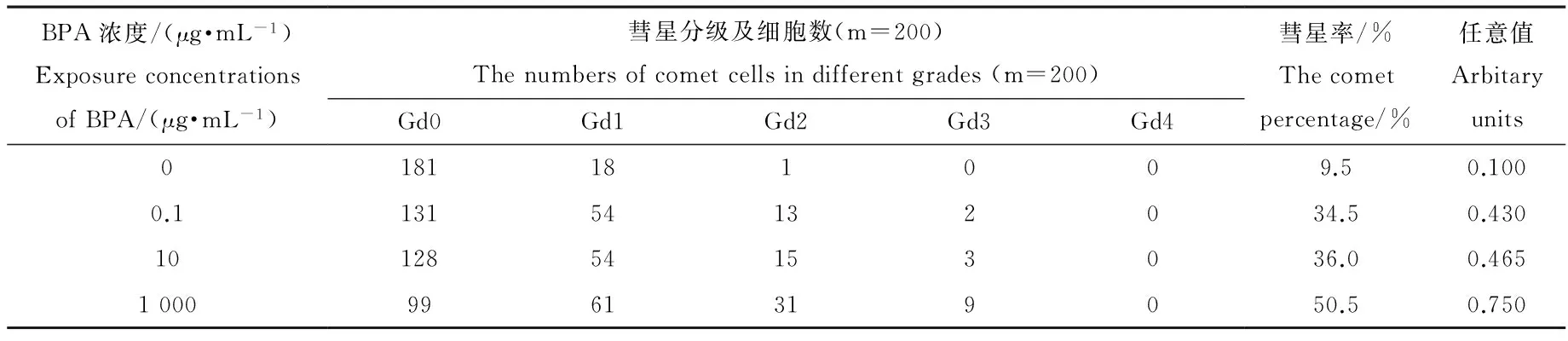
表1 不同浓度BPA暴露后各组别小鼠脑细胞的彗星率和任意值(n=5)
雄性幼龄小鼠长期暴露于不同浓度的BPA时,其脑细胞会产生明显的DNA损伤。即使是低浓度的环境BPA暴露浓度(0.1 μg·mL-1),相对于空白对照组小鼠来讲,也存在显著性差异(P < 0.01)。且随着BPA暴露浓度的升高(10 μg·mL-1、1 000 μg·mL-1),DNA损伤程度会加剧。该结果提示我们应关注普通人群中长期、被动的环境BPA摄入有可能引发的健康风险,特别是处于生长发育期的婴幼儿和儿童。
致谢:感谢广东省自然科学基金(s2013010013183)和广州市科技计划项目(201510010107)对本研究的资助。
[1] Chouhan S, Yadav S K, Prakash J, et al. Effect of Bisphenol A on human health and its degradation by microorganism s: A review [J]. Annals of Microbiology, 2014, 64(1): 13-21
[2] Wolstenholme J T, Rissman E F. The role of Bisphenol A in shaping the brain, epigenome and behavior [J]. Hormones and Behavior, 2011, 59(3): 296-305
[3] 国先芬, 王贻鑫, 耿存珍, 等. 环境激素双酚A的毒理学研究进展[J]. 环境科学与技术, 2013, 36(2): 86-93
Guo X F, Wang Y X, Gen C Z, et al. Progress on toxicological effect of environmental endocrine Biophenol A [J]. Environmental Science and Technology, 2013, 36(2): 86-93 (in Chinese)
[4] Lee S, Suk K, Kim I K, et al. Signaling pathways of Bisphenol A-induced apoptosis in hippocampal neuronal cells: Role of calcium-induced reactive oxygen species, mitogen-activated protein kinases, and nuclear factor-κB [J]. Journal of Neuroscience Research, 2008, 86(13): 2932-2942
[5] Liu R, Xing L, Kong D, et al. Bisphenol A inhibits proliferation and induces apoptosis in micromass cultures of rat embryonic midbrain cells through the JNK, CREB and p53 signaling pathways [J]. Food and Chemical Toxicology, 2013, 52: 76-82
[6] Shashi K T, Swati A, Lalit K S C, et al. Bisphenol-Aimpairs myelination potential during development in the hippocampus of the rat brain [J]. Molecular Neurobiology, 2015, 51(3): 1395-1416
[7] McCaffrey K A, Jones B. Sex specific impact of perinatal bisphenol A (BPA) exposure over a range of orally administered doses on rat hypothalamic sexual differentiation [J]. Neuro Toxicology, 2013, 36: 55-62
[8] 林勇. 双酚A影响大鼠雄性子代脑多巴胺神经系统发育和功能的机理研究[D]. 成都: 四川大学, 2006
Lin Y. Study on the mechanism of Bisphenol A developmental neuronal toxicity to rat male offspring central dopaminergic neuronal pathway [D]. Chengdu: Sichuan University, 2006 (in Chinese)
[9] 龙冬梅, 吴德生. 围生期双酚A暴露对雄性子代脑组织神经营养因子-3表达的影响[J]. 西南国防医药, 2009, 19(12): 1165-1167
Long D M, Wu D S. Effects of perinatal exposure to bisphenol A on expression of NT-3 of weaning male offspring in rats [J]. Medical Journal of National Defending Forces in Southwest China, 2009, 19(12): 1165-1167 (in Chinese)
[10] 林艳丽. 脑源性神经营养因子研究进展[J]. 生物技术通讯, 2003, 3(14): 241-244
Lin Y L. The research advance of brain derived neurotrophic factor [J]. Letters in Biotechnology, 2003, 3(14): 241-244 (in Chinese)
[11] 孙勇, 侍坚, 陆佩华. 神经营养因子与神经干细胞[J]. 生理科学进展, 2002, 33(4): 313-316
Sun Y, Shi J, Lu P H. Neurotrophic factors and neurol stem cells [J]. Progress in Physiological Sciences, 2002, 33(4): 313-316 (in Chinese)
[12] Oka T, Adati N, Shinkai T. Bisphenol A induces apoptosis in central neural cells during early development of Xenopus laevis [J]. Biochemical and Biophysical Research Communications, 2003, 312: 877-882
[13] Weinstein S D, Villafane J J, Juliano N, et al. Adolescent exposure to Bisphenol A increases anxiety and sucrose preference but impairs spatial memory in rats independent of sex [J]. Brain Research, 2003, 1529: 56-65
[14] 田栋, 徐晓虹, 洪星. 成年期双酚A暴露对小鼠行为的影响[J]. 心理学报, 2011, 43(5): 534-543
Tian D, Xu X H, Hong X. Effects of adulthood exposure to Bisphenol-A on behaviors in mice [J]. Acta Psychologica Sinica, 2011, 43(5): 534-543 (in Chinese)
[15] 杨宇杰, 徐晓虹, 洪星, 等. 妊娠期和哺乳期双酚A暴露对幼年子代小鼠焦虑和抑郁行为的影响[J]. 生物物理学报, 2012, 28(2): 131-145
Yang Y J, Xu X H, Hong X, et al. Gestational and lactational exposure to Bisphenol A affects anxiety- and depression-behaviors in young offspring mice [J]. Acta Biophysica Sinica, 2012, 28(2): 131-145 (in Chinese)
[16] Onur K U, Nurçin Y, Emre D, et al. An in vivo assessment of the genotoxic potential of Bisphenol A and 4-tert-octylphenol in rats [J]. Archives of Toxicology, 2011, 85(8): 995-1001
[17] Collins A R, Ai-guo M, Duthie S J. The kinetics of repair of oxidative DNA damage (strand breaks and oxidized pyrimdines) in human cells [J]. Mutation Research, 1995, 336(1): 69-77
[18] Adewale H B, Jefferson W N, Newbold R R, et al. Neonatal Bisphenol A exposure alters rat reproductive development and ovarian morphology without impairing activation of gonadotropin-releasing hormone neurons [J]. Biology of Reproduction, 2009, 81(4): 690-699
[19] Kurebayashi H, Betsui H, Ohno Y. Disposition of a low dose of14C-bisphenol A in male rats and its main biliary excretion as BPA-glucuronide [J]. Toxicological Sciences, 2003, 73(1): 17-25
[20] 张婧, 徐晓虹, 王亚民, 等. 围生期双酚 A 暴露对不同性别子代小鼠行为的影响[J]. 心理学报, 2009, 41(9): 832-841
Zhang J, Xu X H, Wang Y M, et al. Perinatal exposure to Bisphenol A affects sexual differentiation of behaviors in offspring mice [J]. Acta Psychologica Sinica, 2009, 41(9): 832-841 (in Chinese)
[21] 洪星. 不同发育时期双酚A暴露对子代成年小鼠焦虑和抑郁的影响及其神经机制[D]. 杭州: 浙江师范大学, 2012
Hong X. Different development stages exposure to Bisphenol A affects anxiety and depression behaviors in mice and its molecular mechanism [D]. Hangzhou: Zhejiang Normal University, 2012 (in Chinese)
[22] Zalko D, Sotov A M, Dolo L, et al. Biotransformations of Bisphenol A in a mammalian model: Answers and new questions raised by low-dose metabolic fate studies in pregnant CD1 mice [J]. Environmental Health Perspectives, 2003, 11(3): 309-319
[23] 申元媛, 赵娜娜, 龙甲, 等. 广州市食品中双酚A污染现状及人群暴露风险评估[J]. 公共卫生与预防医学, 2013, 24(3): 12-14
Shen Y Y, Zhao N N, Long J, et al. Exposure to Bisphenol A in food and risk assessment for the population in Guangzhou City [J]. Journal of Public Health and Preventive Medicine, 2013, 24(3): 12-14 (in Chinese)
[24] Lu S, Chang W, Samuel O S, et al. Bisphenol A in supermarket receipts and its exposure to human in Shenzhen, China [J]. Chemosphere, 2013, 92(9): 1190-1194
[25] Fan R, Zeng B, Liu X, et al. Levels of Bisphenol-A in different paper products in Guangzhou, China, and assessment of human exposure via dermal contact [J]. Environmental Science: Processes & Impacts, 2015, 17(3): 667-673
[26] Li X, Ying G, Zhao J, et al. 4-Nonylphenol, Bisphenol-A and triclosan levels in human urine of children and students in China, and the effects of drinking these bottled materials on the levels [J]. Environment International, 2013, 52: 81-86
◆
Detection of DNA Damages of Brain Cells in Young Male Mice Induced by Bisphenol A by Comet Assay
Zhou Yuanxiu, Li Minjie, Zhong Weihong, Fan Ruifang*
Guangzhou Key Laboratory of Subtropical Biodiversity and Biomonitoring, School of Life Science, South China Normal University, Guangzhou 510631, China
Received 28 August 2015 accepted 9 October 2015
Bisphenol A (BPA) is an environmental xenoestrogenic endocrine disruptor and has shown detectable toxicity on biological systems, including the reproduction system, immune system, endocrine system and neurological development. However, the neurotoxicity of low dose BPA to children and youth is often underestimated and few studies were conducted on this aspect. We herein examine the effects of low dose BPA exposure on DNA damage of brain cells of male mice. The adolescent male mice at the age of 4 weeks were divided into four groups, including the control group and three exposure groups, and chronically received systematically varying BPA treatments (0 μg·mL-1, 0.1 μg·mL-1, 10 μg·mL-1and 1 000 μg·mL-1in tea oil) for 8 weeks. Comet assay was then employed to detect the DNA damages of the brain cells in these mice. After the treatments with BPA, the comet percentages of brain cells increased significantly from 9.5% in the control group to 34.5%, 36.0% and 50.5% in the three exposure groups respectively, consistent with raised percentages of tail DNA, tail length and tail moment in brain cells. The results show that mid-long term exposure to the low dose BPA lead to DNA damage of brain cells in adolescent male mice and the damage levels increase with the increasing BPA concentrations.
bisphenol A; mice; brain cells; DNA damage; male; young
10.7524/AJE.1673-5897.20150828001
广东省自然科学基金(s2013010013183);广州市科技计划项目(201510010107)
周苑秀(1992-),女,研究生,研究方向为生态毒理学,E-mail: 1097125816@qq.com;
*通讯作者(Corresponding author), E-mail: 20001047@m.scnu.edu.cn
2015-08-28 录用日期:2015-10-09
1673-5897(2016)2-666-06
X171.5
A
简介:范瑞芳(1972-),女,博士,教授,主要研究方向为环境污染物与人体健康,发表学术论文40余篇。
周苑秀, 李敏杰, 钟伟红, 等. 彗星电泳法测定双酚A对雄性幼龄小鼠脑细胞的DNA损伤[J]. 生态毒理学报,2016, 11(2): 666-671
Zhou Y X, Li M J, Zhong W H, et al. Detection of DNA damages of brain cells in young male mice induced by bisphenol A by comet assay [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 666-671 (in Chinese)

