藻类有机质的组成结构对菲和壬基酚生物吸附的影响
张代男,段丹丹,杨余,冉勇
中国科学院广州地球化学研究所, 广州 510640
藻类有机质的组成结构对菲和壬基酚生物吸附的影响
张代男,段丹丹,杨余,冉勇
中国科学院广州地球化学研究所, 广州 510640
对不同来源藻及其有机级分进行元素分析,利用高级核磁共振技术(multi/CP13C NMR)来准确地定量其有机官能团,并研究它们对菲和壬基酚的生物吸附行为和机理。结果表明游离脂和非水解有机碳级分对菲和壬基酚有最高的吸附能力,其吸附容量与脂肪结构呈极显著的正相关,而与极性官能团呈极显著的负相关;而且对壬基酚的吸附容量都大于对菲的吸附容量,可以用专性作用(如π-π键作用和氢键作用)来解释。
藻类有机质;菲;壬基酚;生物吸附
Received 10 November 2015 accepted 22 December 2015
生物吸附是一种利用廉价的、活着或死的生物质的基体(或表面)来吸附化学物质,以达到去除污染物的生物修复方法[1]。一些研究报道了多种生物吸附剂(如真菌、细菌、藻类和植物表皮)对重金属、染料、农药和有机污染物的吸附过程和机理[2-3];生物吸附在除去疏水性有机化合物(HOCs)方面也起着非常重要的作用[4]。其中藻类是一类高效的、可靠的、经济的去除水中多种污染物的生物吸附剂,大部分现有的生物吸附研究都集中在离子类物质和极性有机污染物[1]。然而,藻类对HOCs的吸附机理研究较少。
藻类作为主要的初级生产者对HOCs在水生系统中的归宿起到非常重要的作用。HOCs可以通过食物链从水中进入藻类,然后可能被更高营养级生物所富集。此外,藻类通过含有一类称为藻质素的高脂肪性生物大分子,选择性地被保存在沉积物中[5]。研究表明,死的生物质比活的生物质能更好地去除污染物[2]。一些研究报道了生物质的组成结构影响其对HOCs的生物吸附[3,6-8]。然而,目前只有少量的研究报道了藻类的组成结构与HOCs的生物吸附的关系。
本研究探讨不同来源藻类及其有机质级分对HOCs的吸附行为。以菲和壬基酚为吸附质,考察原始藻类样品及其级分对HOCs的吸附行为,以及藻类有机质组成结构对HOCs的吸附行为的影响,并推测其吸附机理。
1 材料与方法 (Materials and methods)
1.1 样品前处理和表征
藻类样品包括以下:在实验室条件下培养的小球藻、拟球藻,超市购买藻螺旋藻、海藻、紫菜和3个来自湖泊富营养化收集的野外浮游生物样品。2个培养藻类是以BG11培养基进行批量培养,然后以4 500 r·min-1转速离心15 min浓缩藻细胞,再冷冻干燥以备后续实验。LHH25野外藻类样品是2011年8月在广州流花湖公园用25号浮游生物网采集;同时采集大量水样,用连续流离心机以8 000 r·min-1分离,得到LHHPOM野外藻类样品。YTDQ野外藻类样品是2011年9月在增城雁塔大桥水库用25号浮游生物网采集而得的浮游生物。
取一定量超市购买的藻,依次用二氯甲烷和甲醇混合溶液、碱性甲醇和水混合溶液以及不同浓度三氟醋酸和盐酸进行处理,分别得到游离脂级分(LP)、去游离脂级分(LF)、碱性不可水解有机碳级分(ANHC)和非水解有机碳级分(NHC)。固体样品最后经冷冻干燥后研磨,以用于仪器表征和吸附实验。
所有藻类原始样品及其级分样品的C、H、N和O用ElementarVario EL III(Hanau,德国)元素分析仪测定。样品中有机质的结构定量测定,采用高级多重交叉极化(multiCP)13C核磁共振技术,在核磁共振仪(Bruker DSX400,德国)上完成。1H和13C的频率分别为400-MHz和100-MHz。这种高级multiCP定量技术是一种简单的、可靠的、效果好的方法,且具有良好的信噪比[9]。
1.2 吸附实验和吸附模型
疏水性有机污染物用的是色谱纯菲(纯度>98%,Aldrich)和壬基酚(纯度>94%,Aldrich)。背景溶液加0.01 mol·L-1CaCl2、200 mg·L-1NaN3、5 mg·L-1NaHCO3(分析纯,购自广州化学试剂公司)。将0.5~10 mg 质量不等的吸附剂置于20 mL玻璃安瓿瓶中,控制温度在(25±1) ℃。将不同浓度的菲和壬基酚水溶液注入已装有预先称重的原始藻类样品及其级分的玻璃安瓿瓶中,用火焰进行封口,在摇床上以125 r·min-1在振荡14 d达到吸附平衡。菲和壬基酚的浓度采用岛津高效液相色谱(HPLC)仪(LC-20A,日本)进行检测。色谱柱采用反相Inertsil ODS-SP (150 cm × 4.6 mm × 5 μm)柱,检测器使用荧光检测器。进样体积是10 μL,菲的流动相为以90%乙腈/10%水,流速为1.0 mL·min-1,其荧光检测器的激发和发射波长是250 nm和364 nm。壬基酚的流动相为70%乙腈/30%水,其荧光检测器的激发和发射波长是277 nm和300 nm。
吸附结果使用修正的Freundlich吸附容量参数(K’f)对污染物的吸附能力进行直接比较。修正的Freundlich模型公式如下:
log qe=log K’f+ n log Cr
K’f是修正的Freundlich吸附容量,Cr是无量纲水相中浓度,n为Freundlich非线性因子。K’f和Kf的关系可用以下公式表达:
K’f= Kf(Sw)n或Kf(Sscl)n
这里Sw和Sscl分别是指在一定温度条件下,溶质在水中的溶解度和固体有机化合物的过冷液体状态溶解度(Sscl)。
2 结果 (Results)
2.1 藻类有机质及其级分的元素组成
从表1[10]可知,藻类原始样品的总有机碳含量为20.2%~42.7%。超市购买藻、培养藻和野外浮游生物原始样品的H/C比值分别为1.76~1.81、2.26~2.28和1.88~2.13,其O/C比值分别为0.75~0.87、0.90~0.91和0.63~0.68。原始培养藻的H/C比值最高,表明了其脂肪性较高,其O/C比值也最高,说明其含氧官能团也较多;其高的元素比值很可能与培养条件有关。原始野外浮游生物样品的H/C比值也比较高。
与原始样品(OS)相比,LF级分的元素比值变化较小。经过碱性水解后,ANHC 级分的O/C比值明显增加;而且,ANHC级分在所有的级分中极性最大,是由于碱性水解反应使得羧基和羟基键合到有机基质上。经过酸水解后,NHC级分的O/C比值大大降低,这与酸水解过程中去除了大量的碳水化合物和蛋白有关。
2.2 藻类有机质及其有机级分的结构
除了LHH25由于其样品量不足外,所有原始藻类样品OS、LF和NHC级分都采用固体13C NMR技术表征。图1[11]中细线和粗线分别代表定量13C NMR全碳谱图(MultiCP)和偶极相移谱图(MultiCP/DD)。各碳谱位移区间归属如下:0~45 ppm,烷基碳;45~61 ppm, 甲氧基碳(也包括NCH);61~92 ppm,烷氧基碳;92~115 ppm,二烷氧基碳;115~146 ppm,芳香碳(包括非质子芳香 C-C,MultiCP/DD和质子芳香C-H,MultiCP—MultiCP/DD);146~165 ppm,含氧芳香碳;165~190 ppm,羧基碳;190~220 ppm,酮和醛。不同官能团的百分含量列在表2[11]中,原始样品含有大量烷氧基碳,占总碳的22.4%~42.9%,烷基碳为17.7%~35.8%,但是总芳香碳(包括芳香碳和含氧芳香碳)含量很少,为5.80%~10.2%。与其他原始样品相比,小球藻和拟球藻以及YTDQ浮游生物样品含有更多的脂肪碳和聚亚甲基碳,但是烷氧基碳和二烷氧基碳则相对较少。NHC级分与其相应的原始样品OS和LF级分的各官能团的百分含量相差甚大。NHC级分含烷氧基碳占总碳的5.6%~11.4%,低于其原始样品OS的烷氧基碳(30.7%~42.0%)和LF级分的烷氧基碳(27.5~41.8%),这表明大部分多糖和蛋白等化合物在碱性和酸性水解中已被去除。紫菜NHC级分在27.5~31.8 ppm的信号明显地最高,表明其聚亚甲基碳的含量最高。

表1 原始藻类样品及其级分的元素组成
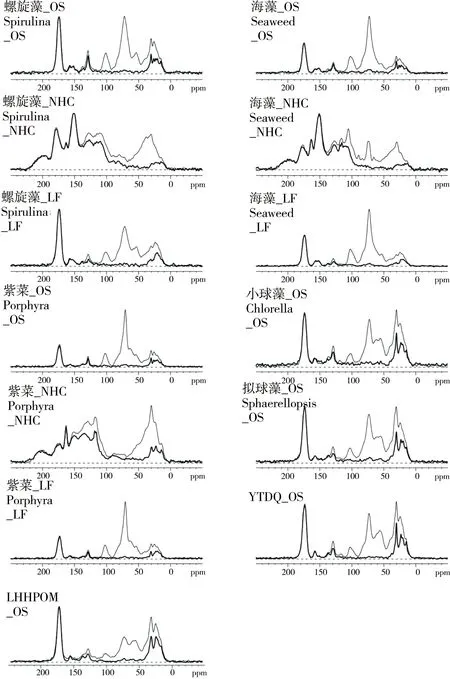
图1 原始藻类样品(OS)、LF和NHC级分的MultiCP/MAS全碳谱图(细线)和MultiCP/MAS偶极相移谱图(粗线)Fig. 1 MultiCP/MAS spectra (thin lines) and multiCP/MAS13C NMR spectra after recoupled dipolar dephasing (thick lines) of the original algal samples (OS) as well as LF and NHC fractions (thin lines)
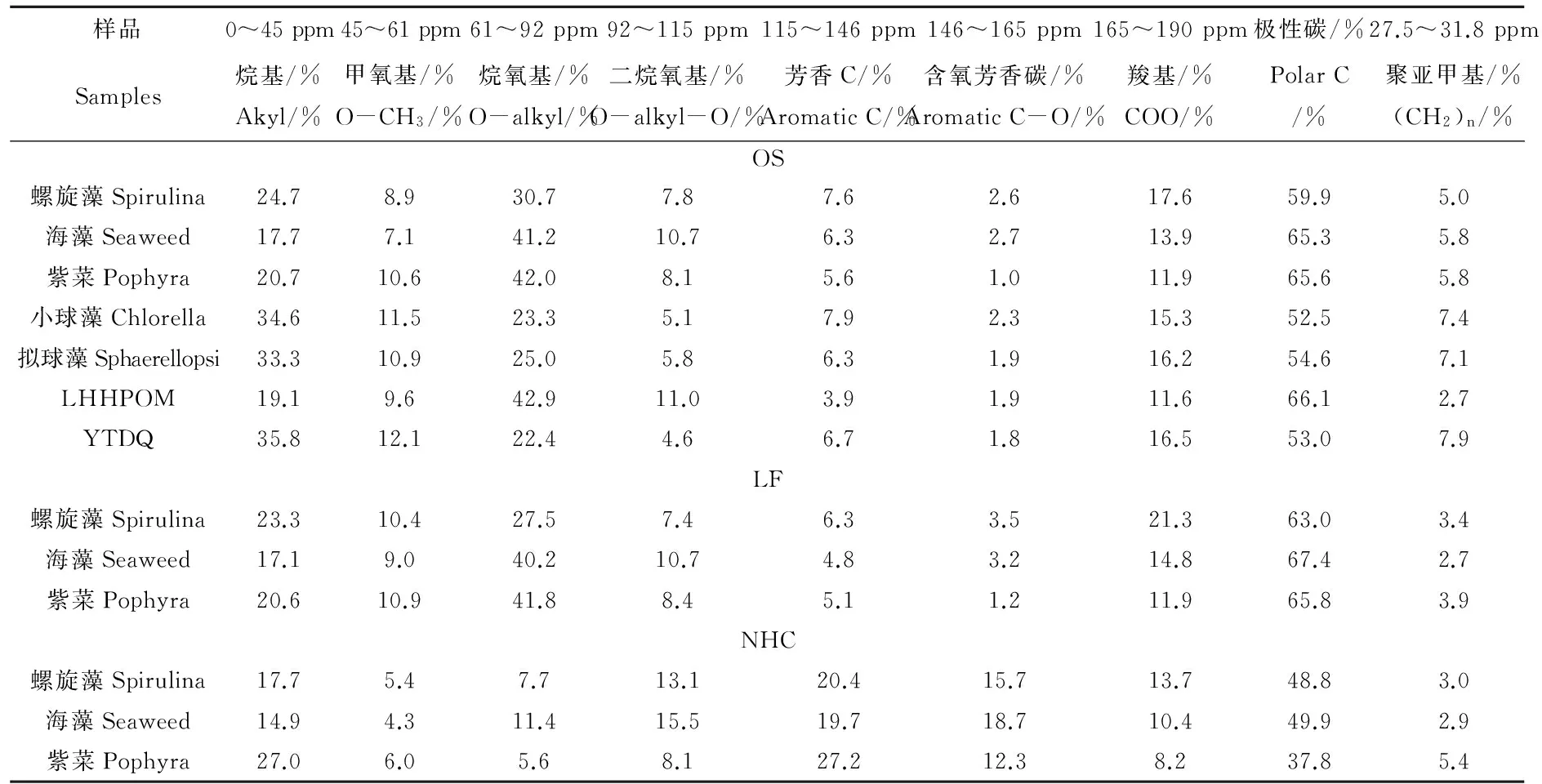
表2 MultiCP/MAS 13C NMR 谱图中各官能团含量的定量
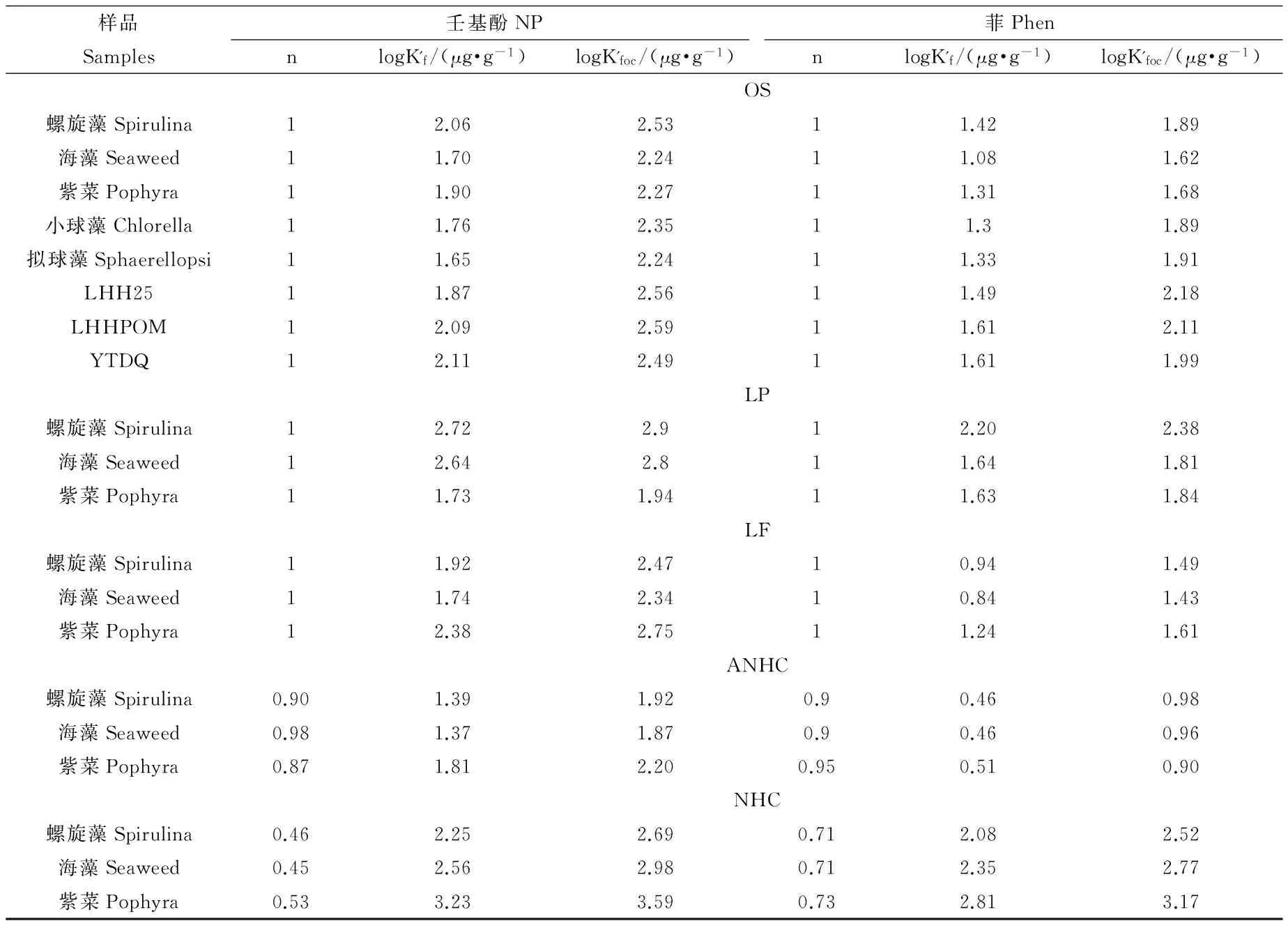
表3 壬基酚和菲的修正Freundlich生物吸附参数
2.3 生物吸附等温线
由表3[11]可知,OS、LP和LF级分对菲和壬基酚的等温线为线性吸附,但是ANHC呈现出较弱的非线性吸附,NHC级分呈现出明显的非线性吸附。其中,NHC级分对壬基酚的非线性因子n为0.450~0.525,小于其对菲吸附的n值(n = 0.707~0.727)。
OS、LF、LP、ANHC和NHC级分对菲的有机碳归一化的吸附容量值(log K’foc)分别为1.62~2.18、1.43~1.61、1.81~2.38、0.90~0.98和2.52~3.17 μg·g-1·OC-1,其对壬基酚的log K’foc值分别为2.24~2.59、1.94~2.90、2.34~2.75、1.87~2.20和2.69~3.59 μg·g-1·OC-1(表3)。LP和NHC级分对菲和壬基酚的吸附能力高于其他级分。
2.4 藻类有机质的性质与吸附参数的关系
OS、LF、ANHC和NHC级分对壬基酚和菲的吸附参数log K’foc值与O/C元素比值分别地呈极显著的负相关(P<0.0001);OS、LF和NHC级分对壬基酚和菲的吸附参数log K’foc值分别地与烷氧基碳、羧基碳和极性碳含量呈显著的负相关(P<0.0001),表明藻类有机质的极性官能团对HOCs的生物吸附作用有重要的影响。
3 讨论(Discussion)
所有样品对壬基酚的log K’foc值明显地大于其对菲的logK’foc值,然而,壬基酚的log Kow值(4.48)与菲的log Kow值(4.57)很相近。分析表明log[K'foc(NP)/K'foc(Phen)]值与O/C和(N+O)/C元素比值呈显著的正相关关系(P<0.05),与烷氧基碳和极性碳含量呈极显著的正相关关系(P<0.01),表明了氢键的重要性。根据多元线性回归分析,OS、LF和NHC级分的log[K'foc(NP)/K'foc(Phen)]与芳香C-H以及极性碳含量比值有显著的正相关关系。多元线性回归方程为:log[K'foc(NP)/K'foc(Phen)] = 0.22 x1+ 0.050 x2- 2.9 (r=0.88,P=0.001;其中x1是芳香C-H含量,x2是极性碳含量),表明π电子作用和氢键作用可能是导致藻类对壬基酚的吸附能力大于对菲的吸附能力的原因,这与前期报道结果一致[12]。前期研究发现疏水性分配作用是珠江颗粒碳对酚类异雌激素的主要吸附机制[13]。
藻类有机质对菲的吸附参数与极性官能团呈负相关关系,表明极性影响菲和壬基酚的吸附能力,这与文献的报道一致[3, 6, 8]。酸水解去除了大量的多糖和碳水化合物,NHC级分的极性官能团大大减少,因此其对菲和壬基酚的生物吸附能力明显增强。此外,研究发现藻类的脂肪结构对菲和壬基酚的生物吸附有很大的影响[10-11],其他研究也表明有机质对菲的吸附能力与非极性聚亚甲基呈正相关关系[14-15]。
在自然环境中,被污染的水体通常不仅仅含有一种污染物,而是同时存在多种污染物(如重金属、多环芳烃等)共存。利用藻类有机质的生物吸附作用来去除水体的HOCs,可能也会同时去除水体的重金属。
致谢:感谢美国欧道明大学毛景东博士在核磁共振技术表征方面给予的帮助。
[1] Kratochvil D, Volesky B. Advances in the biosorption of heavy metals [J]. Trend in Biotechnology, 1998, 16(7): 291-300
[2] Aksu Z. Application of biosorption for the removal of organic pollutants: A review [J]. Process Biochemistry, 2005, 40(3-4): 997-1026
[3] Chen B L, Johnson E J, Chefetz B, et al. Sorption of polar and nonpolar aromatic organic contaminants by plant cuticular materials: Role of polarity and accessibility [J]. Environmental Science & Technology, 2005, 39(16): 6138-6146
[4] Yang Y, Shu L, Wang X L, et al. Effects of composition and domain arrangement of biopolymer components of soil organic matter on the bioavailability of phenanthrene [J]. Environmental Science & Technology, 2010, 44(9): 3339-3344
[5] Gelin F, Volkman J K, Largeau C, et al. Distribution of aliphatic, nonhydrolyzable biopolymers in marine microalgae [J]. Organic Geochemistry, 1999, 30(2-3): 147-159
[6] Chen B L, Schnoor J L. Role of suberin, suberan, and hemicellulose in phenanthrene sorption by root tissue fractions of switchgrass (Panicum virgatum) seedlings [J]. Environmental Science & Technology, 2009, 43(11): 4130-4136
[7] Kwon J H, Liljestrand H M, Katz L E, et al. Partitioning thermodynamics of selected endocrine disruptors between water and synthetic membrane vesicles: Effects of membrane compositions [J]. Environmental Science & Technology, 2007, 41(11): 4011-4018
[8] Wang X L, Cook R, Tao S, et al. Sorption of organic contaminants by biopolymers:Role of polarity, structure and domain spatial arrangement [J].Chemosphere, 2007, 66(8): 1476-1484
[9] Johnson R L, Schmidt-Rohr K. Quantitative solid-state13C NMR with signal enhancement by multiple cross polarization [J]. Journal of Magnetic Resonance, 2014, 239: 44-49
[10] Zhang D N, Ran C Y, Yang Y, et al. Biosorption of phenanthrene by pure algae and field-collected planktons and their fractions [J]. Chemosphere, 2013, 93(1): 61-68
[11] Zhang D N, Ran Y, Cao X Y, et al. Biosorption of nonylphenol by pure algae, field-collected planktons and their fractions [J]. Environmental Pollution, 2015, 198: 61-69
[12] Yamamoto H, Liljestrand H M, Shimizu Y, et al. Effects of physical-chemical characteristics on the sorption of selected endocrine disruptors by dissolved organic matter surrogates [J]. Environmental Science & Technology, 2003, 37(12): 2646-2657
[13] Gong J, Ran Y, Chen D Y, et al. Association of endocrine-disrupting chemicals with total organic carbon in riverine water and suspended particulate matter from the Pearl River, China [J]. Environmental Toxicology Chemistry, 2012, 31(11): 2456-2464
[14] Chefetz B, Deshmukh A P, Hatcher P G, et al. Pyrene sorption by natural organic matter [J]. Environmental Science & Technology, 2000, 34(14): 2925-2930
[15] Mao J D, Hundal L S, Thompson M L, et al. Correlation of poly(methylene)-rich amorphous aliphatic domains in humic substances with sorption of a nonpolar organic contaminant, phenanthrene [J]. Environmental Science & Technology, 2002, 36(5): 929-936
◆
Composition and Structure of Algal Organic Matter and Their Effect on the Biosorption of Phenanthrene and Nonylphenol
Zhang Dainan, Duan Dandan, Yang Yu, Ran Yong*
Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China
Different cultured and field-collected algal specie samples were collected, selectively fractionated into different organic fractions, and quantitatively characterized by using advanced multi/CP13C NMR techniques. Their biosorption isotherms and mechanism for phenanthrene (Phen) and nonylphenol (NP) were investigated. The LP and NHC fractions exhibited the highest sorption capacities. The observed sorption capacities were highly positively correlated with aliphatic constituent and structure, but negatively related to their polar groups. The higher sorption capacities observed for NP than for Phen could be explained by specific interactions such as hydrogen bonding and π-π interaction.
algal organic matter; phenanthrene (Phen); nonylphenol (NP); biosorption
10.7524/AJE.1673-5897.20151110002
国家自然科学基金;广东省联合重点基金(U1201235)
张代男(1988-),女,博士后,研究方向为天然有机质的结构性质与有机污染物的吸附机制,E-mail: zhangdainan88@163.com
*通讯作者(Corresponding author), E-mail: yran@gig.ac.cn
2015-11-10 录用日期:2015-12-22
1673-5897(2016)2-602-07
X171.5
A
简介:冉勇(1963—),男,博士,研究员,主要研究方向为环境地球化学。
张代男, 段丹丹, 杨余, 等. 藻类有机质的组成结构对菲和壬基酚生物吸附的影响[J]. 生态毒理学报,2016, 11(2): 602-608
Zhang D N, Duan D D, Yang Y, et al. Composition and structure of algal organic matter and their effect on the biosorption of phenanthrene and nonylphenol [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 602-608 (in Chinese)

