三氯生光降解动力学过程及其光降解产物生物毒性评价
廖伟,安继斌,聂湘平,安太成,#
1. 暨南大学 生命科学技术学院生态系,广州 510632 2. 中国科学院广州地球化学研究所,广州 510640 3. 江西省灌溉试验中心站,南昌 338026
三氯生光降解动力学过程及其光降解产物生物毒性评价
廖伟1,3,安继斌2,聂湘平1,,安太成2,#
1. 暨南大学 生命科学技术学院生态系,广州 510632 2. 中国科学院广州地球化学研究所,广州 510640 3. 江西省灌溉试验中心站,南昌 338026
光化学降解是药品及个人护理用品(PPCPs)在环境中转化归趋的重要途径之一,同时光解过程对该类化合物的生态毒性产生重要影响。本研究以抗菌药物三氯生为模型化合物,研究在紫外光照射下,三氯生初始浓度、腐殖酸含量、pH、光强对其光降解动力学的复合影响。采用发光细菌、羊角月牙藻2个不同营养级生物的毒性响应变化评价三氯生母体化合物及光降解过程中毒性变化。研究表明:三氯生光降解遵循准一级反应动力学。初始浓度为10 μmol·L-1、腐殖酸含量为0 mg·L-1,初始pH值为11、光强为0.44 mW·cm-2时,该光化学降解反应体系三氯生有最高的反应速率和降解效率。三氯生光降解过程中产生了对受试生物有较高抑制作用的中间产物,随着光降解时间的延长,光降解中间产物的毒性逐渐降低,在光降解30 min后无显著毒性。
三氯生;羊角月牙藻;光降解;生物毒性评价
Received 16 November 2015 accepted 22 December 2015
光化学转化是影响药物及个人护理用品(PPCPs)环境归趋的重要因素之一[1-5],同时光化学转化也对此类污染物的生态毒效应有重要影响[6-8],因此,研究PPCPs等药物的环境光化学行为,评估该类污染物的环境暴露及其光化学过程中毒性变化有着重要的意义。
三氯生是一种广谱抗菌药,广泛用于药品与个人护理品中的添加物中[9-11],其在废水、地表水[12]、沉积物中均用较高的检测量10~10 000 ng·L-1(kg),特别是在污水处理厂中含量更高[13-14],甚至有达到mg·L-1。此外,在一些人类活动频繁地区的湖泊水体中还会出现生物甲基化[15]。由于三氯生的挥发性低,20 ℃时三氯生蒸汽压为4×10-6mmHg,溶解度为10 mg·L-1;pKa为8.14[16],所以光化学过程是三氯生在水体环境中最主要的降解途径之一。
有机污染物的光化学降解受水中氧含量,腐植酸、pH值影响比较大[8, 16-17]。光化学过程中可产生多种稳定中间产物。三氯生可通过光化学反应生成2,8-二氯代二苯并二噁英(2,8-DCDD) 和2,7-二氯代二苯并二噁英(2,7-DCDD),还可能生成羟基化二氯代二苯并呋喃[8,17-18]。2,8-DCDD 和2,7-DCDD 对生物及人类的潜在危害比三氯生母体化合物更大[1]。像阿特拉津、壬基苯酚等中间产物在水体中的化学稳定性高于化合物本身[19-20]。三氯生环境行为和毒性评估已有大量研究报道,但对三氯生光降解过程及其影响因素,以及其降解中间产物毒性评价的研究报道还很有限。因此,本研究主要目的是通过复合实验,调查在多种因素影响下(初始浓度、HA、pH、光强)TCS光降解的化学过程及降解速率变化规律,并通过不同营养级生物的毒性响应,分析和评价三氯生光降解过程中毒性的变化规律,为三氯生的环境影响评价提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
三氯生(纯度>98.0%)购于东京化成工业株式会社,腐殖酸(Humic acid,fluka No.53680)购于Sigma-Aldrich公司。甲醇为色谱纯,购于CNW;氯化钠、盐酸、氢氧化钠等其他试剂均为分析纯,购于广州试剂厂。超纯水由Millipore-Milli Q 系统制备。
光降解反应器为一个150 mL的可通过循环水冷却的双层石英杯(内有磁力搅拌子),紫外光源功率为125 W,主波长为365 nm的高压汞灯(GGZ-125,上海亚明灯泡厂有限公司)。发光细菌冻干粉为明亮杆菌T3小种(Photobacterium phosphoreum),购买于中国科学院南京土壤研究所。羊角月牙藻(S. capricornutum)藻种由中国科学院水生生物研究所淡水藻种库提供。
1.2 实验方法
按照实验需要将待反应溶液150 mL加入石英降解杯内,通过循环水冷却保持反应器恒温在(25±2) ℃。开启搅拌子、预热过的紫外灯,并打开计时器,根据实验设定的时间表用干净的玻璃管取样,每次取样约1.0~1.5 mL,用直径0.22 μm滤膜过滤,装入1.5 mL细胞瓶置于低温黑暗处待测。
三氯生溶液浓度分析采用安捷伦1200液相色谱,色谱条件:配置安捷伦色谱柱(TC-C18 51892-902,250 mm×4.6 mm,5 μm),DAD检测器的波长:λ=230 nm,流动相:水/甲醇比例为20/80,流速0.8 mL·min-1,自动洗针进样,进样体积为20 μL,柱温30 ℃。
发光细菌毒性试验根据国家标准方法[21],采用明亮发光杆菌为指示生物。根据预实验的结果设定一系列的浓度梯度,每个浓度设3个平行。实验时取出1管发光细菌冻干粉,加入2.5%冷氯化钠溶液1.5 mL于管中,待15 min ~ 20 min发光细菌复活后,再吸取10 μL菌液,按照预设定的时间表加入准备好的待测污染物比色管中,震摇5次,同时用3.0%氯化钠溶液作空白对照。待15 min(时间精确到秒)后用毒性测试仪测定发光度,记录实验结果。根据式1计算发光菌发光强度的相对抑制率(I%)。
I发光抑制率=[L样品管(mV) - L对照管(mV) ]/ L对照管(mV)×100 %
(1)
藻类生长抑制试验参照OECD 201化学品测试方法[22],用单位体积内藻细胞荧光量的测定替代生物量,计算出以比生长率为基础的抑制率。藻类培养基质为AAM培养基,在光照强度3 000 lux,光暗周期12 h:12 h,培养温度25 ℃(L)/20 ℃(D),恒温光照培养箱内培养。藻种活化后,取处于生长对数期的藻种(藻密度为5×105个·mL-1)进行毒性实验,根据设计的试验浓度暴露,利用TD400测量藻液的荧光值,记录实验结果,统计48 h和96 h生长抑制率。

表1 中心复合试验因素设置与水平

表2 表面响应显著性分析及二次方程式系数βx的评估
注:A=三氯生初始浓度/(μmol·L-1),B=腐殖酸含量/(mg·L-1),C=初始pH值,D=光强/(mW·cm-2);R1为光降解30 min去除率/%,R2光降解速率常数/10-2min-1。
Note:A= Initial TCS concentration/(μmol·L-1), B=Humic acid concentration/(mg·L-1), C=pH Value, D=Light intensity/(mW·cm-2), R1=Remove efficiency at 30 min interval/%, R2=Rate constant k1/10-2min-1.
1.3 数据统计与分析
三氯生光化学降解中心复合实验数据用Design-Expert Version 8.0进行数据处理;受试生物毒性试验数据应用SPSS13.0软件进行显著性分析。
2 结果与讨论(Results and discussion)
光解实验前将10 μmol·L-1,30 μmol·L-1三氯生溶液分别置于暗箱和实验台,室温搅拌48 h,检测结果表明降解率均小于1%,表明溶液稳定。
2.1 三氯生光降解试验
中心复合实验的因素设置与水平如表1所示。
实验研究三氯生在不同初始浓度、腐殖酸含量、初始pH值、光强等因素下,光降解30 min降解效率和光降解速率变化规律及各因素之间的相互影响。表面响应显著性分析及二次方程式系数βx的评估如表2。
根据中心复合实验设计,可用二次多项式模型(式2)来描述变量与响应之间的关系。当三氯生光降解30 min降解效率(R1)和反应速率常数(R2)用Y表示,Y与4个变量(x1~x4)之间的关系可以用一个完整的二次方程式去拟合[23],表示如下:
(2)

(3)
(4)
YR1和YR2分别指三氯生光降解30 min降解效率和反应速率常数。将表2中βi和βij值代入式3,4拟出三氯生光化学降解模型方程。
(A)光降解30 min降解效率模型
YR=97.65- 1.52 A- 2.29 B+2.4 C+ 1.68 D+ 1.16 BC- 0.7 B2
(5)
(B)反应速率常数模型
YK1=0.101-0.014A-0.021B+ 0.022C+ 0.012D- 0.005C2
(6)
根据对βx值的统计分析评估各个因素对光化学降解的影响以及各个因素之间的相互影响。所调查的4个因素都是三氯生光降解的显著影响因素。β1和β2均为负值,表明三氯生初始浓度和腐殖酸含量抑制了三氯生光降解。β3和β4均为正值,表明初始pH值和光强表现为促进三氯生光降解。根据其β对应的P值可以看出来三氯生初始浓度对光降解的影响最大,腐殖酸含量其次。β12、β13、β14、β23、β24、β34表示所研究的因素两两之间的影响,从P值分析,三氯生初始浓度,腐殖酸含量,初始pH值和光强之间的影响比较弱,无显著性差异。
实验结果表明三氯生初始浓度(A)和腐殖酸含量(B)对三氯生溶液光化学降解的反应速率有抑制作用,而初始pH值(C)和光强(D)对三氯生溶液光降解的反应速率是促进作用。在λ=290~370 nm范围内, 腐殖酸具有较强的光吸收,所以光掩蔽效应抑制三氯生的光解。此外,腐殖酸还可以捕获或猝灭ROS (如·OH和1O2)[23-24],在一定程度上抑制了三氯生的自敏化光解。Tixier等[25]指出水体中溶解性有机质(DOM)直接或间接地影响着三氯生光降解和迁移。pH影响光降解主要表现在三氯生本身的化学性质上,pH影响三氯生在水溶液中的存在形式。Lindstrom等[15]指出三氯生以酚羟基形式存在的时候处于稳定状态,当酚羟基中H+发生电离,三氯生变的光不稳定,容易发生降解。而影响三氯生电离的原因就是溶液pH的改变。当三氯生分子的初始浓度增加,其每个三氯生分子能获得有效反应的光子的概率降低,从而导致是的反应的减慢,反应速率和降解效率相应的也会抑制。当反应的光强增加时,每个三氯生分子能获得有效反应的光子的概率也增加,所以反应速率和降解效率相应的增加;三氯生初始浓度增加或者光强降低都导致单个三氯生分子获得有效光子概率的降低,从而使光降解反应变缓。
选取对三氯生光降解影响最显著的两个因素对光降解速率影响做三维图分析(图1),可以看出随着初始pH的增加,一定时间内三氯生光降解速率呈现增加的趋势,而腐殖酸含量则表现出抑制作用,随着腐殖酸加入量的增多,三氯生光降解速率逐渐下降。

图1 pH值、腐殖酸含量对三氯生光降解速率常数影响Fig. 1 Two-dimension contour and response surface plots of rate constant k1 for TCS (pH value, humic acid concentration)

图2 三氯生光降解不同时间段样品对明亮发光细菌毒性影响([TCS]=30 μmol·L-1, WL=0.32 mW·cm-2, Initial pH=7)注:图2B中带*标示的为根据三氯生光降解不同时间所取样品中三氯生母体化合物含量配制的只含三氯生等量浓度而没有三氯生光降解过程中生成的产物的暴露液。Fig. 2 Toxic test of TCS parent and photolysis products chemical to luminous bacteria (Photobacterium phosphoreum) ([TCS]=30 μmol·L-1, WL=0.32 mW·cm-2, Initial pH=7)Note: Marker * in figure 2B means TCS solution without any photolysis byproducts, which was made up based on the TCS parent content in the sample through different photolysis times.
通过软件(Design Expert)模拟出三氯生在水体中最佳降解去除效率时4种调查因素水平:当三氯生初始浓度(10 μmol·L-1)和腐殖酸浓度(0 mg·L-1)最低,初始pH值(11)和光强(0.44 mW·cm-2)最高时三氯生光降解有着最高效的降解效率和最大反应速率。
2.2 三氯生毒性试验
三氯生对明亮发光杆菌EC50(15 min)=0.055 mg·L-1,95%可置信区间在0.048~0.061 mg·L-1.在初始浓度为30 μmol·L-1(约9 mg·L-1),pH=7,光强为0.32 mW·cm-2的条件下进行光降解,将三氯生光降解不同时间段产生的溶液按照一定比例用纯水稀释进行发光细菌毒性试验。
图2为不同条件下三氯生光降解不同时间段所取样品对明亮发光细菌毒性影响。图2(A)显示三氯生光降解不同时间的样品,不同稀释比例,对发光细菌的抑制率都有先升高再降低的趋势。说明三氯生光降解过程中产生了对发光细菌毒性风险较高的产物,随着三氯生溶液的进一步光降解,对发光细菌的抑制率逐渐降低,当三氯生溶液光降解30 min后,对发光细菌毒性基本消失。图2(B),三氯生光降解不同时间的样品1:60比例稀释时,所调查的各个时间段三氯生光降解混合物对发光细菌抑制率均低于相同浓度三氯生暴露液,而1:30比例稀释时,所调查的各个时间段三氯生光降解混合物对发光细菌抑制率均高于相同浓度三氯生暴露液。由于三氯生光降解过程中间产物比较多,不同降解时间段主要中间产物及母体化合物变化较大,在溶液中存在形式等导致生物有效性不同,从而导致对发光细菌毒性表现不一致,总体上表现为三氯生光降解过程中可能产生对发光细菌毒性风险较高的产物。
三氯生对羊角月牙藻96 h急性毒性EC50(96 h)=0.092 mg·L-1,95%可置信区间在0.085~0.11 mg·L-1。三氯生母体溶液及三氯生不同降解时间的样品溶液对羊角月牙藻暴露毒性与发光杆菌暴露毒性相似。实验结果如图3。
三氯生光降解不同时间的样品溶液随着稀释倍数的增加毒性降低。所取三氯生光降解样品对羊角月牙藻生长抑制随着光降解时间增加有先降低再升高后降低的趋势,三氯生光降解过程中可能产生了对羊角月牙藻生长抑制毒性的中间产物,但随着三氯生进一步光降解,对羊角月牙藻的生长抑制逐渐降低甚至消失。由图3可知三氯生光降解在20~30 min内是一个显著的脱毒过程,40 min的样品对96 h羊角月牙藻生长抑制率不显著性,认为经过光降解40 min的三氯生溶液对羊角月牙藻无毒,实验结果与发光细菌一致。
三氯生及其光降解不同时间段样品分别按照1:60稀释后对羊角月牙藻48 h和96 h急性毒性评估。为进一步研究三氯生光降解不同时间的样品对羊角月牙藻毒性变化,如图4(B)根据三氯生光降解样品中三氯生母体化合物含量做了一个对比实验。不同时间光降解样品暴露液与含有相同三氯生浓度暴露液对比,其对羊角月牙藻抑制率均为光降解不同时间样品暴露液低于只含三氯生母体化合物的暴露液,与发光细菌1:30,1:60比例稀释的暴露液实验结果一致,但2种生物毒性实验结果都表明,三氯生光降解不同时间暴露液均出现毒性先升高后降低,最后消失的趋势。
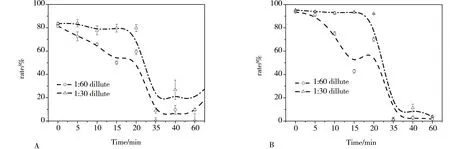
图3 三氯生光降解不同时间样品对羊角月牙藻毒性([TCS]=30 μmol·L-1, WL=0.32 mW·cm-2;(A) 48 h,(B) 96 h)Fig. 3 Toxic test of TCS parent and photolysis products chemical to S. capricornutum ([TCS]=30 μmol·L-1, WL=0.32 mW·cm-2; (A) 48 h; (B) 96 h)

图4 三氯生光降解不同时间所取样品按照1:60稀释后对羊角月牙藻毒性影响([TCS]=30 μmol·L-1, WL=0.32 mW·cm-2)注:图4(B)坐标轴带*标示根据三氯生不同光化学降解时间所取样品中三氯生母化合物含量配制的只含等量的三氯生母体化合物而不含三氯生光降解中间产物的暴露液。Fig. 4 Toxic test of TCS parent and photolysis products chemical to S. capricornutum ([TCS]=30 μmol·L-1, WL=0.32 mW·cm-2)Note: Marker * in figure 4B means TCS solution without any photolysis byproducts, which was made up based on the TCS parent content in the sample through different photolysis times.
研究结果表明三氯生对光合细菌、羊角月牙藻具有较高毒性,与文献资料报道三氯生对水生生物有剧毒结论相一致。Orvos等[26]研究了三氯生对藻类的急性毒性实验,其研究结果表明栅藻EC50(96 h)=1.4 μg·L-1。Barcelo等[27]研究三氯生对发光细菌(Vibrto fischeri)急性毒性实验时,EC50(15 min)=150 μg·L-1。本研究的结果明亮发光杆菌EC50(15 min)=55 μg·L-1,羊角月牙藻EC50(96 h)=92 μg·L-1,结果与其他文献有一定差异。三氯生杀菌作用机理是通过作用于细菌脂肪酸合酶系统中的烯酰基载体蛋白还原酶,抑制脂肪酸的合成,从而达到抗菌的目的。因此,大部分单细胞生物和水生生物均成为其靶生物,所以三氯生对水生生物表现了较高的急性毒性。本研究所用两种毒评估生物,对三氯生母体化合物敏感性(急性毒性)为明亮发光杆菌>羊角月牙藻,与国内外多数研究者数据相一致[26-27]。光降解过程毒性评估方面,则羊角月牙藻表现的最为敏感。研究中分别作了样品母液按照1:60,1:30两组实验,当稀释倍数为30倍时,所有样品对羊角月牙藻均有较高的毒性,降解过程中毒性变化有降低的趋势。当稀释倍数高于60倍时,降解前20 min种的样品均存在比较高的毒性,随着降解时间的延长,样品毒性急剧降低,当样品降解30 min后抑制率不明显。
三氯生光降解遵循准一级反应动力学。光降解效率和准一级动力学速率受到,初始反应浓度、腐殖酸含量,pH和光强等多种因素影响。三氯生光降解过程中产生了对受试生物有较高抑制作用的中间产物,随着光降解时间的延长,光降解中间产物的毒性逐渐降低,在光降解30 min后无显著毒性。羊角月牙藻对于TCS暴露具有较好的指示性。
[1] Boreen A L, Arnold W A, McNeill K. Photodegradation of pharmaceuticals in the aquatic environment: A review [J]. Aquatic Sciences, 2003, 65(4): 320-341
[2] Katagi T. Photodegradation of pesticides on plant and soil surfaces [J]. Reviews of Environmental Contamination and Toxicology, 2004, 182: 1-78
[3] Liu Q T, Williams H E. Kinetics and degradation products for direct photolysis of β-blockers in water [J]. Environmental Science & Technology, 2007, 41(3): 803-810
[4] Arnold W A, Edhlund B L, McNeill K. Aquatic photochemistry of nitrofuran antibiotics [J]. EnvironmentalScience & Technology, 2006, 40(17): 5422-5427
[5] Graham D W, Knapp C W, Cardoza L A, et al. Fate and effects of enrofloxacin in aquatic systems under different light conditions [J]. Environmental Science & Technology, 2005, 39(23): 9140-9146
[6] Yin D Q, Jiao S J, Zheng S R, et al. Aqueous photolysis of tetracycline and toxicity of photolytic products to luminescent bacteria [J]. Chemosphere, 2008, 73(3): 377-382
[7] Choi K, Jung J, Kim Y, et al. Environmental levels of ultraviolet light potentiate the toxicity of sulfonamide antibiotics in Daphnia magna [J]. Ecotoxicology, 2008, 17(1): 37-45
[8] Latch D E, Packer J L, Stender B L, et al. Aqueous photochemistry of triclosan: Formation of 2,4-dichlorophenol, 2,8-dichlorodibenzo-p-dioxin, and oligomerization products [J]. Environmental Chemistry, 2005, 24(3): 517-525
[9] Daughton C G, Ternes T A. Pharmaceuticals and personal care products in the environment: Agents of subtlechange? [J]. Environmental Health Perspectives, 1999, 107: 907-938
[10] Bhargava H, Leonard P A. Triclosan:Applications and safety [J]. American Journal of Infection Control, 1996, 24(3): 209-218
[11] Cox A R. Efficacy of the antimicrobial agent triclosan in topical deodorant products: Recent developments in vivo [J]. Journal of the Society of Cosmetic Chemists, 1987, 38(4): 223-231
[12] Singer H, Müller S, Tixier C, et al. Triclosan:Occurrence and fate of a widely used biocide in the aquatic environment: Field measurements in wastewater treatment plants, surface waters, and lake sediments [J]. Environmental Science & Technology, 2002, 36(23): 4998-5004
[13] Lam P K S, Gulkowska A, Leung H W, et al. Removal of antibiotics from wastewater by sewage treatment facilities in Hong Kong and Shenzhen, China [J]. Water Research, 2008, 42(1-2): 395-403
[14] Ying G G, Kookana R S. Triclosan in wastewaters and biosolids from Australian wastewater treatment plants [J]. Environment International, 2007, 33(2): 199-205
[15] Lindstrom A, Buerge I J, Poiger T, et al. Occurrence and environmental behavior of the bactericide triclosan and its methyl derivative in surface waters and in wastewater [J]. Environmental Science & Technology, 2002, 36(11): 2322-2329
[16] Morrall D, McAvoy D, Schatowitz B, et al. A field study of triclosan loss rates in river water (Cibolo Creek, TX) [J]. Chemosphere, 2004, 54(5): 653-660
[17] Sanchez-Prado L, Llompart M, Lores M, et al. Monitoring the photochemical degradation of triclosan in wastewater by UV light and sunlight using solid-phase microextraction [J]. Chemosphere, 2006, 65(8): 1338-1347
[18] Wong-Wah-Chung P, Rafqah S, Voyard G, et al. Photochemical behaviour of triclosan in aqueous solutions: Kinetic and analytical studies [J]. Journal of Photochemistry and Photobiology A, 2007, 191(2-3): 201-208
[19] Yu J C, Kwong T Y, Luo Q, et al. Photocatalytic oxidation of triclosan [J]. Chemosphere, 2006, 65(3): 390-399
[20] Aranami K, Readman J W. Photolytic degradation of triclosan in freshwater and seawater [J]. Chemosphere, 2007, 66(6): 1052-1056
[21] 国家环境保护局. GB/T15441-1995水质急性毒性的测定发光细菌法[S]. 北京: 中国标准出版社, 1995
[22] Organisation for Economic Co-operation and Development (OECD). Guidelines for testing of chemicals, 201 alga growth inhibition test [S]. Paris: OECD, 1984
[23] Fisher J M, Reese J G, Pellechia P J, et al. Role of Fe (III), phosphate, dissolved organic matter, and nitrate during the photodegradation of domoic acid in the marine environment [J]. Environmental Science & Technology, 2006, 40(7): 2200-2205
[24] Lam M W, Tantuco K, Mabury S A. Photofate: A new approach in accounting for the contribution of indirect photolysis of pesticides and pharmaceuticals in surface waters [J]. Environmental Science & Technology, 2003, 37(5): 899-907
[25] Tixier C, Singer H P, Canonica S, et al. Phototransformation of triclosan in surface waters: A relevant elimination process for this widely used biocide - Laboratory studies, field measurements, and modeling [J]. EnvironmentalScience & Technology, 2002, 36(16): 3482-3489
[26] Orvos D R, Versteeg D J, Inauen J, et al. Aquatic toxicity of triclosan [J]. Environmental Toxicology and Chemistry, 2002, 21(7): 1338-1349
[27] Barcelo D, Farre M, Asperger D, et al. Assessment of the acute toxicity of triclosan and methyl triclosan in wastewater based on the bioluminescence inhibition of Vibrio fischeri [J]. Analytical and Bioanalytical Chemistry, 2008, 390(8): 1999-2007
◆
Photolysis of Triclosan in Aqueous Solution and Toxic Assessment of Its Photolytical Products to Hydrobios
Liao Wei1,3, An Jibing2, Nie Xiangping1,*, An Taicheng2,#
1. Department of Ecology/Institute of Hydrobiology, Jinan University, Guangzhou 510632, China 2. State Key Laboratory of Organic Geochemistry and Guangdong Key Laboratory of Environmental Resources Utilization and Protection, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China 3. Irrigation Experiment Station of Jiangxi, Nanchang 338026, China
Photolysis is one of the most important pathways of pharmaceuticals and personal care products (PPCPs) elimination in natural environment. Photolysis can also influence the ecotoxicological effects of these PPCPs. The aim of the present study was to investigate the effects of selected variables on the photolysis kinetics of triclosan (TCS) and the toxic effects of TCS and its photolysis products to aquatic organisms. On basis of the study known, four experimental variables including initial TCS concentration, humic acid (HA) concentration, initial pH and light intensity were selected in the multivariable experimental design. The optimized conditions were as following: initial TCS concentration (10 μmol·L-1), HA concentration at (0 μmol·L-1), initial pH 11 and light intensity (0.44 mW·cm2). The photolysis products of TCS are more toxic to Photobacterium phosphoreum and Selenastru capricornutum. The results presented in this study will provide basic data for the photolysis and ecotoxicological assessment of TCS.
triclosan; Selenastrum capricornutum; Photobacterium phosphoreum; photocysis; toxicity assessment
10.7524/AJE.1673-5897.20151116001
国家科技支撑计划课题(2012BAC07B05)
廖伟(1987-),男,硕士研究生,研究方向为环境科学,E-mail: lovy21@163.com
*通讯作者(Corresponding author), E-mail: txpnie@jnu.edu.cn
2015-11-16 录用日期:2015-12-22
1673-5897(2016)2-586-07
X171.5
A
简介:聂湘平(1966-),男,博士,教授,主要从事生态毒理学研究。
共同通讯作者简介:安太成(1972-),男,博士,教授,主要从事环境化学及环境工程研究。
廖伟, 安继斌, 聂湘平, 等. 三氯生光降解动力学过程及其光降解产物生物毒性评价[J]. 生态毒理学报,2016, 11(2): 586-592
Liao W, An J B, Nie X P, et al. Photolysis of triclosan in aqueous solution and toxic assessment of its photolytical products to hydrobios [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 586-592 (in Chinese)
*共同通讯作者(Co-corresponding author),E-mail: antc99@gig.ac.cn

