冶炼企业周边农田土壤的多环芳烃污染及其细菌群落效应
吴宇澄,林先贵,,朱清禾,曾军,丁庆旻
1. 中国科学院南京土壤研究所 土壤与农业可持续发展国家重点实验室,南京 210008 2. 中国科学院南京土壤研究所-香港浸会大学土壤与环境联合开放实验室,南京 210008
冶炼企业周边农田土壤的多环芳烃污染及其细菌群落效应
吴宇澄1,2,林先贵1,2,,朱清禾1,2,曾军1,2,丁庆旻1,2
1. 中国科学院南京土壤研究所 土壤与农业可持续发展国家重点实验室,南京 210008 2. 中国科学院南京土壤研究所-香港浸会大学土壤与环境联合开放实验室,南京 210008
多环芳烃是一类持久性有机污染物,进入土壤后可能产生多方面生态效应。为研究多环芳烃对土壤微生物的影响,选取南京某冶炼企业周边农田样品,在分析污染物含量基础上,采用高通量测序、定量PCR等方法综合评价了土壤细菌多样性和组成以及多环芳烃降解细菌丰度等特征。17个土壤样品中,多环芳烃总量为0.25 ~ 31.08 mg·kg-1,并具有随污染源距离增加而降低的空间分布特征。与土壤理化性质如pH相比较,多环芳烃污染对土壤细菌的总体多样性和群落组成影响不显著。进一步分析发现多环芳烃与潜在降解微生物的相对丰度和降解功能基因(芳香环羟基化双加氧酶,PAH-RHDα)拷贝数显著正相关。污染较重样品的克隆、测序分析表明,土壤中PAH-RHDα基因主要属于革兰氏阳性细菌nidA3/fadA1类群,且与分支杆菌相关序列较为接近。这些结果综合评价了冶炼企业周边农田土壤多环芳烃污染对微生物群落的影响,提示土壤污染在多环芳烃潜在降解细菌中的富集作用,将为后续污染土壤生物修复提供重要科学依据。
多环芳烃;土壤细菌;芳香环羟基化双加氧酶;分枝杆菌;群落效应
Received 26 October 2015 accepted 16 November 2015
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是一类具有稠合苯环结构的有机污染物,主要来自化石燃料,特别是煤的燃烧、车辆尾气以及一些生物质燃烧过程[1]。工业排放是环境中多环芳烃的重要来源,可导致附近农田土壤的污染[2-3],并进而通过食物链传递导致人体健康风险。
多环芳烃对土壤生态系统具有广泛的影响,如引起土壤动物死亡[4],抑制植物生长[5],损害土壤功能如硝化等[6]。微生物作为土壤生态系统中广泛存在、最为活跃的组成部分,和PAHs污染物之间存在复杂的相互作用。一方面,PAHs污染具有微生物群落效应,体现为对土壤微生物多样性、组成及生理功能的潜在影响[7-8],反映污染物对微生物的潜在毒害效应;另一方面,部分微生物可通过多种酶学机制如芳香环羟基化双加氧酶(PAH ring-hydroxylating dioxygenase, PAH-RHD)等转化PAHs[9],是控制土壤有机污染物的关键因素。但是,目前对PAHs土壤微生物群落效应的认识,多基于极端污染情况[10],未考虑污染物的老化过程[7],不能反映一般污染条件下的微生物响应规律。
冶炼企业是重要的多环芳烃工业排放源,其周边土壤往往存在PAHs污染[11]。本研究系统采集南京市郊某冶炼企业周边农田土壤,测定污染物含量,采用高通量测序和定量PCR方法深入解析土壤细菌群落多样性和组成,并分析潜在PAHs降解细菌的响应情况。研究的主要目的在于分析工业排放导致农田土壤PAHs污染的微生物群落效应,其结果将为评价PAHs的微生物生态毒性以及污染土壤生物修复提供科学依据。
1 材料与方法(Materials and methods)
1.1 样品采集
南京市郊某大型冶炼企业,其炼焦、热电等生产部门产生的废气排入大气,是潜在的多环芳烃排放源。该企业东、南方主要为农田,受到大气沉降的影响,存在一定污染风险。以厂区为起点,在该区域盛行下风向沿偏东、偏南两个方向开展采样,共设置17个样点(MS-1~MS-17,图1)。其中,MS-1、MS-2最接近潜在污染源(热电厂烟囱,约500 m);偏南方向包括MS-3至MS-10,最远处距污染源约5 km;偏东方向包括MS-11至MS-17,最远处距污染源约4.5 km。各采样点均为蔬菜地。采样于2014年12月进行,采用手动土壤采样器按5点采样法收集5 m×5 m范围内表层农田土壤(0~10 cm),充分混匀成为一个混合土样。土样一部分经风干、磨细后用于PAHs及理化性质分析,另一部分置于-20 ℃保存,用于微生物生态研究。

图1 冶炼企业周边采样点分布Fig. 1 Soil sampling sites around the steel plant
1.2 土壤理化性质测定
采用酸度计测定土壤的pH值(水土比5:1);标准方法分析土壤总碳、总氮、全磷、全钾[12];采用2 mol·L-1KCl溶液提取土壤无机氮(铵态氮、硝态氮),流动分析仪(SKALAR)测定。
1.3 土壤多环芳烃的提取与分析
测定土壤中15种USEPA优先控制多环芳烃的含量,即萘、苊、芴、菲、蒽、荧蒽、芘、苯并[a]蒽、屈、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、茚并[1,2,3-cd]芘、二苯并蒽和苯并[g, h, i]苝。具体方法为:称取10 g干土,用60 mL二氯甲烷在索氏装置上提取24 h,30 ℃旋转蒸干。加入2 mL环己烷溶解,取0.5 mL溶解液过硅胶柱,加入正己烷/二氯甲烷混合液(1:1)洗脱。洗脱液经氮气吹干,用乙腈溶解并定容至5 mL。
采用超快速液相色谱(岛津UFLC-20系统)检测土壤多环芳烃的含量。流动相为乙腈/水混合液,流速为0.8 mL·min-1,柱温40 ℃。分离柱为反相Waters C18-PAH专用柱(4.6 mm×250 mm,粒径5 μm),荧光检测器检测。
1.4 土壤DNA提取
采用FastDNA SPIN Kit for Soil试剂盒(MP Biomedicals)提取土壤DNA,微量分光光度计(NanoDrop 2000)和电泳法检测DNA的质量。为避免共提取的土壤腐殖质等杂质干扰PCR反应,DNA提取液经10倍稀释后用于下游分析。
1.5 细菌16S rRNA基因高通量测序及数据分析
采用通用引物519F和907R扩增细菌16S rRNA基因片段。正向引物序列中包含5 bp的条形码(barcode)序列。PCR反应体系为50 μL,包括25 μL Taq DNA聚合酶预混液(Takara), 1 μL模板(约50 ng基因组DNA),1 μL正向及反向引物,23 μL ddH2O。PCR扩增条件为95 ℃ 3 min;95 ℃ 45 s, 56 ℃ 45 s, 72 ℃ 60 s,35个循环;72 ℃ 7 min。PCR产物经纯化后,构建测序文库,采用Illumina MiSeq系统进行双向高通量测序。
基于QIIME分析平台进行高通量数据分析。序列经拼接、比对后在97%相似性水平划分操作分类单元(operational taxonomic unit,OTU),在此基础上计算多样性指数,包括observed species,Chao1,Phylogenetic Diversity (PD),Shannon和Simpson多样性指数等;通过与Greengene database数据库比较确定序列的系统学分类。
1.6 PAH-RHDα基因定量PCR分析
参照文献报道方法[13],采用定量PCR方法测定各样品革兰氏阳性和阴性细菌PAH-RHDα基因的拷贝数。定量PCR标准品的制备方法为:克隆目标基因(具体方法见1.7),提取质粒后测定浓度并计算拷贝数,梯度稀释制备标准曲线(拷贝数范围107~101μL-1)。定量PCR标准曲线R2>0. 99,扩增效率>80%。
定量PCR采用Sybr Green方法,总反应体系为25 μL,包含12.5 μL TransStart Green qPCR SuperMix(全式金),2 μL土壤DNA和10 pmol引物。反应程序为三步法:95 ℃预变性3 min;94 ℃ 15 s,55℃退火 45 s,95℃延伸30 s并读取荧光信号,共进行40个循环;随后进行熔解曲线分析和电泳评价扩增单一性。
1.7 革兰氏阳性细菌PAH-RHDα基因克隆、测序与序列分析
PCR扩增革兰氏阳性细菌的PAH-RHDα基因,经割胶纯化后克隆至pEASY-T1载体,并转化感受态大肠杆菌。根据菌落颜色随机挑选阳性克隆并测序,所获序列经去除载体和引物部分后,用Mothur软件进行比对和划分操作分类单元。采用MEGA6软件,以Maximum likelihood (ML)方法重建PAH-RHDα基因的系统发育树。
1.8 数据分析
用SPSS13.0进行相关性分析,双侧检验判断显著性;CANOCO 4.5软件进行典范对应分析(canonical correspondence analysis, CCA)。
2 结果(Results)
2.1 土壤理化性质
土壤理化性质分析结果如表1所示。由各因子变异系数可见,17个样品的全磷、铵态氮、硝态氮和PAHs总量性质存在较大差异,而总碳、总氮、碳氮比和全钾总体变化不大。pH值的变化幅度为4.74~7.66,表现出较高的土壤酸碱性差异。
2.2 土壤PAHs含量及组成特征
所有土壤样品中均检出多环芳烃,15种PAHs总量(Σ15PAHs)为0.25~31.08 mg·kg-1(表1)。最靠近排放源的MS-1和MS-2中,Σ15PAHs接近7 mg·kg-1。随着距离增加,土壤PAHs含量迅速降低。在偏东方向,Σ15PAHs由MS-11的1.72 mg·kg-1逐渐降至MS-15至MS-17的0.30 mg·kg-1左右;在偏南方向,除MS-9外,PAHs总量处于0.51~0.96 mg·kg-1之间。所有样品中,MS-9的PAHs总量最高,达31.08 mg·kg-1。
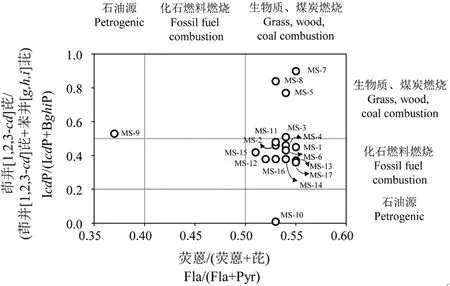
图2 荧蒽/(荧蒽+芘)和茚并[1,2,3-cd]芘/(茚并[1,2,3-cd]芘+苯并[g,h,i]苝)的十字交叉图 注:多环芳烃比值范围参照文献[14-15]。Fig. 2 Cross plot of Fla/(Fla+Pyr) and IcdP/(IcdP+BghiP) ratio Note: The diagnostic ratios are referred to [14-15].
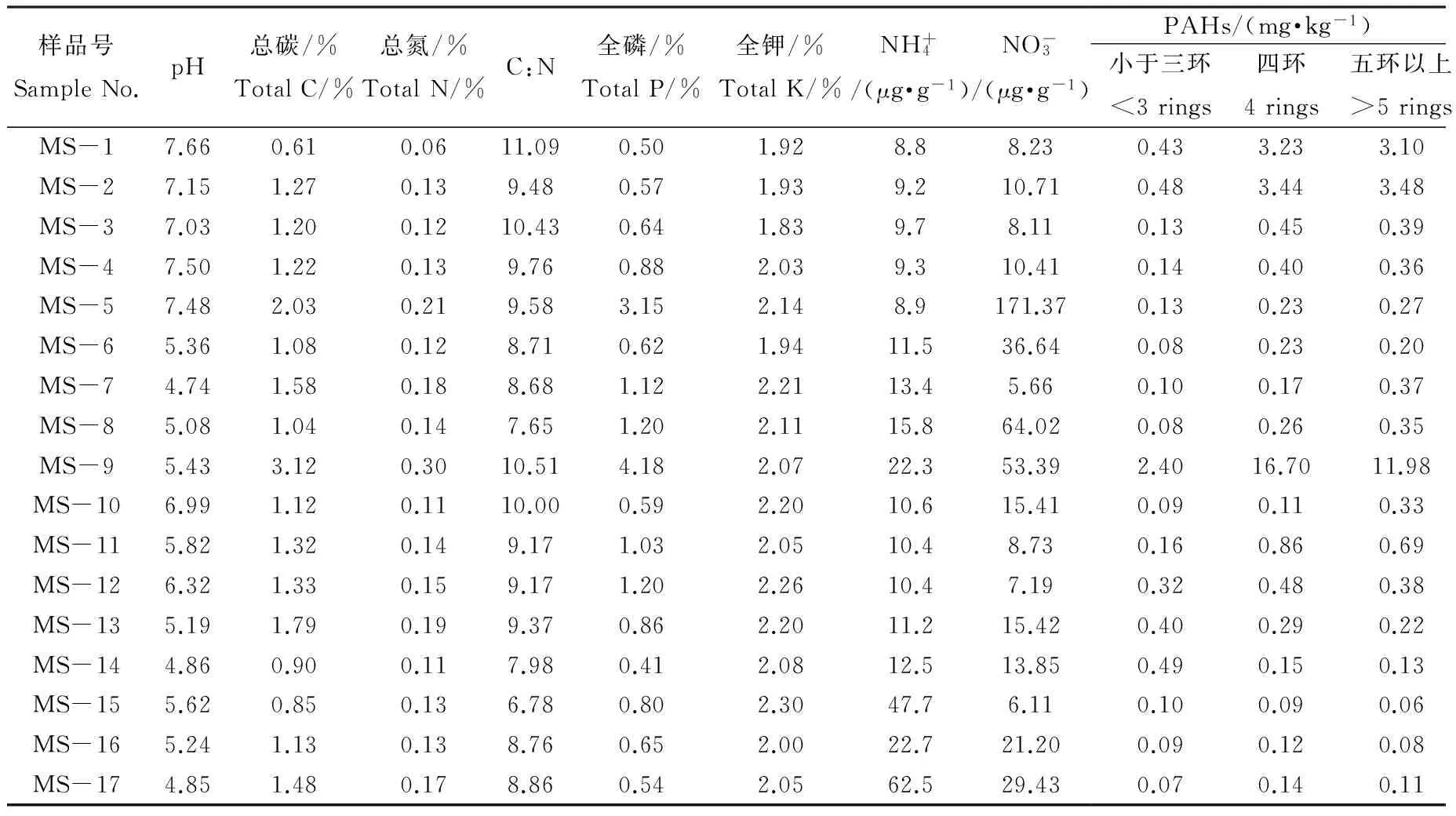
表1 各样点土壤基本性质及多环芳烃含量
按环数统计PAHs组成,接近污染源样品(MS-1和MS-2)和偏南方向样点(MS-3至MS-10)中均以4环及以上PAHs为主,偏东部分样点中三环及以下的低环组分比例较高(表1)。计算荧蒽/(荧蒽+芘)(Fla/(Fla+Pyr))和茚并[1,2,3-cd]芘/(茚并[1,2,3-cd]芘+苯并[g,h,i]苝)(IcdP/(IcdP+BghiP))比值,并作十字交叉图(图2)。图中大部分样点聚为一群,体现出煤炭及化石燃料燃烧的特征;偏南方向5个样点(MS-5,MS-7至MS-10)明显偏离,其中MS-9部分呈现石油源特征。
2.3 土壤细菌群落多样性与组成
17个土壤样品共获得22.5万余条16S rRNA基因序列,各样品序列数为8 786~20 433条。基于OTU计算各样品多样性指数并与环境因子作相关分析,结果显示PAHs与细菌多样性指数间无显著相关性,在土壤因子中仅有pH与各多样性指数间存在显著正相关(表2)。
各土壤在门水平的细菌群落组成如图3所示。该区域农田土壤的优势细菌有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)等。CCA排序图中,第一和第二排序轴共解释32.3%的群落变异,pH和总磷两个因子对细菌组成影响显著(P<0.05)。MS-9与MS-5的细菌群落组成与其他样点分异较大,pH中性的土壤MS-1、MS-2、MS-3、MS-4、MS-10聚在一起,位于CCA图的右侧,而其他更偏酸性的土壤则聚集在图中的左侧。
在属的水平,与Σ15PAHs显著正相关(P<0.05),且至少一个样品中相对丰度在0.5%以上的细菌有12个,其中已有文献报道具有PAHs降解能力的是分枝杆菌(Mycobacterium)[16]、红球菌(Rhodococcus)[17]、Actinomadura[18]、Nocardioides[19]等4个。如果排除PAHs总量异常偏高的MS-9,则仅有分枝杆菌的相对丰度与Σ15PAHs显著正相关(图5a)。
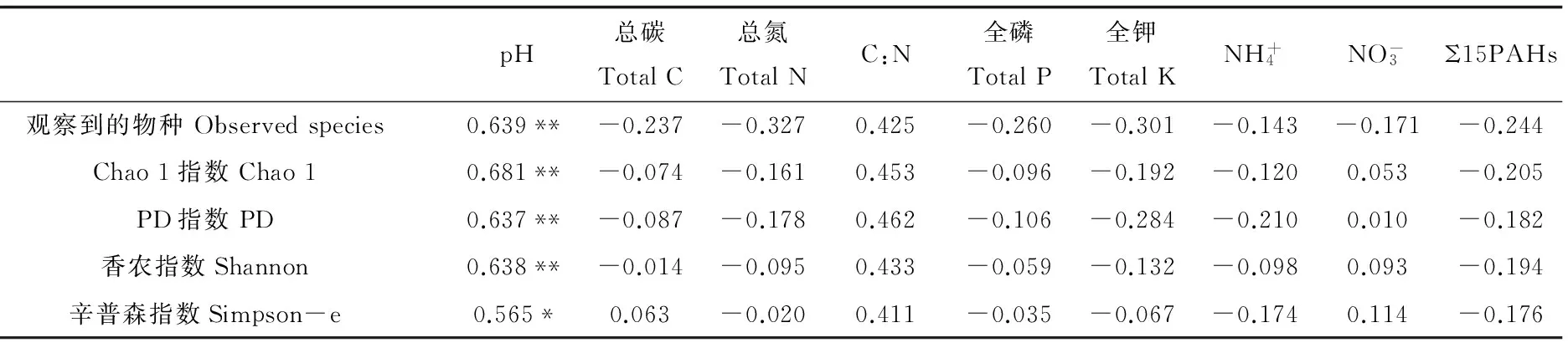
表2 多样性指数与土壤性质及多环芳烃总量间的相关性
注:*和**分别表示显著(P<0.05)和极显著相关(P<0.01)。
Note: * and ** indicate significance at the level of P<0.05 and P<0.01, respectively.
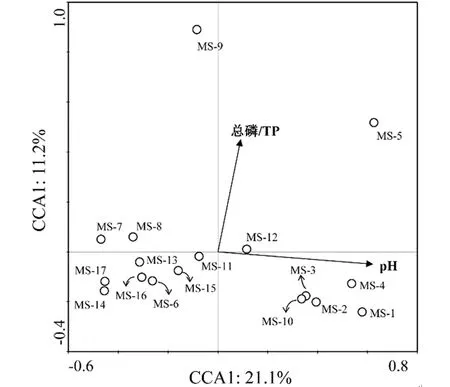
图4 细菌和环境因子的CCA分析Fig. 4 Canonical correspondence analysis of bacterial community in PAHs-contaminated soils
2.4 PAH-RHDα基因丰度和组成
定量PCR检测中,各样品中革兰氏阴性菌均低于检测限。革兰氏阳性菌PAH-RHDα基因扩增产物经熔解曲线和电泳分析为单一峰(条带),表明实验结果不受引物二聚体或非特异扩增的影响。17个土壤样品中,革兰氏阳性菌PAH-RHDα基因拷贝数范围为每克干土0.39×104~1.6×105拷贝,并与土壤中的多环芳烃总量显著正相关(图5b)。
选择PAH-RHDα基因丰度较高的MS-1、MS-2 和MS-9样品进行基因克隆和测序分析,共获得55个序列,经序列比对后在95%相似性划分为4个OTU,其中OTU-1和OTU-2占所获序列的91%。在系统发育树上,这些序列与分支杆菌M. vanbaalenii和M. rhodesiae的nidA3B3基因最为接近,同属于双加氧酶的nidA3/fadA1类群(图6)。
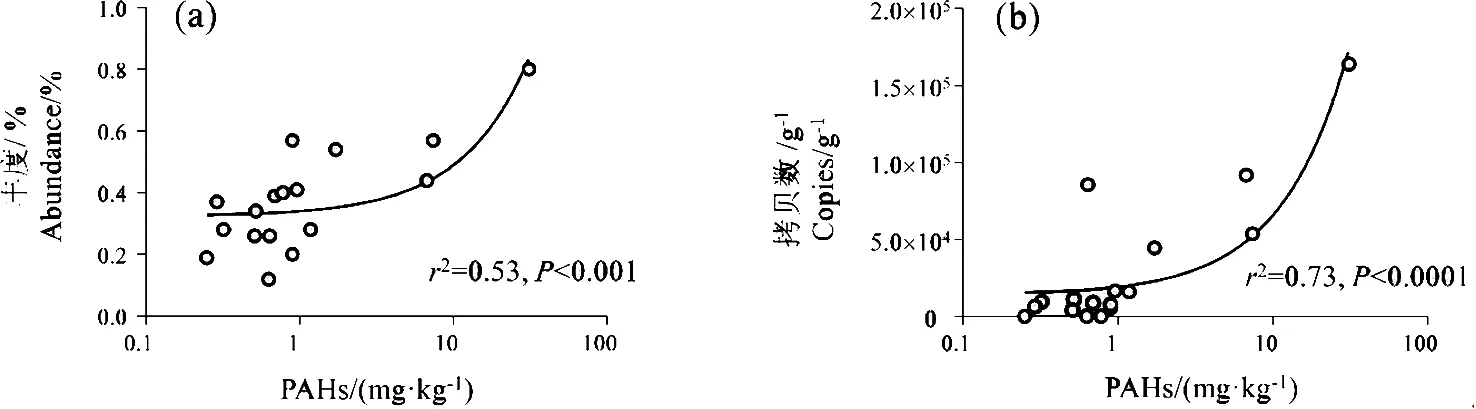
图5 PAHs含量与(a)分支杆菌相对丰度和(b)革兰氏阳性细菌PAH-RHDα基因丰度的关系Fig. 5 Correlations between PAHs concentration and (a) relative abundance of Mycobacterium and (b) copies of GP PAH-RHDα gene

图6 三个土壤中革兰氏阳性细菌PAH-RHDα基因的系统发育树 注:本研究所获序列以RHDα OTU开头,括号中数字为OTU包含序列数。Fig. 6 Maximum likelihood tree of GP bacterial PAH-RHDα gene recovered from MS-1, MS-2 and MS-9 Note: The sequences recovered in this study begin with RHDα OTU. The numbers in the parentheses represent the number of sequences comprising the OTU.
3 讨论(Discussion)
3.1 冶炼企业周边农田土壤PAHs污染特征
本研究涉及17个农田样点,距离污染源(热电厂烟囱)距离从数百米至5 km不等。所有受试土壤中均检出PAHs,含量变异较大。根据加拿大、荷兰等国家现行土壤环境质量标准,接近排放源样品中有4个(MS-1,MS-2,MS-3和MS-11)苯并[a]芘含量超出限定值(>0.1 mg·kg-1);以总量计算,接近排放源的样品(MS-1至MS4,MS-11和MS12)接近或超过1 mg·kg-1(表1),污染程度相对较高。随着距离的增加,PAHs总量迅速降低至1 mg·kg-1以内,呈现由近及远污染程度下降的趋势。高污染土壤的Fla/(Fla+Pyr)比值接近燃煤特征值[15](图2)。由于研究区域内没有其他高能耗企业或大量民用煤炭消耗,因此,该冶炼企业的排放可能是邻近农田土壤PAHs污染的主要原因。根据IcdP/(IcdP+BghiP)比值,偏东及偏南方向部分样品PAHs具有化石燃料燃烧特征[15],这可能与这部分样点临近公路,受到车辆排放影响有关。MS-9样品除PAHs总量外,苯并[a]芘含量高达4.0 mg·kg-1,是调查中所发现污染最严重的样点,由于其远离冶炼企业,具体污染源尚待进一步调查。
3.2 多环芳烃对土壤细菌群落的影响
高浓度多环芳烃污染土壤可以显著改变微生物的多样性[20]、群落组成[7]和生理活性[8]。但在农田生态系统中,PAHs污染程度一般远低于前述研究[21-22];PAHs与土壤的相互作用影响其赋存形态,将导致生物有效性的变化[23],这些因素可能导致不同的微生物响应特征。本研究对某冶炼厂周边农田土壤中细菌群落的分析表明,相对于pH等土壤因子,PAHs污染未能明显影响细菌多样性和群落组成(表2,图4),这可能与研究区域土壤污染水平相对不高和PAHs老化后生物有效性低有关。
由于部分细菌具有PAHs降解功能,本研究重点分析了土壤中潜在PAHs降解菌的变化情况。从高通量测序数据中可以发现分支杆菌、红球菌、Actinomadura、Nocardioides等革兰氏阳性PAHs降解细菌的相对丰度与Σ15PAHs显著正相关。另一方面,PAH-RHD是细菌降解PAHs的关键酶,其基因(PAH-RHDα)拷贝数通常反映了PAHs降解细菌的丰度[13],而高浓度多环芳烃往往导致土壤中PAH-RHDα基因的富集[24]。本研究未能检出革兰氏阴性菌PAH-RHDα基因,提示土壤中该类降解菌的数量较少。对PAHs含量较高土壤中革兰氏阳性菌PAH-RHDα的克隆测序结果表明其组成单一,主要属于nidA3/fadA1类群[25],与分支杆菌等细菌所含序列较为接近。因此,以分支杆菌为代表的革兰氏阳性菌可能是该区域农田土壤的主要PAHs降解微生物。
微生物降解是土壤PAHs消减的主要机制,以分支杆菌为代表的PAHs降解细菌[26-27]已被用于污染土壤的生物强化修复。但是,微生物的降解能力受到包括土壤特性在内的多种因素制约[28],不适宜的环境条件可能影响微生物强化等修复策略的效果。本研究的意义在于考察PAHs污染对农田细菌群落的影响,主要揭示了自然污染状态下PAHs降解细菌的富集,这些微生物可能较为适应该冶炼企业周边污染农田的条件,在污染物降解中具有潜在作用。这些结果将为实施污染土壤生物修复提供重要的科学依据。
[1] 傅家谟, 盛国英. 环境有机地球化学初探[J]. 地学前缘, 1996, 3(1-2): 127-132
Fu J M, Sheng G Y. Preliminary study on environmental organic geochemistry [J]. Earth Science Frontiers, 1996, 3(1-2): 127-132 (in Chinese)
[2] 田靖, 朱媛媛, 杨洪彪, 等. 大型钢铁厂及其周边土壤多环芳烃污染现状调查、评价与源解析[J]. 环境化学, 2013, 32(6): 1002-1008
Tian J, Zhu Y Y, Yang H B, et al. Investigation, assessment and source analysis of polycyclic aromatic hydrocarbons (PAHs) pollution in soil from a large iron and steel plant and its surrounding areas in China [J]. Environmental Chemistry, 2013, 32(6): 1002-1008 (in Chinese)
[3] 葛成军, 安琼, 董元华, 等. 南京某地农业土壤中有机污染分布状况研究[J]. 长江流域资源与环境, 2006, 15(3): 361-365
Ge C J, An Q, Dong Y H, et al. Distribution of organic pollutants in agricultural soil in Nanjing City [J]. Resources and Environment in the Yangtze Basin, 2006, 15(3): 361-365 (in Chinese)
[4] Sverdrup L E, Nielsen T, Krogh P H. Soil ecotoxicity of polycyclic aromatic hydrocarbons in relation to soil sorption, lipophilicity, and water solubility [J]. Environmental Science & Technology, 2002, 36(11): 2429-2435
[5] Maliszewska-Kordybach B, Smreczak B. Ecotoxicological activity of soils polluted with polycyclic aromatic hydrocarbons (PAHs) - effect on plants [J]. Environmental Technology, 2000, 21(10): 1099-1110
[6] Sverdrup L E, Ekelund F, Kroghet P H, et al. Soil microbial toxicity of eight polycyclic aromatic compounds: Effects on nitrification, the genetic diversity of bacteria, and the total number of protozoans [J]. Environmental Toxicology and Chemistry, 2002, 21(8): 1644-1650
[7] Sawulski P, Clipson N, Doyle E. Effects of polycyclic aromatic hydrocarbons on microbial community structure and PAH ring hydroxylating dioxygenase gene abundance in soil [J]. Biodegradation, 2014, 25(6): 835-847
[8] de Menezes A, Clipson N, Doyle E. Comparative metatranscriptomics reveals widespread community responses during phenanthrene degradation in soil [J]. Environmental Microbiology, 2012, 14(9): 2577-2588
[9] Fuchs G, Boll M, Heider J. Microbial degradation of aromatic compounds - from one strategy to four [J]. Nature Reviews Microbiology, 2011, 9(11): 803-816
[10] Mukherjee S, Juottonen H, Siivonen P, et al. Spatial patterns of microbial diversity and activity in an aged creosote-contaminated site [J]. The ISME Journal, 2014, 8(10): 2131-2142
[11] 彭晓春, 吴彦瑜, 谢莉. 广东省医疗废物焚烧厂周围土壤多环芳烃特性[J]. 中国环境科学, 2013, 33(S1): 108-122
Peng X C, Wu Y Y, Xie L. Distribution characteristics of polycyclic aromatic hydrocarbons (PAHs) around medical waste incineration plant in Guangdong Province [J]. China Environmental Science, 2013, 33(S1): 108-122 (in Chinese)
[12] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 107-190
[13] Cébron A, Norini M-P, Beguiristain T, et al. Real-time PCR quantification of PAH-ring hydroxylating dioxygenase (PAH-RHDα) genes from gram positive and gram negative bacteria in soil and sediment samples [J]. Journal of Microbiological Methods, 2008, 73(2): 148-159
[15] Yunker M B, Macdonald R W, Vingarzan R, et al. PAHs in the Fraser River basin: A critical appraisal of PAH ratios as indicators of PAH source and composition [J]. Organic Geochemistry, 2002, 33(4): 489-515
[16] Zeng J, Lin X G, Zhang J, et al. Isolation of polycyclic aromatic hydrocarbons (PAHs)-degrading Mycobacterium spp. and the degradation in soil [J]. Journal of Hazardous Materials, 2010, 183(1-3): 718-723
[17] Sun G D, Xu Y, Liu Y, et al. Microbial community dynamics of soil mesocosms using Orychophragmus violaceus combined with Rhodococcus ruber Em1 for bioremediation of highly PAH-contaminated soil [J]. Applied Microbiology and Biotechnology, 2014, 98(24): 10243-10253
[18] Subramanian A, Menon S. Novel polyaromatic hydrocarbon (PAH) degraders from oil contaminated soil samples [J]. International Journal of Advanced Research, 2015, 3(7): 999-1006
[19] Saito A, Iwabuchi T, Harayama S. A novel phenanthrene dioxygenase from Nocardioides sp. strain KP7: Expression in Escherichia coli [J]. Journal of Bacteriology, 2000, 182(8): 2134-2141
[20] Bengtsson G, Törneman N, De Lipthay J R, et al. Microbial diversity and PAH catabolic genes tracking spatial heterogeneity of PAH concentrations [J]. Microbial Ecology, 2013, 65(1): 91-100
[21] 刘增俊, 滕应, 黄标, 等. 长江三角洲典型地区农田土壤多环芳烃分布特征与源解析[J]. 土壤学报, 2010, 47(6): 1110-1117
Liu Z J, Teng Y, Huang B, et al. Distribution and sources analysis of PAHs in farmland soils in areas typical of the Yangtze River Delta, China [J]. Acta Pedologica Sinica, 2010, 47(6): 1110-1117 (in Chinese)
[22] Ping L F, Luo Y M, Zhang H B, et al. Distribution of polycyclic aromatic hydrocarbons in thirty typical soil profiles in the Yangtze River Delta Region, East China [J]. Environmental Pollution, 2007, 147(2): 358-365
[23] Alexander M. Aging, bioavailability, and overestimation of risk from environmental pollutants [J]. Environmental Science & Technology, 2000, 34(20): 4259-4265
[24] Chen S C, Peng J J, Duan G L. Enrichment of functional microbes and genes during pyrene degradation in two different soils [J]. Journal of Soils and Sediments, 2015, 16(2): 417-426
[25] Kweon O, Kim S J, Baek S, et al. A new classification system for bacterial Rieske non-heme iron aromatic ring-hydroxylating oxygenases [J]. BMC Biochemistry, 2008, 9(1): 11
[26] Li X, Hou L, Liu M, et al. Abundance and diversity of polycyclic aromatic hydrocarbon degradation bacteria in urban roadside soils in Shanghai [J]. Applied Microbiology and Biotechnology, 2015, 99(8): 3639-3649
[27] Leys N M, Ryngaert A, Bastiaens L, et al. Occurrence and community composition of fast-growing Mycobacterium in soils contaminated with polycyclic aromatic hydrocarbons [J]. FEMS Microbiology Ecology, 2005, 51(3): 375-388
[28] Bogan B W, Sullivan W R. Physicochemical soil parameters affecting sequestration and mycobacterial biodegradation of polycyclic aromatic hydrocarbons in soil [J]. Chemosphere, 2003, 52(10): 1717-1726
◆
Polycyclic Aromatic Hydrocarbons (PAHs) Pollution and Their Effects on Bacterial Community in Agricultural Soils Near a Smelting Plant
Wu Yucheng1,2, Lin Xiangui1,2,*, Zhu Qinghe1,2, Zeng Jun1,2, Ding Qingmin1,2
1. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China 2. Joint Open Laboratory of Soil and the Environment, Institute of Soil Science, Chinese Academy of Sciences and Hong Kong Baptist University, Nanjing 210008, China
Polycyclic aromatic hydrocarbons (PAHs) are a group of persistent organic pollutants that may pose significant risks on soil biota. In this study, 17 soil samples were collected from agricultural sites potentially polluted by a smelting plant in the outskirt of Nanjing, Jiangsu Province. The distances of the sampling sites to the potential PAHs source ranged from 500 m to 5 km. The total amounts of 15 PAHs (Σ15PAHs) in these samples ranged from 0.25~31.08 mg·kg-1, with most contaminated samples (> 1 mg·kg-1) found in closely adjacent sites to the plant. High molecular weight PAHs (≥ 4 rings) were dominant in most samples. PAH diagnostic ratios suggested these PAHs were largely related to coal and fossil fuel combustion. To reveal the bacterial community composition, 16S rRNA gene was amplified and analyzed using next generation sequencing. The Illumina’s MiSeq sequencing produced more than 225 000 reads, with averagely 13 257 reads obtained for each sample. The most abundant phyla across all samples were Proteobacteria, Bacteroidetes, Actinobacteria and Acidobacteria. Bacterial alpha diversity, as measured by observed species, Chao1, Phylogenetic Diversity (PD), Shannon and Simpson indices, were directly correlated to pH rather than PAHs. An ordination analysis indicated that the bacterial community composition was significantly influenced by pH and total phosphorus, while the contribution of PAHs was minimal. However, the PAHs levels were positively correlated to the relative abundance of a few potential PAHs degraders such as Mycobacterium, Rhodococcus, Actinomadura and Nocardioides. This trend was further confirmed by the quantitative PCR (qPCR) quantification of bacterial PAH ring-hydroxylating dioxygenase genes (PAH-RHDα). Although the gram negative (GN) bacterial PAH-RHDα gene abundance was below the detectable level, gram positive (GP) PAH-RHDα was recovered from all samples and its abundance was positively correlated with the PAHs pollution. The GP PAH-RHDα gene in three selected samples affiliated to the nidA3/fadA1 group, and their closest matches in Genbank were largely derived from Mycobacterium. Overall, these findings indicate the influence of industrial PAHs emission on the adjacent agricultural soils. The PAHs pollution may cause the enrichment of specific PAHs degraders such as Mycobacterium, although soil pH could be more significant in shaping total community of soil bacteria.
polycyclic aromatic hydrocarbons; soil bacteria; PAH-ring hydroxylating dioxygenase; Mycobacterium; community effect
10.7524/AJE.1673-5897.20151026001
国家重点基础研究发展计划(973计划)(2014CB441106);国家自然科学基金(41371310,41201301);江苏省自然科学基金(BK20131462);土壤与农业可持续发展国家重点实验室优秀青年人才项目(Y212000014)
吴宇澄(1977-),男,副研究员,研究方向为污染土壤生物修复及污染生态学,E-mail: ycwu@issas.ac.cn
*通讯作者(Corresponding author), E-mail: xglin@issas.ac.cn
2015-10-26 录用日期:2015-11-16
1673-5897(2016)2-484-08
Q142;X53
A
简介:林先贵(1955-),男,研究员,博士生导师。主要研究方向土壤微生物多样性及其生态功能、环境微生物及其应用,发表学术论文300余篇。
吴宇澄, 林先贵, 朱清禾, 等. 冶炼企业周边农田土壤的多环芳烃污染及其细菌群落效应[J]. 生态毒理学报,2016, 11(2): 484-491
Wu Y C, Lin X G, Zhu Q H, et al. Polycyclic aromatic hydrocarbons (PAHs) pollution and their effects on bacterial community in agricultural soils near a smelting plant [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 484-491 (in Chinese)

