环渤海近岸海域表层沉积物及底栖生物中PBDEs的赋存特征及富集行为
姚文君,薛文平,国文,徐恒振,林忠胜,姚子伟,马新东,*
1. 大连工业大学轻工与化学工程学院,大连 116034 2. 国家海洋环境监测中心国家海洋局近岸海域生态环境重点实验室,大连 116023
环渤海近岸海域表层沉积物及底栖生物中PBDEs的赋存特征及富集行为
姚文君1,2,薛文平1,国文1,徐恒振2,林忠胜2,姚子伟2,马新东2,*
1. 大连工业大学轻工与化学工程学院,大连 116034 2. 国家海洋环境监测中心国家海洋局近岸海域生态环境重点实验室,大连 116023
多溴联苯醚(PBDEs)作为一种新型的持久性有机污染物,在海洋环境中广泛存在,研究PBDEs在不同介质中的赋存状态对于理解其环境行为及归趋具有重要的意义。通过采集不同区域沉积物及生物样品,考察了PBDEs在环渤海近岸海域表层沉积物及底栖生物中的含量及空间分布特征、污染模式及生物-沉积物富集因子。结果表明,环渤海沿岸表层沉积物中PBDEs总量(Σ10PBDEs)的浓度范围在0.446~26.8 ng·g-1(干重,dw)之间,中值为1.02 ng·g-1(dw),底栖生物中PBDEs(Σ9PBDEs)的浓度范围为0.053~9.90 ng·g-1(dw),中值为1.25 ng·g-1dw;沉积物中BDE-209为最主要的单体,平均丰度达到90.5%,生物体中主要以低溴代BDEs为主,其中单体BDE-47的含量最高,平均丰度范围为43.2%~49.7%;沉积物和生物中PBDEs的含量在空间上存在显著的差异,其中莱州湾和锦州附近区域的结果明显高于其他区域;5种不同的底栖生物对PBDEs均表现出一定的生物富集性,其中∑9PBDEs的BSAF值按从大到小的顺序为菲律宾蛤仔(0.43~4.06, mean=1.19) > 紫贻贝(0.34~2.86, 1.03) > 四角蛤蜊(0.17~1.95, 0.82) > 麻蛤(0.13~2.33, 0.61) > 牡蛎(0.09~1.20, 0.52)。辛醇水分配系数(logKOW)与不同物种BSAF值的相关性分析结果表明,除BDE-17单体外,其他单体的BSAF值表现出随logKOW的升高而下降的趋势。
PBDEs;底栖生物;BSAF;渤海;表层沉积物
Received 30 November 2015 accepted 13 January 2016
多溴联苯醚(polybrominated diphenyl ethers,PBDEs)是一类典型的溴代阻燃剂,由于其良好的阻燃效果及较低的经济成本,被广泛地应用于塑料制品、纺织品、电路板和建筑材料等领域[1]。PBDEs具有典型的持久性有机污染物(persistent organic pollutants, POPs)特征[2],2009年5月在瑞士日内瓦举行的斯德哥尔摩公约缔约方大会第四届会议上,已通过了将商用五溴(Penta-BDEs)和八溴联苯醚(Octa-BDEs)列入公约附件A的决议[3]。
中国是溴代阻燃剂最大的生产和使用国之一[4],有关PBDEs在不同环境介质中的赋存状态研究已经引起越来越多的关注[5-7],而位于我国南方的珠三角地区以及电子垃圾拆卸地及附近区域的污染尤为明显[8-9]。比如,Luo等[10]报道的广东贵屿(典型电子垃圾拆卸地)地区河流沉积物中PBDEs的浓度高达9 400 ng·g-1(dry weight, dw),Wu等[6]报道的珠江流域水体中生物的含量最高达到1 702 ng·g-1(wet weight,ww)。与南方地区相比,我国北方地区PBDEs的研究报道相对较少,并且整体的污染水平相对较低[11-12]。
渤海是我国北方最大的半封闭式内海,海水的交换能力较弱,并且环渤海经济圈是我国北方最大的经济发展区域,巨大的产业经济及人口规模为渤海的环境质量带来较大的压力[13]。此外,位于山东半岛的莱州湾经济带是我国最大的溴代阻燃剂生产基地,这进一步增加了渤海海域PBDEs的污染压力[14]。本文以渤海10个典型城市为研究区域,系统研究PBDEs在沉积物和底栖类生物体中的赋存状态及生物-沉积物富集行为,为我国北方典型近岸海域新型持久性有机污染物的环境行为及归趋提供基础性数据。
1 样品采集与分析(Samples collection and analysis)
1.1 样品采集与预处理
环渤海近岸海域表层沉积物和底栖生物样品分别采自2012年和2011—2013年,具体采样站位如图1所示。其中,表层沉积物采用抓斗式采样器采集,取样深度为0~5 cm,样品采集后采用铝箔纸包裹,装入密封袋后于4 ℃冰箱冷藏保存。生物样品采用拖网式方式采集,样品包括紫贻贝(Mytilus edulis, ME)、四角蛤蜊(Mactra veneriformis, MV)、麻蛤(Anadara subcrenata, AS)、牡蛎(Ostrea gigas Thunberg, OGT)和菲律宾蛤仔(Ruditapes philippinarum, RP),其中部分城市牡蛎样品采用购置的方式取自当地小型渔船。采集后的生物样用铝箔包裹,装在密封的聚乙烯袋中,存放在4 ℃冰箱冷藏保存。样品送达实验室后,立即存于-20 ℃冰箱冷冻,冷冻干燥后研磨,将粉末置于棕色玻璃瓶内避光保存,待分析。
1.2 仪器与试剂
农残级正己烷、二氯甲烷、丙酮、异辛烷购自Tedia(ABSOLV, USA);硅胶(0.063~0.100 mm)购自Merck公司(分析纯,德国),使用前采用二氯甲烷进行索式提取去除杂质干扰,并在马弗炉中于450 ℃烘制4 h,备用;硫酸、盐酸为优级纯;铜粉(63 μm)使用前盐酸清洗3次,然后依次用去离子水、丙酮和正己烷洗至中性,通风厨内阴干待用。PBDEs混合标样(包含BDE-17、28、47、85、99、100、153、154、183, IUPAC命名)和BDE-209单标均购自美国Accustandards公司。同位素标记替代内标(13C-HCH, 100 ng·mL-1溶于壬烷,纯度99%)和同位素标记进样内标(68A-IS,13C-PCB-138, 100 ng·mL-1)购自Wellington公司。
实验仪器包括Agilent 6890/5973i气相色谱-质谱联用仪(ECNI电离源)配7683B自动进样器进样器;加速溶剂萃取仪(ASE350, Dionex, USA);Heidolph旋转蒸发仪(Hei-VAP, 德国);凝胶渗透色谱仪(J2 Scientific, USA);总有机碳分析仪(Vario TOC cube, Elementar Co. Ltd, GER)。
1.3 样品提取与净化
分别准确称取15.0 g沉积物和3.0 g生物干样,与硅藻土研磨混匀后装入萃取池中,精确加入10 μL13C标记提取内标,用体积比为1:1的正己烷和二氯甲烷混合液进行加速溶剂萃取。萃取温度100 ℃,加热时间5 min,静态时间10 min,循环3次,冲洗体积60%,吹扫时间60 s。沉积物样品提取液过无水硫酸钠小柱,加盐酸处理过的铜粉除硫;生物样品提取液直接转入洁净的烧瓶中,加入一定量(视有机相的透明度而定)的酸性硅胶,磁力搅拌约0.5 h,去除脂肪等大分子杂质。所有萃取液最后浓缩至2.0 mL左右,转入复合层析柱净化(内径1.0 cm),复合层析柱采用干样法自行填装,从下到上依次为1.0 g活化硅胶、4.0 g碱性硅胶、1.0 g活化硅胶、8.0 g酸性硅胶、1.0 g活化硅胶、2.0 g AgNO3硅胶和4.0 g无水硫酸钠。用50 mL正己烷活化复合硅胶柱,上样后先用70 mL正己烷淋洗,淋洗液弃去,再用100 mL二氯甲烷/正己烷(V/V = 1:1)淋洗,收集淋洗液并旋转蒸发至1 mL左右。将浓缩液转移至K-D管,用高纯氮气吹至200 μL,再转移至内衬管中并进一步氮吹至10 μL,加入10 μL13C-PCB-138进样内标,待测。
1.4 质量控制与保证(QA/QC)
实验室分析的全过程实施严格的质量控制程序。所有容器在使用前均用二氯甲烷进行清洗;样品定量采用同位素稀释内标法定量,并对每个样品的前处理过程进行跟踪和加标回收率测定,所有样品替代内标回收率的范围在52.5%~99.4%之间,满足EPA 1614的方法要求。方法的定量限以10倍的最低标准系列浓度值测地的标准偏差(5次平行测定)定义,该方法的定量限为0.1 (BDE-17)~0.5 (BDE-183) pg·g-1,BDE-209的方法定量限为5.0 pg·g-1。每10个样品为一组进行空白加标平行试验,结果显示,所有空白试验PBDEs单体的浓度值均低于方法定量限。
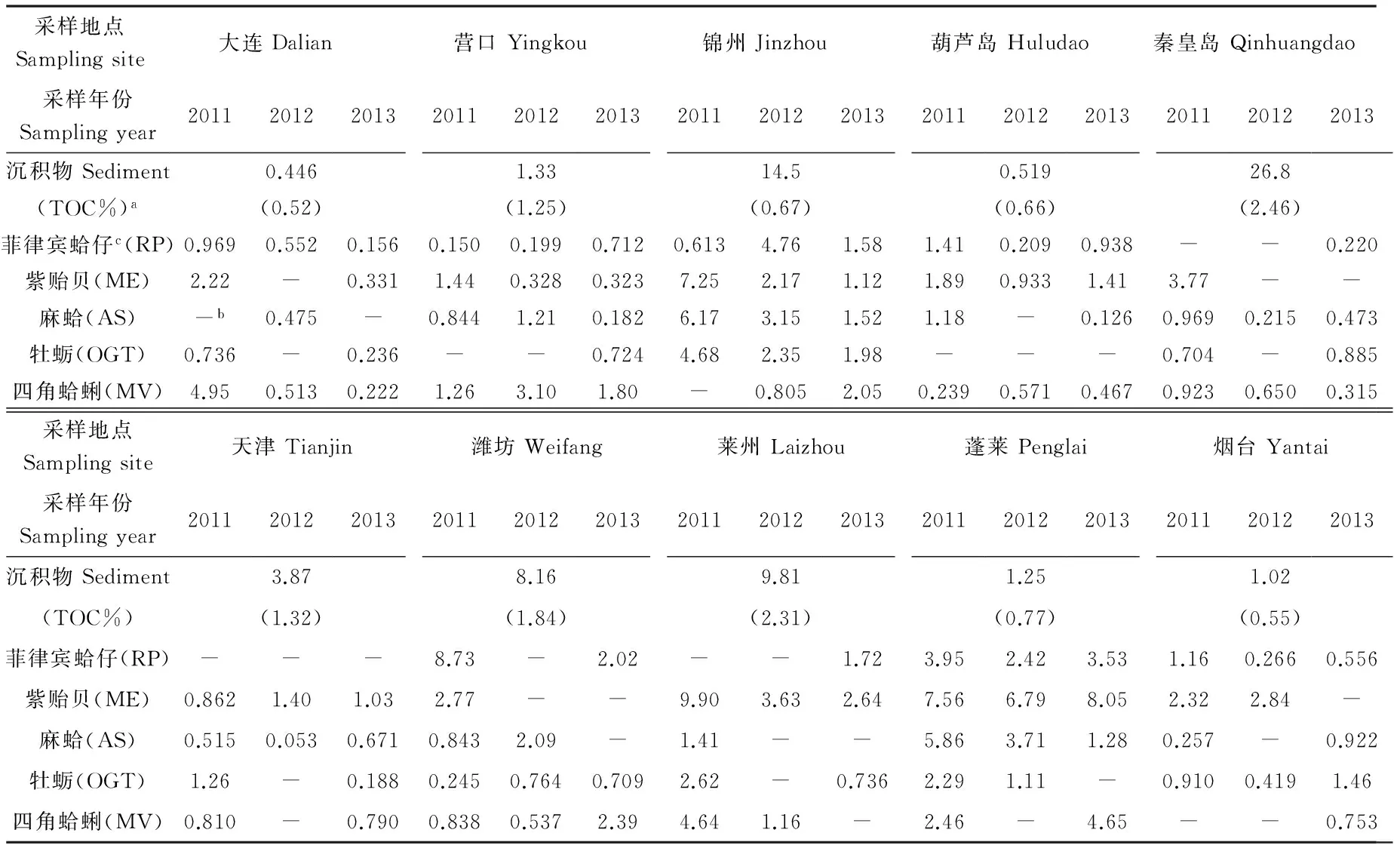
表1 不同生物及沉积物中PBDEs含量的统计结果(ng·g-1, dw)
注:a括号内为沉积物的总有机碳含量(%);b“-”代表生物样品未采集;c生物的脂肪含量范围:菲蛤(6.9%~10.2%, mean = 7.7%);紫贻贝(9.2%~16.4%, 13.49%);麻蛤(8.3%~15.2%, 10.2%);牡蛎(6.4%~10.7%, 8.2%);四角蛤蜊(9.9~15.7%, 12.9%)。
Note:aTOC of sediment in parentheses (%);b‘-’ represent the benthic organisms sample is not collected;cthe range of biological fat content: RP (6.9%-10.2%, mean = 7.7%); ME(9.2%-16.4%, 13.49%); AS(8.3%-15.2%, 10.2%); OGT(6.4%-10.7%, 8.2%); MV(9.9%-15.7%, 12.9%).
1.5 其他参数测定及数据处理
沉积物TOC采用高温燃烧法使用总有机碳分析仪(Elementar Vario TOC Cube)测定,生物脂质含量采用重量减差法测定;文中统计分析P值小于0.05则认为数据之间相关性显著;所有分析主要采用Origin 8.5 (OriginLab Inc., USA)、SPSS 17.0 (SPSS Inc., USA)和ArcGIS10.3 (ESRIInc., USA)软件完成。
2 结果与讨论(Results and discussion)
2.1 PBDEs的含量水平
渤海近岸表层沉积物及对应区域底栖生物样品中的PBDEs的统计结果如表1所示。其中,沉积物中低溴代BDEs (Σ9PBDEs, BDE-209除外)的浓度范围在0.046~2.16 ng·g-1(dw),中值为0.21 ng·g-1(dw),单体BDE-209的含量范围为0.35~24.6 ng·g-1(dw),中值为3.87 ng·g-1(dw);底栖类生物体中Σ9PBDEs的浓度范围为0.053~9.90 ng·g-1(dw),中值为1.25 ng·g-1(dw)。与国内研究结果相比,渤海近岸海域沉积物中∑9PBDEs的含量水平与南海北部(9PBDEs: 0.04~4.48 ng·g-1dw,平均值为0.46 ng·g-1dw)[15]及黄海(7PBDEs: 0.064~0.81 ng·g-1dw,平均值为0.25 ng·g-1dw)[16]相当,但明显的低于我国珠江口地区(9PBDEs: 0.33~21.8 ng·g-1dw,平均值为3.13 ng·g-1dw)[15],该结果同样显著低于欧洲和北美等发达国家地区[17-19];此外,生物体中∑9PBDEs的含量显著低于珠江流域生物体内PBDEs的浓度水平(57.2~1 702 ng·g-1, ww)[6],这说明渤海地区PBDEs的使用量和整体污染水平相比于我国珠江三角洲地区以及国外发达国家地区相对较低。
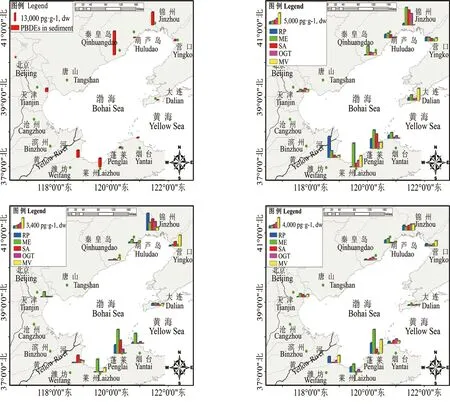
图1 环渤海地区沉积物和生物体中PBDEs的空间分布图 注:a. 沉积物;b. 2011年生物;c. 2012年生物;d. 2013年生物。RP、ME、AS、OGT、MV分别为菲律宾蛤仔、紫贻贝、麻蛤、牡蛎和四角蛤蜊。Fig. 1 Spatial distributions of PBDEs in sediment and organisms around the Bohai Sea Note: a. Sediments; b. Benthic organisms collected in 2011; c. Benthic organisms collected in 2012; d. Benthic organisms collected in 2013. RP: Ruditapes philippinarum, ME: Mytilus edulis, AS: Anadara subcrenata, OGT: Ostrea gigas Thunberg, MV: Mactra veneriformis.
对比不同物种间的浓度发现,紫贻贝中PBDEs的含量明显高于其他物种(表1),说明不同物种间的生物富集能力存在一定的差异,该结果与刘汉霞[20]报道的结果一致。此外,沉积物中∑10PBDEs的含量与TOC之间表现出显著的相关性(R2= 0.50, P < 0.01),说明有机质含量是影响PBDEs在渤海表层沉积物中分布的一个主要因子[15],同样,生物体中∑9PBDEs的含量与脂肪含量也表现出显著的相关性(R2= 0.38, P < 0.05),说明脂肪含量是影响PBDEs在底栖生物体内分布的一个主要因子[6]。需要指出的是,沉积物中∑9PBDEs的含量与生物体中的平均浓度同样表现出显著的相关性(R2= 0.55, P < 0.05),说明沉积环境的暴露水平同样是影响生物体中PBDEs含量赋存程度的一个主要因素[21]。
2.2 PBDEs的空间分布特征
环渤海地区沉积物Σ10PBDEs与生物体中Σ9PBDEs的空间分布如图1所示。结果显示,该地区PBDEs的分布在空间上表现出显著的差异(图1 a),该结果整体上与Wang等[11]2009年报道的结果一致。需要指出的是,秦皇岛沿岸沉积物中BDE-209的含量(2.68 ng·g-1, dw)相对于2008年(相同站位)的含量显著偏低(2 776 ng·g-1, dw)[11],说明该区域随着地方整治项目的推进,PBDEs的河流输入量可能存在明显的降低[22];而莱州和潍坊地区入海沉积物中PBDEs尤其是BDE-209含量整体偏高的原因可能主要由局部污染源排放所致。根据Jin等[14]的报道,该区域是我国北方最主要的溴代阻燃剂生产基地。需要指出的是,辽东湾锦州附近海域沉积物中PBDEs的浓度整体偏高,表明该区域可能同样存在PBDEs的生产和使用,相关更为有力的证据有待进一步的研究。
图1 b~图1 d的结果显示,环渤海地区不同种类生物体中PBDEs的含量同样存在空间上的差异,其中位于莱州湾和锦州湾地区生物体中Σ9PBDEs的含量整体偏高,这与沉积物中的分布特征整体类似,也进一步说明底栖类生物的摄食习性以及栖息环境的污染物暴露水平是影响生物体中PBDEs含量赋存的一个主要因素[21]。与沉积物的分布特征略有不同的是,蓬莱地区生物体中的含量明显高于其他地区,分析原因可能是受海流(绕岸流)的影响[23],低溴代联苯醚更容易迁移到蓬莱附近海域,这也是为什么蓬莱地区PBDEs总量偏低,但低溴代联苯醚(Σ9PBDEs: 0.40 ng·g-1, dw)整体上与潍坊(0.57 ng·g-1, dw)和莱州(0.60 ng·g-1,dw)差异不显著的一个主要原因,该结果也进一步说明BDE-209的迁移能力较弱,更易随着悬浮颗粒物的吸附而沉降[4]。
2.3 PBDEs同系物分布特征
环渤海表层沉积物中BDE-209是最主要的单体,平均丰度达到90.5%,说明该地区十溴代联苯醚商品是最主要的使用产品[14],这与Deca-BDEs是我国最主要使用的溴代阻燃剂的事实相符[23]。除BDE-209单体外,低溴代BDEs单体的组成模式主要以3~6溴代为主,其中丰度最高的为4Br-BDEs (40.2%),其次为5Br-BDEs (24.9%)和3Br-BDEs (17.7%),该结果与Zhao等[12]报道的辽河口地区沉积物中PBDEs的组成模式相似。根据Law等[24]和Hites[25]的报道,商品化Octa-BDE产品主要以BDE-183为主(> 40%),而Penta-PBDE产品中主要以4Br-BDE和5Br-BDE为主(二者含量之和大于90%)。根据Jin等[14]的报道,莱州湾海域生产的PBDEs主要为Deca-BDEs为主,而有关低溴代联苯醚的生产未见相关报道,本研究中,低溴代联苯醚的整体比例小于10%,另外,沉积物中低溴代联苯醚的浓度水平较2009年之前(禁用)并未表现出明显的降低[11],说明环渤海地区低溴代BDEs可能主要来自Deca-BDEs的降解[4,26]。
与沉积物中PBDEs的同系物模式不同,生物体中BDE-209的检出率较低,分析原因一方面是由于BDE-209的分子量较高,细胞膜通过性较低[11],而另一个主要原因可能是生物对高溴代的BDE单体存在生物代谢和生物转化作用,进而导致生物对高溴代PBDE单体的富集作用相对较弱[11]。生物体低溴代联苯醚的单体分布特征与沉积物相似,同样以4Br-BDEs的丰度为最高,其中单体最高的BDE-47的范围为43.2%~49.7%,该结果与大量的研究报道一致[27-29]。低溴代BDEs的同系物特征与沉积物略有不同的是,3Br-BDE (BDE-28)的相对丰度略高于沉积物,这是由于高溴代BDE单体在生物体内的降解和转化所致[30-31],该结果同样与其他的报道相类似[11,27-29,32-33]。
2.4 生物沉积物富集因子
生物-沉积物富集因子(BSAF)的计算公式为:BSAF = Cm/Cs,其中Cm和Cs分别代表生物体内PBDEs的脂肪归一化浓度(pg·g-1, lw)和沉积物中PBDEs的总有机碳归一化浓度(pg·g-1TOC)。计算结果表明,5种不同的底栖生物对PBDEs均表现生物富集性,但不同的生物的富集能力不同,其中∑9PBDEs的BSAF值按从大到小的顺序为RP(0.43~4.06, mean = 1.19) > ME(0.34~2.86, 1.03) > MV(0.17~1.95, 0.82) > AS(0.13~2.33, 0.61) > OGT(0.09~1.20, 0.52)。造成这种物种间富集能力差异的原因主要是由于生物个体的差别以及不同的生活习性[34],该结果与Wang等[11]报道的结果相比偏低,分析原因主要是由于BSAF计算方法的不同所致(Wang等直接采用干重含量比值的方法计算)。

图2 沉积物及不同生物体中PBDEs的同系物分布特征Fig. 2 Congener patterns of PBDEs in sediment and different organisms
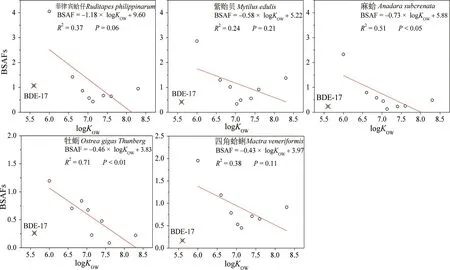
图3 不同生物体中PBDE单体的BSAF值与logKOW的相关关系(BDE-17单体除外)Fig. 3 Relations of BSAF of individual PBDE congener and logKOW in different organisms
辛醇水分配系数是描述不同PBDE单体在生物体内富集行为一个重要参数[11],He等[35]的研究发现,鱼体中PBDEs不同单体的BSAF值随logKOW的升高呈先升高后降低的趋势,Wang等[11]的研究发现,紫贻贝中各单体的BSAF值随logKOW的升高呈下降的趋势,造成2种变化趋势的原因可能与不同物种的生活习性有关。本研究中,除BDE-17单体外,不同物种的各单体的BSAF值随logKOW的升高而下降的趋势更为明显(图3所示),该结果与Wang等[11]报道的结果更为接近,说明底栖类生物体对低溴代BDEs具有较强的代谢能力外[36],沉积物中有机质相对于生物体的竞争吸附也是影响高溴代BDEs的富集行为的一个重要因素[37]。
综上可知:环渤海不同地区沉积物和底栖类生物体中PBDEs的含量水平相对于我国南方地区及国外发达地区整体偏低,并且表现出明显的空间差异,其中位于莱州湾和锦州附近区域的结果整体高于其他区域,PBDEs的同系物分布特征表明,环渤海地区低溴代BDEs的来源可能主要来自Deca-BDEs的降解;底栖类生物对PBDEs具有明显的富集特征,并且受理化性质等多种因素的影响,不同生物的BSAF值整体上表现出随logKOW升高而下降的趋势。
[1] Alaee M, Arias P, Sjödin A, et al. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release [J]. Environment International, 2003, 29(6): 683-689
[2] Eljarrat E, Feo M L, Barceló D. Degradation of Brominated Flame Retardants [M]//Brominated Flame Retardants. Berlin: Springer Berlin Heidelberg, 2011: 187-202
[3] United Nations Environment Programme (UNEP). Conference of the Parties of the 97 Stockholm Convention on Persistent Organic Pollutants Fourth Meeting (POPS/COP4/1) [R]. Geneva,Switzerland: POPs Review Committee, 2009
[4] Mai B X, Chen S J, Luo X J, et al. Distribution of polybrominated diphenyl ethers in sediments of the Pearl River Delta and Adjacent South China Sea [J]. Environmental Science and Technology, 2005, 39(10): 3521-3527
[5] 王亚韡, 蔡亚岐, 江桂斌. 斯德哥尔摩公约新增持久性有机污染物的一些研究进展[J]. 中国科学: 化学, 2010,40(2): 99-123
[6] Wu J P, Luo X J, Zhang Y, et al. Bioaccumulation of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in wild aquatic species from an electronic waste (e-waste) recycling site in South China [J]. Environment International, 2008, 34(8): 1109-1113
[7] Chen S J, Feng A H, He M J, et al. Current levels and composition profiles of PBDEs and alternative flame retardants in surface sediments from the Pearl River Delta,Southern China: Comparison with historical data [J].Science of the Total Environment, 2013, 444(2): 205-211
[8] Xiang C H, Luo X J, Chen S J, et al. Polybrominated diphenyl ethers in biota and sediments of the Pearl River Estuary, South China [J]. Environmental Toxicology and Chemistry, 2007, 26(4): 616-623
[9] Labunska I, Harrad H, Wang M J, et al. Human dietary exposure to PBDEs around e-waste recycling sites in Eastern China [J]. Environmental Science and Technology, 2014, 48(10): 5555-5564
[10] Luo Q, Cai Z W, Wong M H. Polybrominated diphenyl ethers in fish and sediment from river polluted by electronic waste [J]. Science of the Total Environment, 2007, 383(1-3): 115-127
[11] Wang Z, Ma X D, Lin Z S, et al. Congener specific distributions of polybrominated diphenyl ethers (PBDEs) in sediment and mussel (Mytilus edulis) of the Bo Sea, China [J]. Chemosphere, 2009, 74(7): 896-901
[12] Zhao X F, Zhang H J, Ni Y W, et al. Polybrominated diphenyl ethers in sediments of the Daliao River Estuary,China: Levels, distribution and their influencing factors [J]. Chemosphere, 2011, 82(9): 1262-1267
[13] 陈晨, 马新东, 国文, 等. 辽河口海域短链氯化石蜡污染特征及生物富集[J]. 科学通报, 2014, 59(7): 578-585
Chen C, Ma X D, Guo W, et al. Congener specific distribution and bioaccumulation of short-chain chlorinated paraffins in Liao Estuary [J]. Chinese Science Bulletin, 2014, 59(7): 578-585 (in Chinese)
[14] Jin J, Liu W Z, Wang Y, et al. Levels and distribution of polybrominated diphenyl ethers in plant, shellfish and sediment samples from Laizhou Bay in China [J]. Chemosphere, 2008, 71(6): 1043-1050
[15] 陈社军, 麦碧娴, 曾永平, 等. 珠江三角洲及南海北部海域表层沉积物中多溴联苯醚的分布特征[J]. 环境科学学报, 2005, 25(9): 1265-1271
Chen S J, Mai B X, Zeng Y P, et al. Polybrominated diphenyl ethers (PBDEs) in surficial sediments of the Pearl River Delta and adjacent South China Sea [J]. Acta Scientiae Circumstantiae, 2005, 25(9): 1265-1271 (in Chinese)
[16] Wang G G, Peng J L, Xu X, et al. Polybrominated diphenyl ethers in sediments from the Southern Yellow Sea: Concentration, composition profile, source identification and mass inventory [J]. Chemosphere, 2016, 144: 2097-2105
[17] Allchin C R, Law R J, Morris S. Polybrominated diphenylethers in sediments and biota downstream of potential sources in the UK [J]. Environmental Pollution, 1999, 105(2): 197-207
[18] Sílvia L, Míriam G, Elena M, et al. Occurrence and specific congener profile of 40 polybrominated diphenyl ethers in river and coastal sediments from Portugal [J]. Environmental Science and Technology, 2003, 37(5): 892-898
[19] Eljarrat E, Dela C A, Raldua D, et al. Occurrence and bioavailability of polybrominated diphenyl ethers and hexabromocyclododecane in sediment and fish from the Cinca River, a tributary of the Ebro River (Spain) [J]. Environmental Science and Technology, 2004, 38(9): 2603-2608
[20] 刘汉霞. 多溴联苯醚的分析方法及其在我国典型区域的分布研究[D]. 北京: 中国科学院大学, 2006
Liu H X. Studies on the analysis method of polybrominated diphenyl ethers and its contamination in selected areas in China [D]. Beijing: University of Chinese Academy of Sciences, 2006 (in Chinese)
[21] Wan Y, Zhang K, Dong Z M, et al. Distribution is a major factor affecting bioaccumulation of decabrominated diphenyl ether: Chinese sturgeon (Acipenser sinensis) as an example [J]. Environmental Science and Technology, 2013, 47(5): 2279-2286
[22] 马新东, 穆景利, 林忠胜, 等. 典型陆源入海排污对邻近海域富营养化及生物毒性的影响[J]. 中国环境监测, 2014, 30(1): 25-30
Ma X D, Mu J L, Lin Z S, et al.The impact of sewage from typical land-based sources on the adjacent marine eutrophication and biological toxicity [J].Environmental Monitoring in China, 2014, 30(1): 25-30 (in Chinese)
[23] Zhang Y, Zhao H D, Zhai W D, et al. Enhanced methane emissions from oil and gas exploration areas to the atmosphere-The central Bohai Sea [J]. Marine Pollution Bulletin, 2014, 81(1): 157-165
[24] Law R J, Allchin C R, Jacob D B, et al. Levels and trends of brominated flame retardants in the European environment [J]. Chemosphere, 2006, 64(2): 187-208
[25] Hites R A. Polybrominated diphenyl ethers in the environment and in people: A Meta-Analysis of concentrations [J]. Environmental Science and Technology, 2004, 38(4): 945-956
[26] Eriksson J, Green N, Marsh G, et al. Photochemical decomposition of 15 polybrominated diphenyl ether congeners in methanol/water [J]. Environmental Science and Technology, 2004, 38(11): 3119-3125
[27] Law R J, Covaci A, Harrad S, et al. Levels and trends of PBDEs and HBCDs in the global environment: Status at the end of 2012 [J]. Environment International, 2014, 65(2): 147-158
[28] 夏斌, 周明莹, 陈碧鹃, 等. 胶州湾养殖区贝类生物体中多溴联苯醚的分布特征[J]. 海洋环境科学, 2010, 29(6): 879-883
Xia B, Zhou M Y, Chen B J, et al. Distribution of polybrominated diphenyl ethers in shellfish species in culture area of Jiaozhou Bay [J]. Marine Environmental Science, 2010, 29(6): 879-883 (in Chinese)
[29] 向彩红, 孟祥周, 陈社军, 等. 鱼肉组织中多溴联苯醚的定量分析[J]. 分析测试学报, 2006, 25(6): 14-18
Xiang C H, Meng X Z, Chen S J, et al. Determination of polybrominated diphenyl ethers in fish tissue [J]. Journal of Instrumental Analysis, 2006, 25(6): 14-18 (in Chinese)
[30] Xu J, Gao Z S, Xian Q M, et al. Levels and distribution of polybrominated diphenyl ethers (PBDEs) in the freshwater environment surrounding a PBDE manufacturing plant in China [J]. Environmental Pollution, 2009, 157(6): 1911-1916
[31] 郭英, 唐洪磊, 孟祥周, 等. 多溴联苯醚在桂花鱼体内的分布[J]. 环境科学, 2007, 28(12): 2806-2810
Guo Y, Tang H L, Meng X Z, et al. Tissue distribution of PBDEs in mandarin fish [J]. Environmental Science, 2007, 28(12): 2806-2810 (in Chinese)
[32] Keum Y S, Li Q X. Reductive debromination of polybrominated diphenylethers by zerovalent iron [J]. Environmental Science and Technology, 2005, 39(7): 2280-2286
[33] Meng X Z, Yu L P, Guo Y, et al. Congener-specific distribution of polybrominated diphenyl ethers in fish of China: Implication for input sources [J]. Environmental Toxicology and Chemistry, 2008, 27(1): 67-72
[34] Xiang C H, Luo X J, Chen S J, et al. Polybrominated diphenyl ethers in biota and sediments of the Pearl River Estuary, South China [J]. Environmental Toxicology and Chemistry, 2007, 26(4): 616-623
[35] He M J, Luo X J, Chen M Y, et al. Bioaccumulation of polybrominated diphenyl ethers and decabromodiphenyl ethane in fish from a river system in a highly industrialized area, South China [J]. Science of the Total Environment, 2012, 419(3): 109-115
[36] Mizukawa K, Takada H, Takeuchi I, et al. Bioconcentration and biomagnification of polybrominated diphenyl ethers (PBDEs) through lower-trophic-level coastal marine food web [J]. Marine Pollution Bulletin, 2009, 58(8): 1217-1224
[37] Moermond C T A, Zwolsman J J G, Koelmans A A, et al. Black carbon and ecological factors affect in situ biota to sediment accumulation factors for hydrophobic organic compounds in flood plain lakes [J]. Environmental Science and Technology, 2005, 39(9): 3101-3109
◆
Occurrence and Bioaccumulation of Polybrominated Diphenyl Ethers(PBDEs)in Surficial Sediment and Benthic Organism in the Bohai Sea
Yao Wenjun1,2, Xue Wenping1, Guo Wen1, Xu Hengzhen2, Lin Zhongsheng2, Yao Ziwei2, Ma Xindong2,*
1. School of Chemistry Engineering & Light Industry, Dalian Polytechnic University, Dalian 116034, China 2. State Oceanic Administration Key Laboratory for Ecological Environment in Coastal Areas, National Marine Environmental Monitoring Center, Dalian 116023, China
As the new type of persistent organic pollutants, polybrominated diphenyl ethers (PBDEs) widely existed in the marine environment. Thereby it is meaningful to investigate the occurrence of PBDEs in different matrixes for understanding the environmental behavior and fate. In present study, the concentration, spatial distribution, congener pattern and bio-sediment accumulation factor were studied by collecting the surface sediments and benthic organisms around the Bohai sea. The results showed that the total concentration of PBDEs (Σ10PBDEs) in surficial sediments ranged from 0.446 to 26.8 ng·g-1(dry weight, dw) with the median value of 1.02 ng·g-1(dw). The Σ9PBDEs in the benthic organisms ranged from 0.053 to 9.90 ng·g-1(dw) with the median of 1.25 ng·g-1(dw). The congener BDE-209 predominated in the surficial sediments with the mean abundance of 90.5%. With a difference, the lowly brominated BDEs was dominated in the benthic organisms, and BDE-47 was the highest congener with the mean abundance of 43.2%~49.7%. The spatial distribution of total PBDEs concentration in sediments and organisms showed a significant difference, which the results around the Laizhou bay and Jinzhou city were significantly higher than those from other areas. The five different species all showed the bioaccumulation and BSAF values of ∑9PBDEs with descending values followed the sequence of Ruditapes philippinarum (0.43~4.06, mean = 1.19) > Mytilus edulis (0.34~2.86, 1.03) > Mactra veneriformis (0.17~1.95, 0.82) >Anadara subcrenata (0.13~2.33, 0.61) > Ostrea gigas Thunberg (0.09~1.20, 0.52). The correlation analysis between octanol-water partition coefficient (logKOW) and BSAFs in different species both showed a decrease trend with the increase of logKOWvalues except the congener BDE-17.
PBDEs; bentonic organism; BSAF; Bohai Sea; surficial sediment
10.7524/AJE.1673-5897.20151130003
国家自然科学基金资助项目(41201491,21577028)
姚文君(1989-),女,硕士研究生,研究方向为有机污染物分析及环境行为,E-mail: 15840861939@163.com;
*通讯作者(Corresponding author), E-mail: xdma@nmemc.org.cn
2015-11-30 录用日期:2016-01-13
1673-5897(2016)2-413-08
X171.5
A
简介:马新东(1980—),男,分析化学博士,副研究员,主要从事分析化学及污染物环境行为研究。
姚文君,薛文平, 国文, 等. 环渤海近岸海域表层沉积物及底栖生物中PBDEs的赋存特征及富集行为[J]. 生态毒理学报,2016, 11(2): 413-420
Yao W J, Xue W P, Guo W, et al. Occurrence and bioaccumulation of polybrominated diphenyl ethers (PBDEs) in surficial sediment and benthic organism in the Bohai Sea [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 413-420 (in Chinese)

