运动对2,3,7,8-四氯二苯并二恶英急性暴露大鼠肝脏抗氧化能力的影响
张弛,闫会萍,陆一帆,*,翁凯翔,武铁男,胡兵,王娟娟,刘一凝,魏东洋,许振成
1. 北京体育大学 运动康复系,北京 100084 2. 环境保护部华南环境科学研究所,广州 510655
运动对2,3,7,8-四氯二苯并二恶英急性暴露大鼠肝脏抗氧化能力的影响
张弛1,闫会萍1,陆一帆1,*,翁凯翔1,武铁男1,胡兵1,王娟娟1,刘一凝1,魏东洋2,许振成2
1. 北京体育大学 运动康复系,北京 100084 2. 环境保护部华南环境科学研究所,广州 510655
观察8周中等强度游泳运动对2,3,7,8-四氯二苯并二恶英(2,3,7,8-tetrachlorodibenzo-p-dioxin,2,3,7,8-TCDD)急性暴露大鼠肝脏氧化应激的影响。以8周龄雄性Sprague Dawley大鼠为研究对象,将大鼠随机分为玉米油静养组(NC组)、玉米油运动组(EC组)、TCDD静养组(NT)和TCDD运动组(ET组)。将TCDD溶于玉米油中,NT和ET组大鼠按照10 μg·kg-1(以单位体重计)腹腔注射TCDD,NC和EC组大鼠注射等量玉米油。正式实验开始后,EC和ET组大鼠进行运动(尾部负重5%游泳30 min),每周运动5 d,共8周,NC和NT组大鼠不进行任何运动干预。8周后,称重并宰杀大鼠,收集血清和肝组织样本,待测血清天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)的活性;肝组织丙二醛(MDA)含量,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)以及谷胱甘肽过氧化物酶(GSH-Px)的活性。将数据进行多因素方差分析,结果表明,染毒可升高大鼠血清AST的活性,增加肝脏MDA的含量,降低肝脏SOD、CAT和GSH-Px的活性;运动可降低大鼠肝脏GSH-Px的活性;染毒后运动可减少肝脏MDA的含量,升高肝脏SOD、CAT和GSH-Px的活性。研究表明,TCDD急性暴露可导致大鼠肝细胞功能受损,导致大鼠肝脏发生氧化应激。8周有氧运动改善TCDD急性暴露诱导的肝细胞损伤,改善肝脏氧化应激,这可能是运动改善TCDD肝毒性的机制之一。
2,3,7,8-四氯二苯并二恶英;大鼠;肝脏抗氧化能力;运动
Received 30 November 2015 accepted 6 January 2016
伴随全球工业化进程的加快,环境中存在着大量危害人类健康的致病因素,二恶英作为一种典型的持续性有机污染物,因其亲脂性、生物富集性、难降解、高毒性等特点引起了学术界的广泛关注。二恶英包含多种化学有机物,其中毒性最强的是2,3,7,8-四氯二苯并二恶英(2,3,7,8-tetrachlorodibenzo-p-dioxin,2,3,7,8-TCDD)[1]。TCDD可经皮肤、呼吸道和消化道进入机体,对机体造成广泛的损害[2]。TCDD经腹腔注射后在肝脏发生首过消除效应,可扰乱肝功能,诱导肝细胞增生、肥大,造成肝细胞损伤甚至凋亡,还可导致肝脏氧化与抗氧化系统功能失衡,表现为丙二醛(malondialdehyde,MDA)含量增加,超氧化物歧化酶(superoxidase dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶活性降低,因此氧化应激被认为是TCDD发挥肝脏毒性作用的重要环节[3-5]。
随着“exercise is medicine”这一健身理念的提出,长期规律的运动锻炼作为一种防治慢性疾病的非药物性手段越来越受到学术界的关注。研究表明,参加体育锻炼或者体力活动具有防治非酒精性脂肪肝,改善肥胖患者肝脏脂代谢,增加II型糖尿病患者肝脏糖原储备、改善糖代谢等诸多益处,适宜的有氧运动是防治肝脏疾病保护肝组织的有效干预手段[6-8]。剧烈运动时,机体的能量代谢增加,活性氧(reactive oxidative species, ROS)作为线粒体氧化磷酸化的副产物在细胞内的浓度也急剧升高,因此剧烈运动会造成机体的氧化损伤。而规律的、适宜强度的有氧运动具有提高机体抗氧化能力、降低氧化应激水平的作用[9],可见机体氧化与抗氧化系统对于运动的应答与运动强度和机体本身的氧化-抗氧化平衡状态有关。
本文通过随机对照试验(randomized controlled trail, RCT)研究8周有氧运动对TCDD急性暴露大鼠肝脏氧化应激的影响,为运动缓解TCDD导致的肝毒性、防治肝脏疾病、促进机体健康提供一定的理论依据。
1 材料与方法 (Materials and methods)
1.1 实验对象及分组
8周龄SPF级雄性Sprague-Dawley(SD)大鼠40只,体重(191.06±9.94) g,购于中国人民解放军军事医学科学院(许可证号SCXK-(军)2012-0004),实验已经通过北京体育大学福利伦理委员会审核批准,适应性饲养1周后,将大鼠随机分为4组:正常对照组(normal control, NC)、染毒组(normal toxic, NT)、运动对照组(exercise control, EC)、运动染毒组(exercise toxic, ET),各组分笼饲养,饲养温度(22±2) ℃,湿度为(50±5)%,昼夜交替时间为12 h,自由饮用水和食物,以国家标准啮齿类动物常规饲料喂养,自由饮水、饮食,大鼠所用饮用水和垫料均经过高压蒸汽灭菌,动物房及饲养用具定期清扫消毒。饲养室、用具等定期消毒灭菌。
1.2 染毒及运动方案
将2,3,7,8-TCDD溶于玉米油中,NT和ET组大鼠腹腔注射10 μg·kg-1(以单位体重计)的2,3,7,8-TCDD(购自美国Cambridge Isotope Laboratories Inc,纯度99%),NC和EC组大鼠腹腔注射等量玉米油。运动组(ET与EC)大鼠运动方式为尾部负重5%进行游泳(尾根套负重螺丝),每周游泳5 d,每天游泳30 min,水温为(32±2) ℃。游泳水桶直径150 cm,水深75 cm。每组大鼠每天游泳时间固定,于每周称重后调整负重,共8周,NC和NT组大鼠不进行任何运动干预。
1.3 实验取材
运动组大鼠最后1次运动48 h后进行取材。所有大鼠在取材前禁食8 h,称重并记录,按照0.006 g·kg-1(以单位体重计)的剂量,腹腔注射水合氯醛麻醉。大鼠开腹后,分离腹主静脉,用负压采血管采集大鼠血液,离心后分离血清,-80 ℃冻存。快速剥离肝脏组织,在预冷的生理盐水中浸洗后,滤纸吸干水分,称重并记录,用手术剪剪成100~200 mg的小组织块,锡纸包裹后液氮速冻,之后转入-80 ℃冻存。
1.4 血清指标测试
采用比色法测试血清天门冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)的活性。所用试剂盒购自于北京华英生物技术研究所。血清样本按说明书操作步骤进行处理,分别加入相应试剂并进行孵育,用全自动生化分析仪读取特定波长的吸光度变化,计算酶活性。
1.5 肝脏氧化应激指标测试
称取100 mg肝脏组织,加入1 mL生理盐水,在玻璃匀浆器中制成10%的匀浆液。采用比色法测试肝脏匀浆液中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)的活性,及丙二醛(MDA)含量。所用试剂盒均购自北京华英生物技术研究所,操作步骤均按说明书进行。
1.6 统计学分析
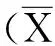
2 研究结果(Results)
2.1 血清AST、ALT水平
大鼠血清AST和ALT结果见表1,结果显示,运动对血清AST活性的影响有可靠的主效应(P=0.025,F=5.449,偏Eta方=0.131),使血清AST活性非常显著升高;染毒对血清AST活性的影响有可靠的主效应(P=0.001,F=14.404,偏Eta方=0.286),使血清AST活性非常显著升高;运动、染毒对血清AST活性的影响无可靠的交互效应(P=0.809,F=0.059,偏Eta方=0.002)。运动对血清ALT活性的影响有可靠的主效应(P=0.000,F=48.372,偏Eta方=0.573),使血清ALT活性非常显著升高;染毒对血清ALT活性的影响无可靠的主效应(P=0.089,F=3.062,偏Eta方=0.078);运动、染毒对血清ALT活性的影响无可靠的交互效应(P=0.802,F=0.064,偏Eta方=0.002)。
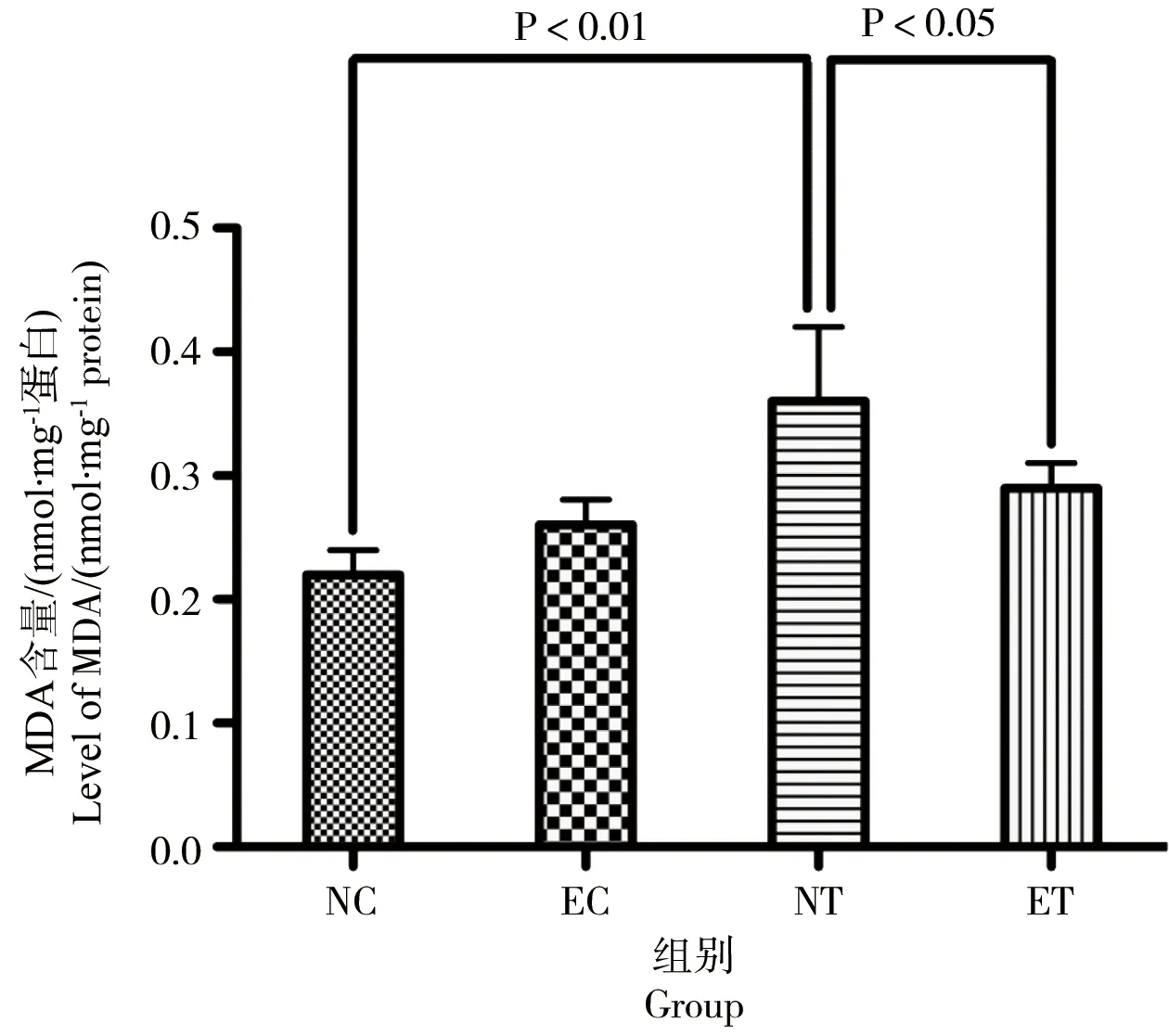
图1 运动对TCDD染毒大鼠肝组织MDA含量的影响Fig. 1 The effect of exercise on the liver MDA level of rats after acute exposure to TCDD

表1 大鼠血清AST和ALT活性的变化
注:NC, 正常对照组;EC, 运动对照组;NT, 染毒组;ET, 运动染毒组。*, P<0.05 vs. NC; **, P<0.01 vs. NC; ***, P<0.001 vs. NC。
Note: NC, the normal control group; EC, the exercise control group; NT, the normal TCDD group; ET, the exercise TCDD group. *, P<0.05 vs. NC; **, P<0.01 vs. NC; ***, P<0.001 vs. NC.
2.2 肝脏MDA含量
肝组织MDA含量测试结果见图1,运动对肝脏MDA含量的影响无可靠的主效应(P=0.371,F=0.900,偏Eta方=0.101);染毒对肝脏MDA含量的影响有可靠的主效应(P=0.005,F=14.400,偏Eta方=0.643),使肝脏MDA含量非常显著升高;运动、染毒对肝脏MDA含量的影响有可靠的交互效应(P=0.045,F=5.625,偏Eta方=0.413),染毒后运动可显著降低肝脏MDA含量。
2.3 肝脏抗氧化酶活性
肝组织抗氧化酶活性检测结果见图2~4。结果显示,运动对肝脏SOD的影响无可靠的主效应(P=0.455,F=0.617,偏Eta方=0.072);染毒对肝脏SOD活性的影响有可靠的主效应(P=0.000,F=34.638,偏Eta方=0.812),使肝脏SOD活性非常显著降低;运动、染毒对肝脏SOD活性的影响有可靠的交互效应(P=0.005,F=14.967,偏Eta方=0.652),染毒后运动可非常显著升高肝脏SOD活性。
运动对肝脏CAT活性的影响无可靠的主效应(P=0.095,F=3.581,偏Eta方=0.309);染毒对肝脏CAT活性的影响有可靠的主效应(P=0.000,F=40.302,偏Eta方=0.834),使肝脏CAT活性非常显著降低;运动、染毒对肝脏CAT活性的影响有可靠的交互效应(P=0.001,F=23.255,偏Eta方=0.744),染毒后运动可非常显著升高肝脏CAT活性。
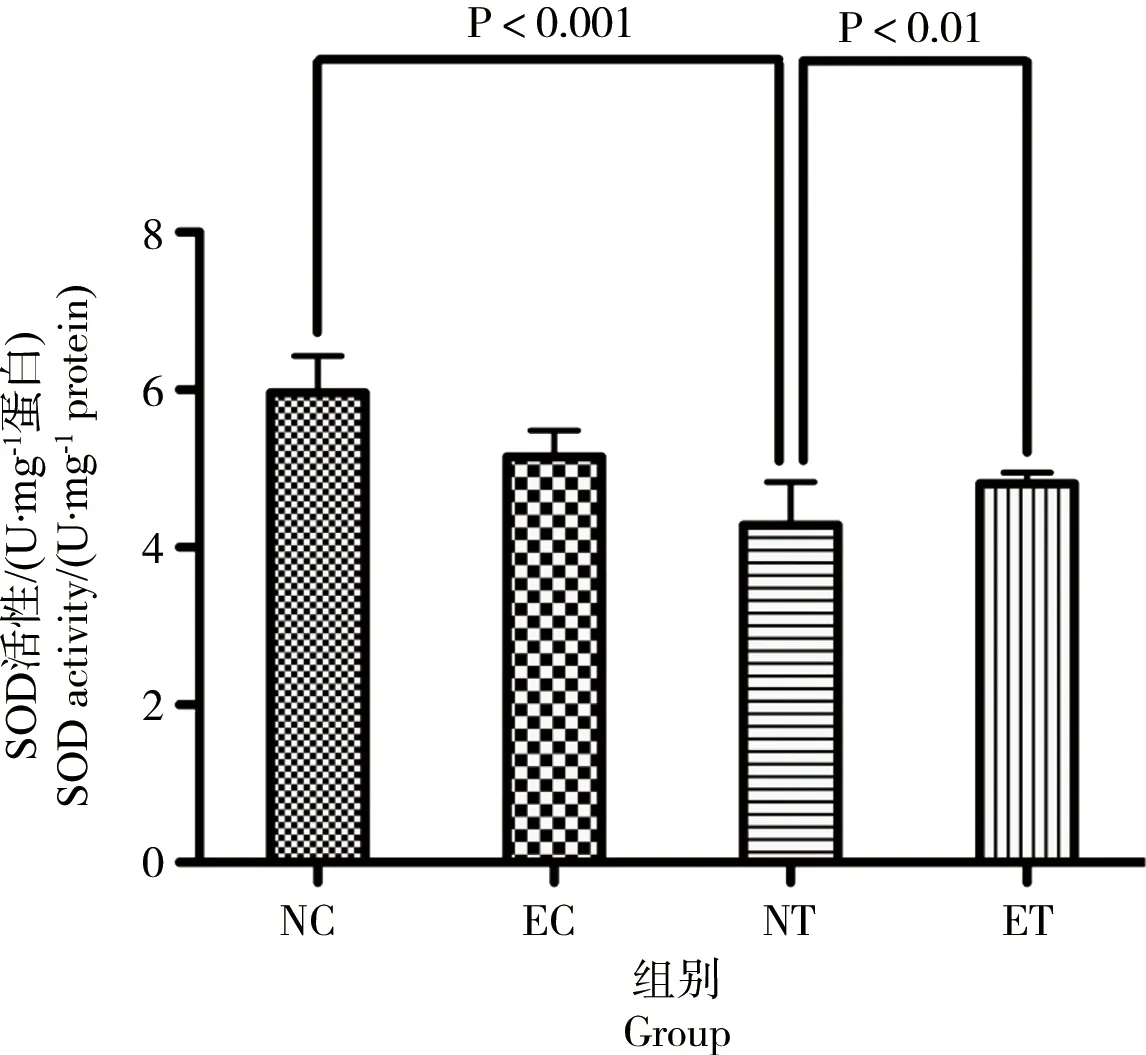
图2 运动对TCDD染毒大鼠肝组织SOD活性的影响Fig. 2 The effect of exercise on the activity of liver SOD of rats after acute exposure to TCDD
运动对肝脏GSH-Px活性的影响有可靠的主效应(P=0.023,F=7.846,偏Eta方=0.495),使肝脏GSH-Px活性显著降低;染毒对肝脏GSH-Px活性的影响有可靠的主效应(P=0.001,F=29.843,偏Eta方=0.789),使肝脏GSH-Px活性非常显著降低;运动、染毒对肝脏GSH-Px活性的影响有可靠的交互效应(P=0.000,F=50.822,偏Eta方=0.864),染毒后运动可非常显著升高肝脏GSH-Px活性。

图3 运动对TCDD染毒大鼠肝组织CAT活性的影响Fig. 3 The effect of exercise on the activity of liver CAT of rats after acute exposure to TCDD
图4 运动对TCDD染毒大鼠肝组织GSH-Px活性的影响Fig. 4 The effect of exercise on the activity of liver GSH-Px of rats after acute exposure to TCDD
3 讨论(Discussion)
3.1 运动对TCDD大鼠血清AST、ALT及LDH水平的影响
TCDD进入机体后首先在肝脏发生首过消除效应,肝脏因较早地接触TCDD而成为TCDD毒性的靶器官。TCDD在肝脏的聚集会导致肝脏肿大、实质增生和肥大,最终会引起肝细胞大量的坏死和凋亡。伴随肝脏病理学改变发生的是肝脏代谢功能的紊乱,表现为肝脏内大量存在的AST、ALT和LDH等代谢酶释放进入血液,使血清中酶的活性升高。本实验室前期的研究结果证实,有氧运动可以改善TCDD诱导的肝毒性,保护肝细胞,改善肝脏功能,纠正肝脏脂代谢紊乱[10]。本实验结果所示,TCDD急性暴露8周后,大鼠血清AST的活性显著增高,ALT的活性有增高的趋势但是没有统计学意义,这说明本实验成功建立了大鼠肝脏TCDD急性暴露染毒模型,而ALT没有显著增高的原因可能与本实验采用的染毒模型为急性暴露,其对大鼠肝脏的损伤较慢性染毒较轻有关[11-12]。8周有氧运动并未使TCDD急性暴露大鼠血清AST和ALT活性显著减低。结合运动对正常大鼠血清AST和ALT酶活性的影响,我们推测可能是运动引起大鼠骨骼肌发生损伤,释放部分AST和ALT进入血液,这说明本实验所采用的运动方案是有效的,这也提示我们在今后的研究中,当不能排除运动诱导骨骼肌和心肌等释放一系列的酶进入血液的情况下,评价运动模型的肝功能一定要从多方面、多角度着手,比如增加肝脏超声等指标。
3.2 运动对TCDD大鼠肝脏抗氧化能力的影响
TCDD导致肝脏损伤的机制虽然目前仍不完全清楚,但是动物实验已经证实TCDD的肝毒性主要是通过AhR受体介导的[13-15]。TCDD进入肝脏后同内源性的核转录因子AhR结合,诱导毒物代谢有关I相代谢酶和II相代谢酶的表达,从而导致相应的毒效应。I相代谢酶主要是细胞色素P450。细胞色素P450可以将TCDD代谢成易氧化还原的酚类或醌类物质,在氧化还原的过程中不断产生ROS和活性氮(reactive nitrogen species,RNS)。而肝脏内存在众多抗氧化酶可以降解ROS或RNS,缓解氧化损伤。但当肝脏内自由基生成增加,抗氧化能力减退时,将诱发氧化应激。近几年的研究发现,长期TCDD暴露可以使肝脏内氧化—抗氧化系统失衡,表现为MDA含量增加,SOD、CAT和GSH-Px等氧化酶的活性减弱。而抗氧化治疗可以改善TCDD的肝毒性[16-17]。本实验结果显示,TCDD急性暴露8周后大鼠肝脏MDA含量增加,SOD、CAT和GSH-Px的活性减弱,这说明TCDD急性暴露也可以使肝脏发生氧化应激,综合以上结果,本实验证明氧化应激是TCDD导致肝毒性的重要环节。
运动作为一种应激,可以对机体的抗氧化系统产生影响。长期的运动刺激可以使机体产生不同水平的结构和功能重塑,其表现之一是机体对氧化应激产生系统性适应[18]。运动与氧化应激的关系是十分复杂的。研究发现,大强度运动过程中ROS产生增多,并伴随脂质、蛋白质和DNA的氧化损伤。但是长期规律的运动锻炼可以降低机体的氧化应激水平,这是因为适宜强度的运动产生的低浓度的ROS对机体不具有毒性作用但又能刺激机体对此产生适应包括抗氧化体系和氧化损伤修复系统的激活[19-20]。关于运动与肝脏氧化应激的关系已有大量研究,Barcelos等[21]发现4周运动训练虽然可以增强骨骼肌的有氧代谢能力但会造成肝脏的氧化损伤,表现为肝脏脂质过氧化增加,血清AST、CK活性增加,肝脏抗氧化酶SOD、GSH-Px的活性代偿性增加,所以在进行大运动量训练时进行抗氧化营养剂的补充是必需的。Hu等[22]报道,运动锻炼可以通过降低肝脏氧化应激损伤对非酒精性脂肪肝起到防治作用。由此可见,运动对机体氧化应激的影响与运动方式、运动强度和机体本身的氧化应激水平息息相关[14]。因此,探索运动对TCDD急性暴露大鼠肝脏氧化应激的影响具有一定的理论价值和实践意义。本实验结果显示,8周有氧运动对正常大鼠肝脏MDA含量,SOD、CAT活性没有影响,这提示本实验所采用的运动方案不是大负荷方案,没有影响肝脏氧化和抗氧化之间的平衡,未造成大鼠肝脏氧化损伤[23],这与本实验血清酶活性指标的结果相互印证。本实验结果显示,运动降低了TCDD急性暴露大鼠肝脏MDA含量,升高了SOD和CAT的活性,这提示本实验所选用的运动方案可以提高TCDD急性暴露大鼠肝脏的抗氧化能力,降低氧化应激水平,这可能是有氧运动缓解TCDD肝毒性的机制之一。
综上所述,急性10 μg·kg-1体重TCDD染毒后8周,可导致大鼠肝细胞功能受损,导致大鼠肝脏抗氧化能力减退发生氧化应激,表现为MDA含量增加,SOD和CAT的活性减弱。8周有氧运动能有效抵抗TCDD急性暴露诱导的肝细胞损伤,改善肝脏氧化应激,这可能是运动改善TCDD肝毒性的机制之一。
致谢:特别感谢环境保护部华南环境科学研究所许振成研究员、国家体育总局运动医学研究所方子龙研究员的支持和帮助。
[1] Malisch R, Kotz A. Dioxins and PCBs in feed and food - review from European perspective [J]. Science of the Total Environment, 2014, 491-492: 2-10
[2] Sorg O. AhR signalling and dioxin toxicity [J]. Toxicology Letters, 2014, 230(2): 225-233
[3] Diliberto J J, Jackson J A, Birnbaum L S. Comparison of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) disposition following pulmonary, oral, dermal, and parenteral exposures to rats [J]. Toxicology and Applied Pharmacology, 1996, 138(1): 158-68
[4] Ciftci O, Vardi N, Ozdemir I. Effects of quercetin and chrysin on 2,3,7,8-tetrachlorodibenzo-p-dioxin induced hepatotoxicity in rats [J]. Environmental Toxicology, 2013, 28(3): 146-154
[5] Turkez H, Geyikoglu F, Yousef M I. Beneficial effect of astaxanthin on 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced liver injury in rats [J]. Toxicology & Industrial Health, 2013, 29(7): 591-599
[6] 李军汉, 苏全生, 孙君志,等. 内质网应激介导细胞凋亡在运动预防非酒精性脂肪肝形成中的作用[J]. 北京体育大学学报, 2015, 10: 8
Li J H, Su Q S, Sun J Z, et al. Effects of exercise on endoplasmic reticulum stress induced apoptosis of liver cells in rats with non-alcoholic fatty liver diseases model [J]. Journal of Beijing Sport University, 2015, 10: 8 (in Chinese)
[7] 晋娜, 陈文鹤. 中小强度有氧运动对肥胖症患者脂肪肝的影响[J]. 上海体育学院学报, 2013, 36(6): 58-61
Jin N, Chen W H. The influence of aerobic exercise with moderate and low intensity on fatty liver of obese patients [J]. Journal of Shanghai University of Sport, 2013, 36(6): 58-61 (in Chinese)
[8] 张裕中, 王银晖, 陈晓光, 等. 游泳运动和白藜芦醇对Ⅱ型糖尿病大鼠肝糖原及肝脏GLUT2的影响[J]. 中国运动医学杂志, 2014, 33(2): 135-140
Zhang Y Z, Wang Y H, Chen X G, et al. Effects of swimming and resveratrol adminnstrarion on hepatic glycogen and GLU2 in the liver of type 2 diabetic rat [J]. Chinese Journal of Sports Medicine, 2014, 33(2): 135-140 (in Chinese)
[9] Zsolt R, Zhongfu Z, Erika K, et al. Oxygen consumption and usage during physical exercise: The balance between oxidative stress and ROS-dependent adaptive signaling [J]. Antioxidants & Redox Signaling, 2013, 18(10): 1208-1246
[10] 蔡爱芳. 运动对二恶英致大鼠脂质合成代谢障碍的干预作用及其机制研究[D]. 北京: 北京体育大学, 2013
Cai A F. Intervention effect and mechanism of exercise on dioxin caused lipid anabolism disorders in rats [D]. Beijing: Beijing Sport University, 2013 (in Chinese)
[11] Kalaiselvan I, Samuthirapandi M, Govindaraju A, et al. Olive oil and its phenolic compounds (hydroxytyrosol and tyrosol) ameliorated TCDD-induced heptotoxicity in rats via inhibition of oxidative stress and apoptosis [J]. Pharmaceutical Biology, 2016, 54(2): 1-9
[12] Lu H, Cui W, Klaassen C D. Nrf2 protects against 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin (TCDD)-induced oxidative injury and steatohepatitis [J]. Toxicology and Applied Pharmacology, 2011, 256(2): 122-135
[13] Sorg O. AhR signalling and dioxin toxicity [J]. Toxicology Letters, 2014, 230: 225-233
[14] Watson J D, Prokopec S D, Smith A B, et al. TCDD dysregulation of 13 AHR-target genes in rat liver [J]. Toxicology and Applied Pharmacology, 2014, 274(3): 445-454
[15] Pierre S, Chevallier A, Teixeira-Clerc F, et al. Aryl hydrocarbon receptor-dependent induction of liver fibrosis by dioxin [J]. Toxicological Sciences, 2014, 137(1): 114-124
[16] Türkez H, Geyikoglu F, Yousef M I. Ameliorative effect of docosahexaenoic acid on 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced histological changes, oxidative stress, and DNA damage in rat liver [J]. Toxicology & Industrial Health, 2012, 28(8): 687-696
[17] Aly H A, El-Shitany N A, El-Beshbishy H A, et al. Ameliorative effect of lycopene against 2,3,7,8-tetrachlorodibenzo-p-dioxin- induced rat liver microsomal toxicity: An in vitro study [J]. Toxicology & Industrial Health, 2015, 31(10): 938-950
[18] 赵丽, 熊开宇, 王正珍, 等. 运动与毒物兴奋效应[J]. 中国老年学杂志, 2011, 31(11): 2134-2136
Zhao L, Xiong K Y, Wang Z Z, et al. Exercise and hormesis [J]. Chinese Journal of Gerontology, 2011, 31(11): 2134-2136 (in Chinese)
[19] Vezzoli A, Pugliese L, Marzorati M, et al. Time-course changes of oxidative stress response to high-intensity discontinuous training versus moderate-intensity continuous training in masters runners [J]. PloS one, 2014, 9(1): e87506
[20] Sugama K, Suzuki K, Yoshitani K, et al. Changes of thioredoxin, oxidative stress markers, inflammation and muscle/renal damage following intensive endurance exercise [J]. Exercise Immunology Review, 2015, 21: 130-142
[21] Barcelos R P, Souza M A, Amaral G P, et al. Caffeine supplementation modulates oxidative stress markers in the liver of trained rats [J]. Life Sciences, 2014, 96(1-2): 40-45
[22] Hu X, Duan Z, Hu H, et al. Proteomic profile of carbonylated proteins in rat liver: Exercise attenuated oxidative stress may be involved in fatty liver improvement [J]. Proteomics, 2013, 13(10-11): 1755-1764
[23] Kwon T D, Lee M W, Kim K H. The effect of exercise training and water extract from propolis intake on the antioxidant enzymes activity of skeletal muscle and liver in rat [J]. Journal of Exercise Nutrition & Biochemistry, 2014, 18(1): 9-17
◆
Effect of Exercise on the Activity of Liver Antioxidant Ability in 2,3,7,8-Tetrachlorodibenzo-p-dioxin (TCDD) - Exposed Rats
Zhang Chi1, Yan Huiping1, Lu Yifan1,*, Weng Kaixiang1, Wu Tienan1, Hu Bing1, Wang Juanjuan1, Liu Yining1, Wei Dongyang2, Xu Zhencheng2
1. Sports Rehabilitation College, Beijing Sport University, Beijing 100084, China 2. South China Institute of Environmental Sciences of Ministry of Environmental Protection, Guangzhou 510655, China
The purpose of this study was to investigate the effects of moderate intensity exercise (8-week swimming) on the oxidative stress in the liver of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD)-exposed rats. Forty, 2-month-old, male Sprague Dawley (SD) rats were randomly assigned to 4 groups, including normal control (NC) group, normal toxic (NT) group, exercise control (EC) group, and exercise toxic (ET) group. The rats in NT and ET groups were intraperitoneally injected with TCDD (dissolved in the corn oil, 10 μg·kg-1body weight); and the NC and EC groups were injected with equivalent volume of corn oil. Then, the rats in EC and ET groups swam for 8 weeks with a weight of 5% body weight attached to the tails (30 min·d-1and 5 d per week). After all the procedure, the body weights of the rats were measured, the liver of the rats was obtained to determine the concentration of malonaldehyde (MDA), and the activities of the superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GSH-Px). And the sera were collected to determine the activities of the aspartate aminotransferase (AST) and the alanine aminotransterase (ALT). The results show that the AST activity and the MDA concentration increased, and the activities of SOD, CAT, and GSH-Px decreased in the NT groups compared to the NC group. In addition, the GSH-Px activity decreased in the EC group, while the MDA concentration decreased and the activities of SOD, CAT and GSH-Px increased. It can be conclude that acute exposure of TCDD could lead to hepatocyte damage, and consequently result in the oxidative stress in the live. Eight week of moderate intensity exercise may decrease the cell damage and the oxidative stress. Therefore, the improving effects of the exercise on the anti-oxidative capacity of the liver may be one of the mechanisms of its hepatic protective function against TCDD.
2,3,7,8-TCDD; rat; antioxidant ability of liver; exercise
10.7524/AJE.1673-5897.20151130023
北京体育大学自主科研课题(2014YB015);全国重点地区环境与健康专项调查(21111011101EHH(2011)-505)
张弛(1992-),男,在读硕士生,研究方向运动与健康,E-mail: sws_zc@126.com
*通讯作者(Corresponding author), E-mail: fanluyi@hotmail.com
2015-11-30 录用日期:2016-01-06
1673-5897(2016)2-300-07
X171.5
A
简介:陆一帆(1963—),男,运动生理学博士,教授,博士研究生导师,主要研究方向为运动训练监控、社区体育健身、运动与健康。
张弛, 闫会萍, 陆一帆, 等. 运动对2,3,7,8-四氯二苯并二恶英急性暴露大鼠肝脏抗氧化能力的影响[J]. 生态毒理学报,2016, 11(2): 300-306
Zhang C, Yan H P, Lu Y F, et al. Effect of exercise on the activity of liver antioxidant ability in 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD)-exposed rats [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 300-306 (in Chinese)

