邻苯二甲酸二丁酯对海洋微藻生长的影响
黄博珠,何瑞,孙凯峰,段舜山,徐宁,*
1. 暨南大学生态学系 水生生物研究所,广州510632 2. 珠江水利科学研究院,广州510611 3. 环境保护部华南环境科学研究所,广州510655
邻苯二甲酸二丁酯对海洋微藻生长的影响
黄博珠1,何瑞2,孙凯峰3,段舜山1,徐宁1,*
1. 暨南大学生态学系 水生生物研究所,广州510632 2. 珠江水利科学研究院,广州510611 3. 环境保护部华南环境科学研究所,广州510655
近年来,内陆和近海水体中的一种典型环境激素邻苯二甲酸二丁酯(DBP)含量显著上升,但其对海洋生态系统的影响并不明确。本研究选取7种海洋微藻为实验材料,包括1种甲藻(东海原甲藻Prorocentrum donghaiense),2种定鞭藻(小普林藻Prymesium parvum和球形棕囊藻Phaeocystis globosa),2种硅藻(中肋骨条藻Skeletonema costatum和三角褐指藻Phaeodactylum tricornutum),以及1种隐藻(红胞藻Rhodomonus salina)和1种绿藻(海洋小球藻Chlorella sp.),设置5个DBP暴露浓度(5、10、20、50、100 μg·L-1),研究其对海洋微藻生长的影响,并探索DBP暴露对微藻抗氧化系统和光合系统的影响。结果表明:在所有暴露组中,球形棕囊藻、小普林藻、东海原甲藻、红胞藻、海洋小球藻生长速率显著增加;5~20 μg·L-1的DBP暴露下中肋骨条藻不受影响,50、100 μg·L-1下受到抑制;所有DBP暴露组对三角褐指藻没有显著影响。在50 μg·L-1DBP暴露下,随着时间的延长,球形棕囊藻的SOD、CAT、MDA均表现出先升高后下降的趋势,第7天藻的叶绿素a、叶绿素b,类胡萝卜素含量较对照组分别增加了23%、10%、48%,球形棕囊藻光系统II(PSII)的最大光能转化效率(Fv/Fm)、PSII的潜在活性(Fv/F0)、光合性能指数PI分别增加了4.8%、16%、69%。研究发现DBP对海洋微藻的影响具有种间差异性,能够显著促进有害赤潮藻球形棕囊藻的生长,近岸水体DBP含量的增加可能改变浮游植物群落组成,进而增加有害藻华暴发的风险。
邻苯二甲酸二丁酯;海洋微藻;生长速率;超氧化物歧化酶(SOD);过氧化氢酶(CAT);丙二醛(MDA);光合色素
邻苯二甲酸二丁酯(DBP)是塑料工业最重要的增塑剂之一。DBP通过氢键或范德华力连接到塑料的高分子碳链上,因此极易从塑料释放到环境中,对水体、土壤和生物等造成影响[1]。DBP是公认的一种能够危及人体和生物环境内分泌干扰物的环境激素[2-4],被列入我国环境优先污染物黑名单[5],因此,其对环境的影响受到政府和学术界的关注。
随着增塑剂使用量的增多,内陆和近岸水体中的DBP也呈增加趋势。有报道指出,福建省以九江为水源的2个自来水厂进水中均检测出DBP,最高含量达到17.238 μg·L-1[6],合肥市2个重点引用水的水源董铺水库和巢湖所有采样点均检出DBP,最高含量为7.25 μg·L-1[7],北京东沙河检测出70 μg·L-1以上的DBP含量[8],福建泉州湾海水中DBP浓度达到82 μg·L-1[9]。近几十年,珠江三角洲地区工业迅速发展,使得珠江河口的水体环境形势愈加严重,珠江流域同沙水库DBP含量大于8 μg·L-1[10],珠江河口DBP浓度为0.042~14.8 μg·L-1,已属于中等污染水平[11]。DBP在水体中易被沉积物和微粒吸附,珠江口沉积物中检测出4.66 μg·g-1的DBP含量,但迄今为止有关DBP对水生生态系统的影响并不清楚。
DBP很容易在水生生物中富集,研究显示,水蚤的富集系数为403,在微藻中更大[5,12]。海洋微藻是海洋食物链的基础,是初级生产力的重要组成,海洋微藻的群落组成和结构对海洋初级生产力具有重要影响,DBP对海洋微藻种群的影响也引起越来越多的关注。目前,DBP对藻类的生态毒性亦有报道,胡芹芹[13]发现DBP(5~100 mg·L-1)暴露对斜生栅藻存在明显的剂量-效应关系,DBP的暴露能降低斜生栅藻的种群生长力,对该藻有急性毒性,其96 h的半致死浓度(EC50)为2.21 mg·L-1[14-15]。高浓度DBP对三角褐指藻具有明显的抑制作用,2.5~7.5 mg·L-1暴露下均抑制三角褐指藻生长,叶绿素a、c及类胡萝卜素质量浓度随着DBP暴露浓度增大而逐渐降低[16]。另外有研究发现普通小球藻对DBP有明显的富集作用,因此DBP也存在随着食物链传递有生物累积和生物放大效应,然而铜绿微囊藻能显著降解DBP,降解速率常数为5.9×10-3·h-1[17-19]。
综合现有研究,DBP对藻类的影响主要集中于微藻对DBP的富集和降解,多使用淡水微藻类为实验材料,且关注DBP高浓度暴露下的毒性效应。海洋环境DBP污染与浮游植物群落变化间的相关关系鲜有报道。本文选取珠江口海域典型海洋微藻球形棕囊藻、小普林藻、中肋骨条藻、海洋小球藻等,研究和模拟近岸水体的DBP浓度对典型海洋微藻的影响,探索DBP污染加重对典型海洋微藻干扰效应的规律。重点探讨典型藻华原因种类球形棕囊藻[20]在DBP暴露下的生理生化相应特征,进而分析DBP污染与球形棕囊藻藻华在南海区域频频发生之间的相关关系[21],为进一步认识典型环境激素DBP对海洋生态系统的影响提供参考资料。
1 材料与方法 (Materials and methods)
1.1实验材料
本实验用藻以分离自广东省惠州市大亚湾海域的定鞭藻球形棕囊藻(Phaeocystis globosa)、小普林藻(Prymesium parvum),硅藻中肋骨条藻(Skeletonema costatum)、三角褐指藻(Phaeodactylum tricornutum),绿藻海洋小球藻(Chlorella sp.)为材料,另选取实验室长期保种的甲藻东海原甲藻(Prorocentrum donghaiense),隐藻红胞藻(Rhodomonus salina)作对比研究。本研究均采用f/2液体培养基,温度(23±1) ℃,盐度为30,光照强度100 (μmol·m-2·s-1),光暗周期为12L: 12D。培养期间每天定时摇动3次,并随机变换位置。
实验用邻苯二甲酸二丁酯(dibutyl phthalate)购自上海阿拉丁试剂公司,纯度>99.5%(GC)。
1.2 实验方法
1.2.1 DBP对海洋微藻生长的影响
DBP浓度设置参考近岸水体浓度范围,以低于20 μg·L-1为自然水体状况,并模拟污染加剧情况下的浓度50、100 μg·L-1,以不加入DBP组为对照。由于实验用藻的大小及密度有所差异,经过预实验后确定每种微藻的接种密度(见表1)。通过预实验和方差分析得到丙酮的无可观察效应剂量(no observed effect level, NOEL)为0.5%,因此本研究中采用体积浓度为0.5%丙酮为DBP助溶剂。
实验采用50 mL玻璃试管(藻液体积为35 mL),于培养箱中培养一周,每组设置3个平行。利用TD-700叶绿素荧光仪每天测定各实验组叶绿素荧光值,并计算指数生长期的生长速率,公式如下:
生长速率=ln(Nt/N0)/T
公式中:Nt为第t天藻的叶绿素荧光值,N0为初始的叶绿素荧光值,T为培养时间
1.2.2 DBP对球形棕囊藻抗氧化酶和MDA的影响
选取指数生长期的球形棕囊藻为受试藻,接种至1 L三角瓶中,每瓶600 mL藻液,接种密度为2×105cells·mL-1,DBP暴露浓度为50 μg·L-1,以不加入DBP作为对照组,每组设置3个平行。在0 h、12 h、24 h、48 h、72 h、168 h时分别取60 mL藻液分装至6个10 mL离心管,4℃、7 000 r·min-1离心15 min,去上清收集藻细胞,每个离心管加入2 mL预冷处理后的粗酶提取缓冲液,重新悬浮后冰浴下超声破碎10 min,镜检无完整细胞,再次于4 ℃、12 000 r·min-1离心15 min,上清即为待测酶粗提取液。实验采用蛋白测定试剂盒(A-045)、总过氧化物歧化酶(T-SOD)试剂盒(A001)、过氧化氢酶(CAT)试剂盒(A007)、丙二醛(MDA)试剂盒(A003)测定藻的SOD、CAT、MDA含量,试剂盒均购自南京建成公司,实验过程严格按照试剂盒说明操作。
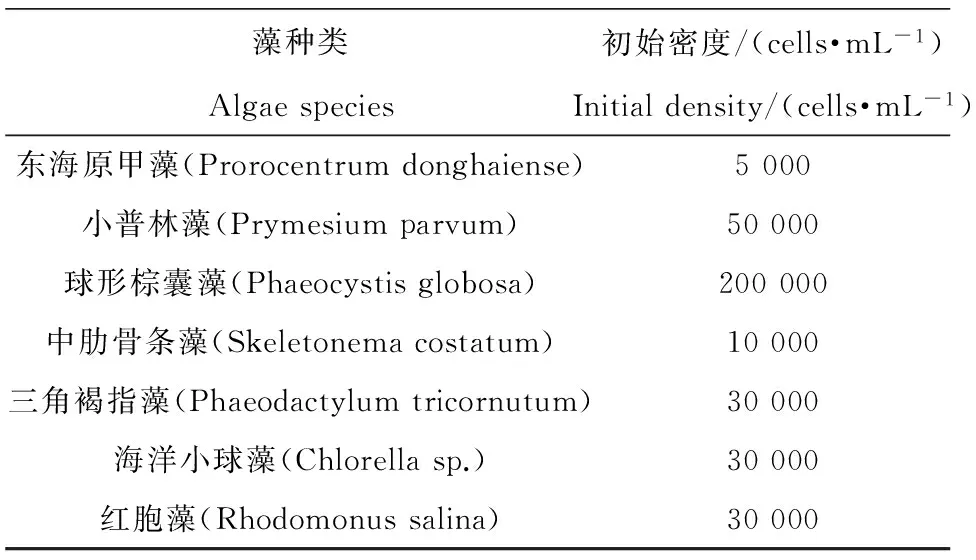
表1 7种海洋微藻的初始密度
1.2.3 DBP对球形棕囊藻光合色素及光合系统II(PSII)的影响
实验采用250 mL的三角瓶,加入200 mL藻液,接种密度为2×105cells·mL-1,DBP终浓度为50 μg·L-1,未加DBP为对照,每组设置3个平行。在第7天时取5 mL藻液,室温下以5 000 r·min-1离心15 min,弃上清,加入90%丙酮5 mL,震荡混匀后于黑暗处4 ℃静置抽提24 h,以5 000 r·min-1离心15 min,取上清液于470 nm、644.8 nm、661.6 nm波长下测定吸光值,以空白抽提液为对照,色素含量(mg·L-1)计算公式如下:
叶绿素a =11.24A661.6-204A644.8
叶绿素b =20.13A644.8-4.19A661.8
类胡萝卜素=(1000A470-1.90叶绿素a-63.14叶绿素b)/214
取一定量体积的藻液,测量前将样品先暗适应30 min,然后暴露在饱和脉冲光(3 000 μmol·m-2·s-1)下2 s,用Handy-PEA连续激发式荧光仪测量O-J-I-P荧光诱导曲线及分析得到光合参数最大光能转化效率(Fv/Fm)、PSII的潜在活性(Fv/F0)、光合性能指数PI[22]。
1.3 数据统计与分析
所有数据采用SPSS13.0和Origin8.0进行统计分析。
2 结果(Results)
2.1 DBP对海洋微藻生长的影响
不同质量浓度DBP作用下7种海洋微藻的生长速率如图1所示。实验结果显示,在5~20 μg·L-1DBP暴露下,定鞭藻球形棕囊藻(Fig. 1A)、小普林藻(Fig. 1B),甲藻东海原甲藻(Fig. 1C),隐藻红胞藻(Fig. 1D),绿藻海洋小球藻(Fig. 1E)生长速率显著增加,增长率分别为64%、71%、67%、214%、5.0%。中肋骨条藻和非赤潮藻三角褐指藻生长与对照没有显著性差别。
当DBP污染加重,50 μg·L-1DBP暴露下球形棕囊藻生长率仍有65%的增加,东海原甲藻生长率增加了133%,红胞藻生长率增加了243%,海洋小球藻生长率增加了4.9%,而小普林藻生长率增加相对减少,仅增加25%。中肋骨条藻则表现出生长抑制,生长率较对照组下降了2.1%,非赤潮藻三角褐指藻没有显著影响。
当DBP污染继续加重,100 μg·L-1DBP暴露下球形棕囊藻生长率增长了56%,东海原甲藻生长率增加了99%,红胞藻生长率增加了262%,海洋小球藻生长率增加了4.9%,小普林藻生长率增加了29%,中肋骨条藻持续抑制,生长率下降了59%,非赤潮藻三角褐指藻仍无显著影响。
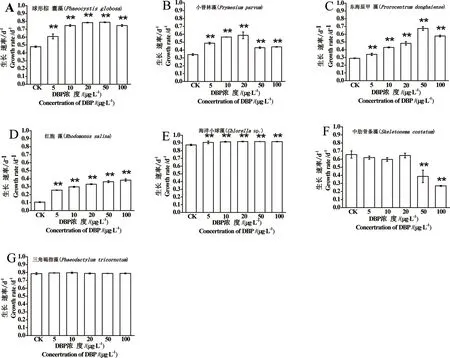
图1 不同DBP浓度对7种海洋微藻生长速率的影响(**:与对照组比较,P<0.01)Fig. 1 Effects of different concentrations of DBP on the growth rate of seven marine algae (**: compared with the control group, P <0.01)
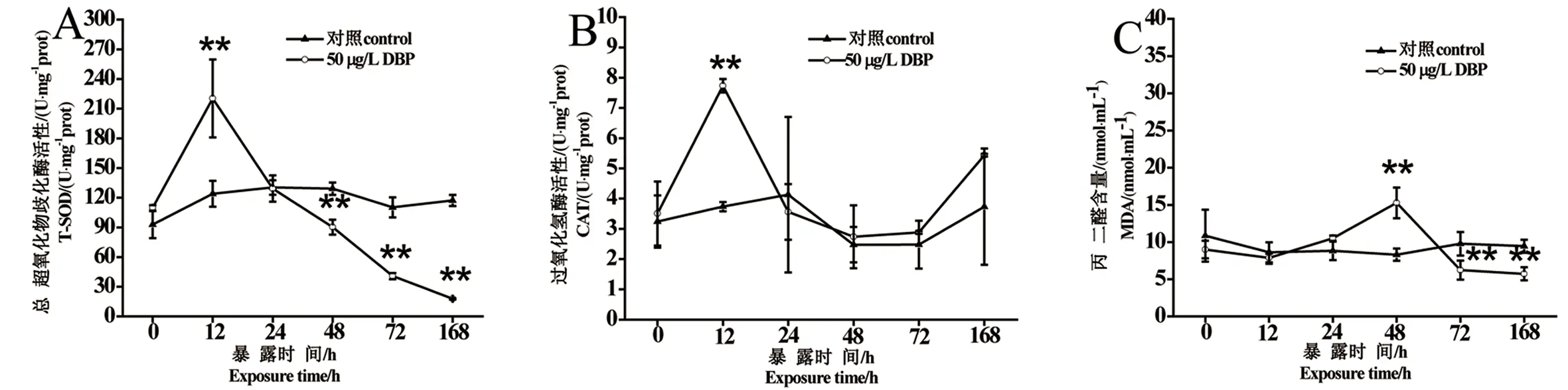
图2 DBP(50 μg·L-1)暴露下,球形棕囊藻SOD、CAT、MDA含量的时间变化(*:与对照组比较,P<0.05; **:与对照组比较,P<0.01)Fig. 2 Content of SOD, CAT, MDA of Phaeocystis globosa exposed to DBP (50 μg·L-1) at different culture time(*: compared with the control group, P <0.05; **: compared with the control group, P <0.01)
2.2 DBP对球形棕囊藻抗氧化酶和MDA的影响
在50 μg·L-1的DBP暴露下,球形棕囊藻的SOD、CAT、MDA含量如图2所示。球形棕囊藻SOD在12 h较对照上升了78%,48 h后下降,呈现先升高后下降的趋势。球形棕囊藻的CAT活性在12 h迅速上升,达到7.7 U·mg-1prot,较对照上升了107%,随后逐渐下降,呈现先升高后下降趋势;球形棕囊藻的MDA在48 h MDA含量较对照增加了19%,随后下降,呈现先升高后下降趋势。
2.3 DBP对球形棕囊藻光合色素及光合系统II的影响
在50 μg·L-1的DBP暴露下,球形棕囊藻第7天光合色素含量如图3所示,叶绿素a、叶绿素b、类胡萝卜素较对照组均有所升高,分别增加了23%、10%、48%。球形棕囊藻快速叶绿素荧光诱导曲线如图4所示,第7天荧光值高于对照组。通过对OJIP快速荧光诱导曲线分析得到球形棕囊藻第7天光合参数如表2所示,最大光能转化效率(Fv/Fm)较对照增加了4.8%,PSII的潜在活性(Fv/F0)较对照增加了16%,光合性能指数PI较对照增加了69%。
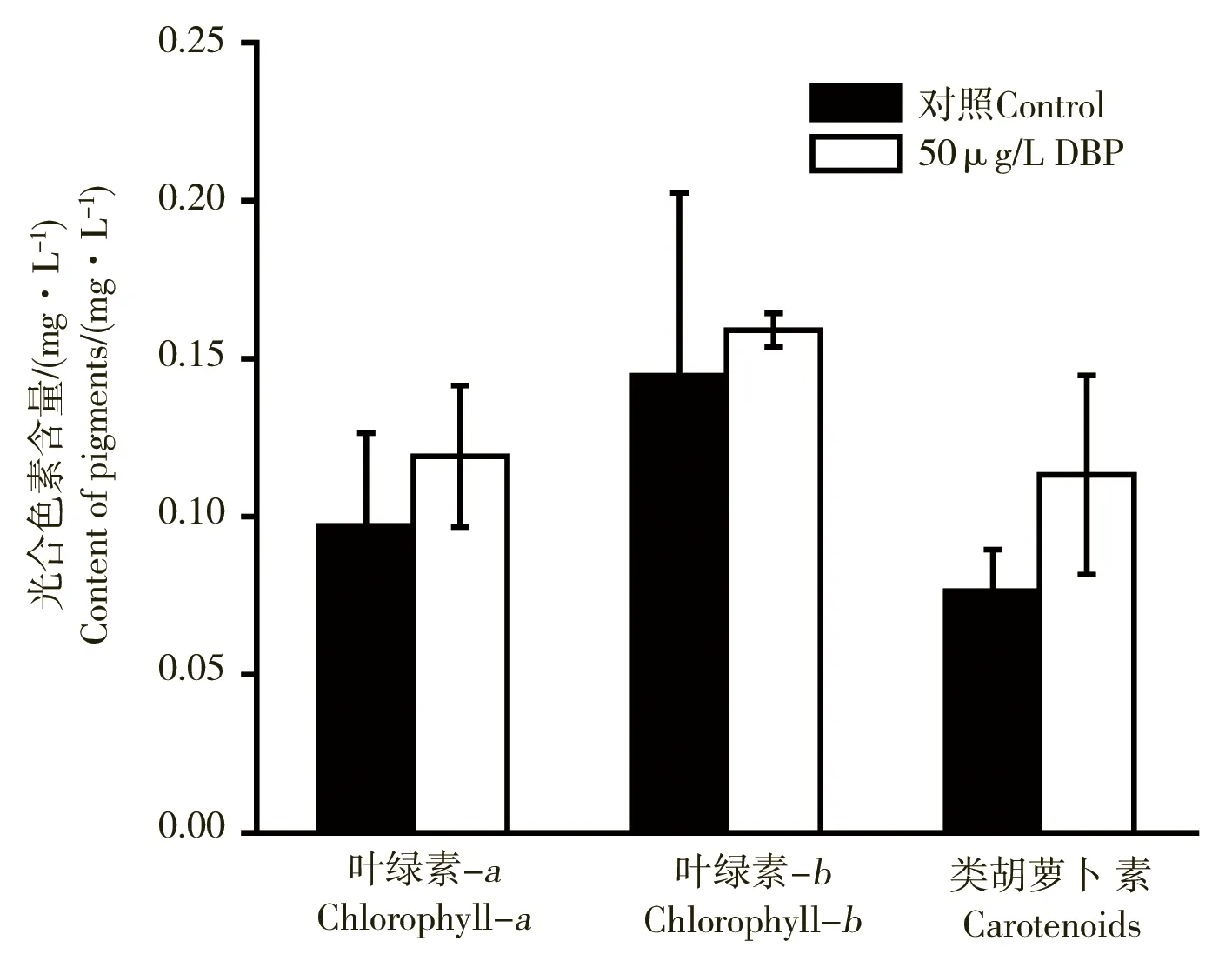
图3 DBP(50 μg·L-1)暴露7天后,球形棕囊藻光合色素含量的变化Fig. 3 Effects of DBP (50 μg·L-1) on the content of pigments of Phaeocystis globosa after cultured for 7 days
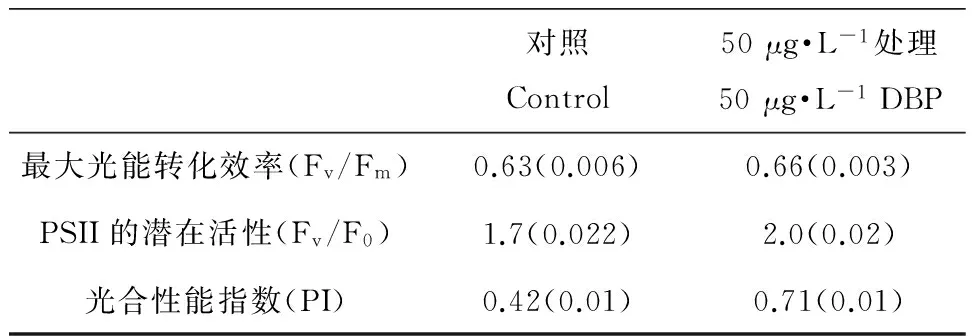
表2 DBP(50 μg·L-1)暴露7天后,球形棕囊藻的叶绿素荧光诱导参数
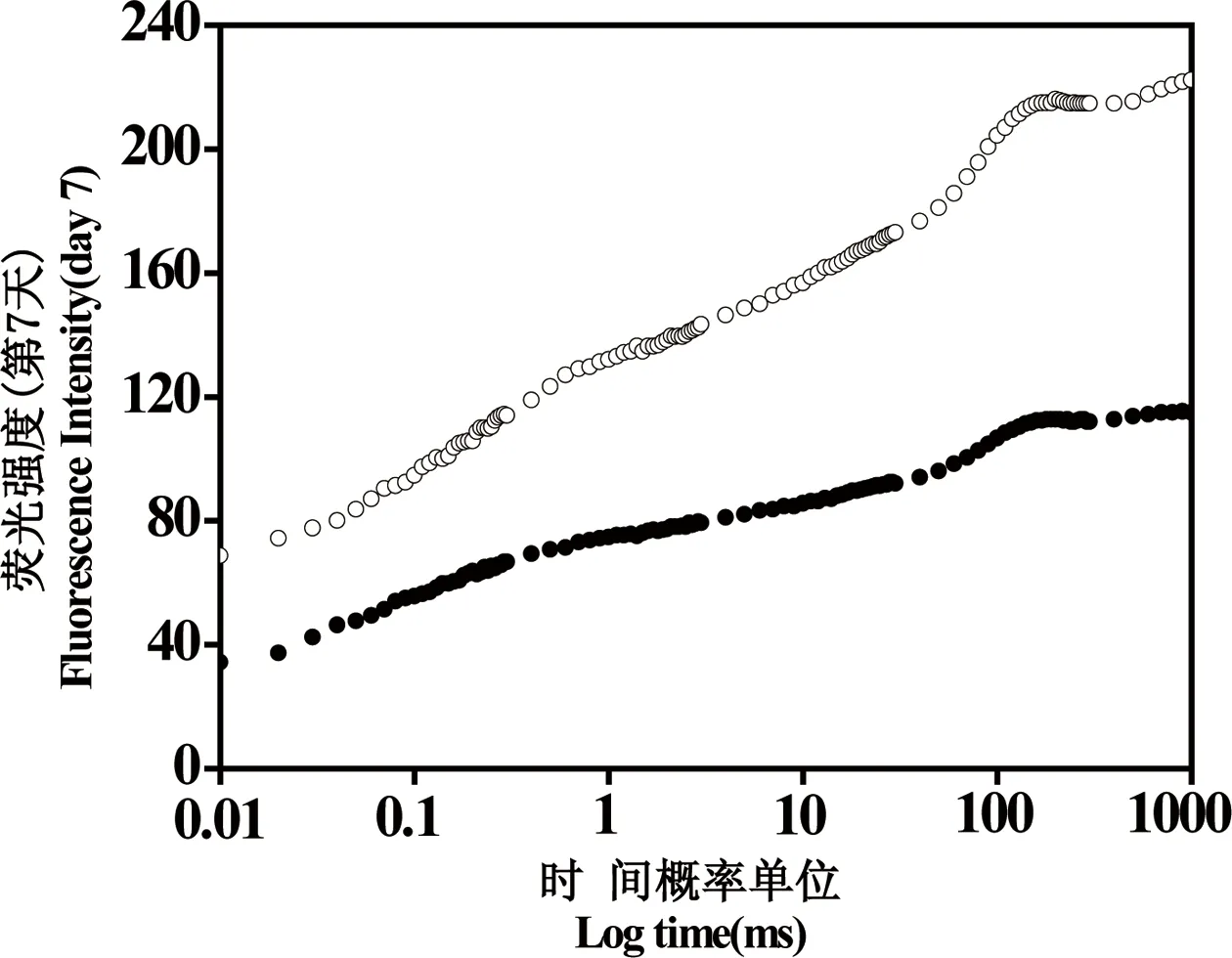
图4 DBP(50 μg·L-1)暴露7天后,球形棕囊藻的叶绿素荧光诱导曲线Fig. 4 Effects of DBP (50 μg·L-1) on chlorophyll a fluorescence transients of Phaeocystis globosa
3 讨论(Discussion)
3.1 DBP对海洋微藻生长的影响因种而异
DBP对不同受试藻的影响具有种间差异性,在低浓度(5~20 μg·L-1)下,受试微藻的生长率增加范围在5%~214%之间,DBP能够显著增加定鞭藻球形棕囊藻和小普林藻、甲藻东海原甲藻、隐藻红胞藻、绿藻海洋小球藻的生长率,然而对2种硅藻中肋骨条藻和三角褐指藻生长作用不显著。近年来随着增塑剂使用量不断增加,水体中DBP含量也随之升高,本研究结果显示,DBP浓度增加可能在一定程度上刺激有害赤潮藻定鞭藻类如球形棕囊藻和小普林藻的生长。其他研究显示,低浓度的DBP对藻类有一定的促进作用。如汪星[23]的研究发现1 mg·mL-1和2 mg·mL-1的DBP处理鱼腥藻时,暴露组藻密度高于对照组10%和20%,Acey等[24]也发现,10、100、500 nmol·L-1、1、10 μmol·L-1五个浓度的DBP不同程度的刺激了聚球藻聚集,使其生物量增加,10-6~10-7mol·L-1之间的DBP也可以促进小球藻的光合作用[25]。
若水环境中DBP含量持续上升,在≥50 μg·L-1DBP胁迫下,小普林藻、东海原甲藻生长率有所下降,硅藻中肋骨条藻生长受到抑制。随着DBP浓度增加,其会对藻类产生毒性作用[14-16]。野外数据显示,暴发赤潮时水体中DBP浓度显著增加,且其增加的倍数与发生赤潮的严重程度呈正相关[26],有毒赤潮藻球形棕囊藻在高浓度DBP(100 μg·L-1)下生长率显著增大,水体DBP含量的增加通过促进球形棕囊藻等有害赤潮藻的生长而提高其竞争优势,可能提高形成有害藻华的生态风险。海洋微藻组成了海洋食物链重要的一部分,藻对DBP不同的响应,生长率的不同,对浮游植物群落的改变、分布可能会有很大影响[24],在适宜环境条件下引发藻华。
3.2 DBP对海洋微藻生理生化的影响
光合色素是客观反映植物利用光照进行光合作用的重要指标,研究显示,在环境胁迫条件下,微藻光合色素含量下降,Alberte等[31]认为主要原因是叶绿体片层中捕光Chla/b-Pro复合体合成受到抑制,但也有研究发现,低浓度的DBP能够提高斜生栅藻光合色素的含量[32]。本研究结果显示,50 μg·L-1DBP能够刺激球形棕囊藻光合色素含量提高,球形棕囊藻的最大光能转化效率、PSII潜在活性、光合性能指数均有所增加,说明DBP促进球形棕囊藻进行光合作用,这与球形棕囊藻生长率增加的结果相符,结合前面抗氧化系统的响应,球形棕囊藻能够及时清除DBP对其危害,DBP甚至能够刺激球形棕囊藻的生长,表明在DBP环境污染日益严重的形势下,球形棕囊藻具有生长优势并可能在适宜的条件下形成有害藻华。
[1] Staples C A, Adams W J, Parkerton T F, et al. Aquatic toxicity of eighteen phthalate esters[J]. Environmental Toxicology and Chemistry, 1997, 16(5): 875-891
[2] 刘慧杰, 舒为群. 邻苯二甲酸酯类化合物的毒理学效应及对人群健康的危害[J]. 第三军医大学学报, 2005, 26(19): 1778-1781
Liu H J, Shu W Q. Toxicological effect and risks of phthalate acid esters on the health of population [J]. Academlae Medicinae Militaris Tertiae, 2005, 26(19): 1778-1781 (in Chinese)
[3] 任仁. 警惕邻苯二甲酸酯污染[J]. 大学化学, 2003, 18(6):33-36
[4] 刘春晓. DBP对铜绿微囊藻生长和抗氧化酶的影响[D]. 南京: 南京农业大学, 2013
Liu C X. Effects of di-butyl phthalate on growth and enzymatic antioxidants of Microcytis aeruginosa[D]. Nanjing: Nanjing Agricultural University, 2013 (in Chinese)
[5] 白璐, 姬亚芹, 莫笑萍, 等. 水中邻苯二甲酸酯的研究进展[J]. 给水排水, 2010, 36(6): 121-124
[6] 陆洋, 袁东星, 邓永智. 九龙江水源水及其出厂水邻苯二甲酸酯污染调查[J]. 环境与健康杂志, 2007(9): 703-705
Lu Y, Yuan D X, Deng Y Z. Investigation of Jiulong Riverwater source pollution by phthalates [J]. Journal of Environment and Health, 2007(9): 703-705 (in Chinese)
[7] 张付海, 张敏, 朱余. 合肥市饮用水和水源水中邻苯二甲酸酯的污染现状调查[J]. 环境监测管理与技术, 2008(2): 22-24
[8] 叶常明, 魏爱雪. 水体有机污染的原理研究方法及应用[M]. 北京: 海洋出版社, 1990: 202-204
[9] 庄婉娥, 姚文松, 汪夏霞, 等.泉州湾海水及沉积物中邻苯二甲酸酯的分布及化学组成[J]. 环境与健康杂志, 2011, 28(10): 898-902
Zhuang W E, Yao W S, Wang X X, et al. Distribution and chemical composition of phthalate esters in seawater and sediments in Quanzhou Bay, China [J]. Journal of Environment and Health, 2011, 28(10): 898-902 (in Chinese)
[10] 贺涛, 许振成, 魏东洋, 等. 珠江流域湖库型水源集水区酞酸酯(PAEs)类污染物环境健康风险评估[J]. 生态与农村环境学报, 2014, 30(6): 699-705
He T, Xu Z C, Wei D Y, et al. Environmental health risk assessment of phthalic acid esters like pollutants in reservoir or lake type water source catchments in the Pearl River Basin [J]. Journal of Ecology and Rural Environment, 2014, 30(6): 699-705 (in Chinese)
[11] 李婷. 珠江河口水体和沉积物中6种邻苯二甲酸酯污染及初步风险评价[D]. 广州: 暨南大学, 2014
Li T. Pollution levels and risk assessment of 6 priority phthalate esters in water and sediments from estuaries of the Pearl River Delta [D].Guangzhou: Jinan University, 2014 (in Chinese)
[12] Howard P H, Boethling R S, Jarvis W F, et al. Handbook of environmental degradation rates [M]. CRC Press, 1991
[13] 胡芹芹, 熊丽, 田裴秀子, 等.邻苯二甲酸二丁酯(DBP)对斜生栅藻的致毒效应研究[J]. 生态毒理学报, 2008, 3(1): 87-92
Hu Q Q, Xiong L, Tianpei X Z, et al. Toxic effects of dibutyl phthalate (DBP) on Scenedesmus obliquus [J]. Asian Journal of Ecotoxicology, 2008, 3(1): 87-92 (in Chinese)
[14] Wang Z, Hu F, Song W, et al. Chronic toxic effect of three estrogens to algae (Scenedesmus obliquus)[C]//Human Health and Biomedical Engineering (HHBE). 2011 International Conference, IEEE, 2011: 877-880
[15] Wang L, Tang L Y, Wei C X, et al. Di-(2-ethylhexyl) phthalate toxic effect on Scenedesmus obliquus evaluated by the biomakers of inhibition rate and pigment content[C]//Bioinformatics and Biomedical Engineering (iCBBE). 2010 4th International Conference, IEEE, 2010: 1-4
[16] 杨慧丽, 段舜山. 邻苯二甲酸二丁酯对三角褐指藻的生态毒性效应[J]. 生态环境学报, 2010, 19(9): 2155-2159
Yang H L, Duan S S. The ecological toxic effects of dibutyl phthalate on Phaeodactylum tricornutum [J]. Ecology and Environmental Sciences, 2010, 19(9): 2155-2159 (in Chinese)
[17] 迟杰, 刘华, 郎铁柱. 普通小球藻与DBP的相互作用[J]. 环境科学与技术, 2005, 28(2): 26-28
Chi J,Liu H, Lang T Z. Interaction between dibutyl phthalate and Chlorella vulgaris[J]. Environmental Science and Technology, 2005, 28(2): 26-28 (in Chinese)
[18] 迟杰, 董林林, 李金娟. 铜绿微囊藻对DBP和DEHP的富集和降解特性[J]. 天津大学学报, 2007, 39(12): 1395-1398
Chi J,Dong L L, Li J J. Characteristics of accumulation and biodegradation of DBP and DEHP in Microcystis aeruginosa [J]. Journal of Tianjin University, 2006, 39(12): 1395-1398 (in Chinese)
[19] 阎海, 雷志芳, 叶常明. 斜生栅藻降解邻苯二甲酸二甲酯和苯胺的动力学研究[J]. 环境科学学报, 1998, 18(2):216-220
Yan H, Lei Z F, Ye C M. Kinetics of the biodegradation of dimethyl phthalate and aniline by Scenedesmus obliqnus[J]. Acta Scientiae Circumstantiae, 1998, 18(2): 216-220 (in Chinese)
[20] Chen J F, Xu N, Jiang T J, et al. A report of Phaeocystis globosa bloom in coastal water of Southeast China[J]. Journal of Jinan University Natural Science and Medicine Edicine, 1999, 20: 124-129
[21] Wang Y, Qi Y, Li S. Nutritional requirements for the growth of Phaeocystis globosa scherffei [J]. Acta Hydrobiologica Sinica, 2007, 31(1): 29
[22] Force L, Critchley C, van Rensen J J S. New fluorescence parameters for monitoring photosynthesis in plants[J]. Photosynthesis Research, 2003, 78(1): 17-33
[23] 汪星. 类激素对蓝藻生长的影响及其环境效应研究[D]. 武汉: 华中科技大学, 2006
Wang X.Effects of generic incretion on the growth of blue-green algae and environment [D].Wuhan: Huangzhong University of Science and Technology, 2006(in Chinese)
[24] Acey R, Healy P, Unger T F, et al. Growth and aggregation behavior of representative phytoplankton as affected by the environmental contaminant di-n-butyl phthalate [J]. Bulletin of Environmental Contamination and Toxicology, 1987, 39(1): 1-6
[25] Melin C, Egnéus H. Effects of di-n-butyl phthalate on growth and photosynthesis in algae and on isolated organelles from higher plants[J]. Physiologia Plantarum, 1983, 59(3): 461-466
[26] 赵明桥, 李攻科, 栾天罡, 等. SPME-GC-MS法测定海水中PEs及与赤潮关系[J]. 中山大学学报, 2000, 39(3): 54-58
Zhao M Q, Li G K, Luan T G, et al.Determination of phthalic esters in seawater by SPME-GC-MS and the concentration variations of phthalic esters in redtide seawater [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2009, 39(3): 54-58 (in Chinese)
[27] 尹永强, 胡建斌, 邓明军.植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J].植物生理科学,2007,23(1): 105-110
Yi Y Q, Hu J B, Deng M J. Latest development of antioxidant system and responses to stress in plant leaves [J]. Chinese Agricultural Science Bulletin, 2007,23(1): 105-110 (in Chinese)
[28] 唐海溶. 球形棕囊藻的营养生理及两种重要的抗氧化酶-SOD和CAT活性的研究[D]. 广州: 暨南大学, 2006
Tang H R. The study on nutrient physiology and two important antioxidiant enzyme—SOD and CAT acitvity of Phaeocystis globosa [D]. Guangzhou: Jinan University, 2006 (in Chinese)
[29] Tripathi B N, Metha S D, Amar A, et al. Oxidative stress in Scenedesmus sp.during short-and long-term exposure to Cu2+and Zn2+[J]. Chemosphere, 2006, 62: 538-544
[30] 唐学玺, 李永祺. 久效磷对海洋微藻毒性机理的初步研究Ⅲ. 超氧化物歧化酶和过氧化物酶活性的变化[J]. 环境科学学报, 1998, 18(2): 204-207
Tang X X, Li Y Q. Monocrotophos on marine microalgae Ⅲ. Changes of activity of superoxide dismutase and peroxidase [J]. Acta Scientiae Circumstantiae, 1998, 18(2): 204-207 (in Chinese)
[31] Alberte R S, Friedman A L, Gustafson D L, et al. Light - harvesting systems of brown algae and diatoms. Isolation and characterization of chlorophyll a/c and chlorophyll a fucoxanthin pigment - protein complexes [J]. Biochimica et Biophysica Acta, 1981, 635(2): 304- 316
[32] 刘碧云, 周培疆, 李佳洁, 等. 丙体六六六对斜生栅藻生长及光合色素和膜脂过氧化影响的研究[J]. 2006, 25(1): 204-207
Liu B Y, Zhou P J, Li J J, et al. Effects of γ-HCH on the growth and photosysytem and lipid peroxidation of Scenedesmus Obliqnus Kütz [J]. 2006, 25(1): 204-207 (in Chinese)
◆
Effects of Dibutyl Phthalate(DBP) on the Growth of Marine Microalgae
Huang Bozhu1, He Rui2, Sun Kaifeng3, Duan Shunshan1, Xu Ning1,*
1. Department of Ecology, Institute of Hydrobiology, Jinan University, Guangzhou 510632, China 2. Pearl River Hydraulic Research Institute, Guangzhou 510611, China 3. Research Center of Offshore Marine Environment, South China Institute of Environmental Sciences, MEP, Guangzhou 510655, China
Received 30 November 2015 accepted 26 January 2016
In order to study the effects of DBP on the growth, antioxidant system and photosynthesis of marine algae, seven marine algae, including Prorocentrum donghaiense, Prymesium parvum, Phaeocystis globosa, Skeletonema costatum, Phaeodactylum tricornutum, Rhodomonus salina, and Chlorella sp. were exposed to DBP at concentration gradients of 5, 10, 20, 50, 100 μg·L-1and a control. Chlorophyll fluorescence were measured each day. T-SOD, CAT, MDA pigment contents and chlorophyll fluorescence of P. globosa were determined during the experiment at concentration of 50 μg·L-1DBP. Results showed that, growth of P. globosa, P. parvum, P.donghaiense, Chlorella sp. and R. salinawere significantly higher than the controls in all treatments (P<0.01). DBP had inhibition effect on S. costatum at 50 and 100 μg·L-1treatments (P<0.01). There was no significant difference in all P. tricornutum treatments compared with the control. SOD, CAT activities and MDA values of P. globosa cultures increased at first and decreased subsequently during the experiments. At day 7, the contents of chlorophyll a, b and carotenoids were increased by 23%, 10%, and 48% respectively, and the maximal photochemical efficiency of PSII (Fv/Fm), the potential activity of PSII (Fv/F0) and performance index (PI) were also increased by 4.8%, 16%, and 69% respectively. DBP displayed species-specific influences on marine microalgae, and significantly promoted the growth of P. globosa. Increasing concentration of DBP at coastal water may change the community composition of phytoplankton and increase the risk of harmful algal blooms.
dibutyl phthalate; marine algae; growth; SOD; CAT; MDA; photosynthrtic pigment
10.7524/AJE.1673-5897.20151130005
国家自然科学基金项目(41576159,21307140,U1133003);
黄博珠(1990-),女,硕士研究生,研究方向为藻类生理生态学,E-mail: bozhuhuang258@163.com
*通讯作者(Corresponding author), E-mail: txuning@163.com
2015-11-30 录用日期:2016-01-26
1673-5897(2016)2-292-08
X171.5
A
简介:徐宁(1971-),女,研究员,硕士生导师,主要从事藻类生理生态方面的研究,发表各类论文40篇
黄博珠, 何瑞, 孙凯峰, 等. 邻苯二甲酸二丁酯对海洋微藻生长的影响[J]. 生态毒理学报,2016, 11(2): 292-299
Huang B Z, He R, Sun K F, et al. Effects of dibutyl phthalate (DBP) on the growth of marine microalgae [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 292-299 (in Chinese)

