壬基酚对多刺裸腹溞连续世代的毒性效应
唐思,刘伟杰,段舜山
暨南大学 水生生物研究中心,广州 510632
壬基酚对多刺裸腹溞连续世代的毒性效应
唐思,刘伟杰,段舜山
暨南大学 水生生物研究中心,广州 510632
为探讨典型环境激素壬基酚(nonylphenol,NP)对枝角类浮游动物多刺裸腹溞连续世代的毒性效应,在实验室条件下,暴露连续3个世代(F0、F1、F2)多刺裸腹溞于0.02~0.10 mg·L-1的NP。15 d后测定成体死亡率、首胎繁殖时间、后代数目、成体蜕皮次数以及终点体长。研究结果表明,NP对F0代多刺裸腹溞具有很高的致死率;随着世代的增加,在相同NP质量浓度暴露下,与母代成体的死亡率相比,子代多刺裸腹溞成体的死亡率增高,致死毒性放大;NP对多刺裸腹溞连续3个世代的繁殖力都有显著抑制作用(P <0.05),并随着世代递增,NP对子代繁殖力的抑制增强;在NP暴露下,多刺裸腹溞F0首胎繁殖时间明显推迟,NP暴露浓度与延迟程度呈正相关,呈现出剂量-效应关系,首胎繁殖时间延迟的趋势也存在于F1、F2世代中且存在放大效应;但是连续3个世代多刺裸腹溞成体的蜕皮次数都不受NP暴露影响;F0和F1世代多刺裸腹溞终点体长降低,并呈现明显的剂量-效应关系,但与F1相比,F2低浓度处理组受试个体终点体长呈增加趋势。对结果进行分析,认为多刺裸腹溞在NP暴露后的母代DNA或DNA完整性遭到破坏导致子代在相同NP质量浓度暴露下更容易受到NP致死性的影响;NP化合物具有的苯酚结构抑制枝角类体内葡萄糖、硫酸盐与类固醇的结合,从而引起体内荷尔蒙水平异常,最终对诸如生殖等生理行为造成不利影响;多刺裸腹溞成体的蜕皮次数都不受NP暴露影响表明蜕皮激素系统未受到干扰,且NP对生长的影响显然存在蜕皮外的其他作用机制。
壬基酚;多刺裸腹溞;连续世代
壬基酚(nonylphenol,NP)属于壬基酚聚氧乙烯醚(nonylphenol ethoxylates,NPEOs)衍生物[1]。NPEOs是全球第二大商用非离子表面活性剂[2],在纺织、塑料、造纸、化肥、农药、食品、医药等方面广泛应用[3],与人类生活关系密切。NPEOs经各种途径进入水体后,可降解为NP以及短链NPEOs产物[4],与母体相比、NP更加稳定,生物毒性也明显上升[5]。NP对人类和动物个体的生理、生殖以及子代发育产生负面影响[6-8],同时NP还具有很强的致畸、致癌、致突变效应[9-10]。联合国环境保护署(UNEP)把NP列入27种优先控制持久性污染物名单。欧盟水框架指令把NP及其短链母体化合物制定为优先控制污染物质。虽然我国已经展开对NP的生态风险评价研究,但仍然缺乏水体环境中NP长期性污染状况与生态风险的研究。
枝角类浮游动物是淡水生态系统食物链的重要组成部分,对维持水域生态系统的结构与功能稳定十分重要[11]。同时,由于枝角类浮游动物个体小、繁殖快、易于培养且对环境污染物敏感等优点使其成为生态毒理学研究的重要受试生物[12]。
在枝角类毒理学研究中,大型溞(Daphnia magna)由于众多优点被认为是国际上标准受试生物,但由于其全球范围内分布不均匀,在热带和亚热带水体中并不常见,因此仅针对大型溞毒理学研究显得并不全面[13]。本实验采用多刺裸腹溞作为受试生物,多刺裸腹溞(Moina macrocopa)属于甲壳纲(Crustacean)、枝角亚目(Cladocera)、裸腹溞属(Moina),广泛分布于全球范围内,在各国水体中均有出现,较多分布在热带水域[14]。迄今为止,已经有不少关于环境激素对枝角类浮游动物的干扰效应研究,但多半集中在急性毒性和单一世代的亚慢性毒性研究,对枝角类连续世代的毒理学研究十分稀少。本文以多刺裸腹溞为研究对象,研究了NP对连续3个世代(F0、F1、F2)多刺裸腹溞的毒性效应,以期揭示污染物进入水体后对浮游动物的长期干扰效应,丰富NP的生态毒理学数据,为制定相应的受NP污染环境的监测与治理提供科学依据。
1 材料与方法 (Materials and methods)
1.1 实验材料
本研究使用的多刺裸腹溞于2009年从广东省惠州西湖示范区水域采集分离,经鉴定后驯化培养。实验采用经多代孤雌生殖的单克隆株系。饵料藻种为羊角月牙藻(Selenastrum capricornutum),为本课题组藻种库长期培养藻种。壬基酚(nonylphenol,NP),纯度≥99.0%,购自美国Sigma Aldrich试剂公司;丙酮,分析纯(AR),购自广州化学试剂厂。实验所使用试剂均现配现用。
1.2 多刺裸腹溞的培养
多刺裸腹溞在室内条件下,用M4培养基配方配制的稀释水作为培养液培养[15],配制用水为曝气超过24 h以上的超纯水,重组培养液含氧量≥80%。自然光照下培养,培养温度为(25±1) ℃,每周更换3次培养液,定时定量投喂饵料藻,投喂密度为105cells·mL-1[15]。
1.3 急性毒性实验
急性毒性实验方法参照OECD(2004)[16]及GB/T(2008)[17]关于大型溞(溞类)急性毒性实验的方法。急性毒性实验受试个体采用孤雌生殖单克隆株系幼体(<24 h)。实验在100 mL烧杯中进行,通过预实验,以丙酮为助溶剂配制6个NP质量浓度(15、30、60、120、240、480 μg·L-1),同时设置空白对照以及助溶剂丙酮对照组(丙酮含量为0.5‰)。每个质量浓度处理设置4个平行,每个平行烧杯中加入50 mL培养液,10只幼溞,在空调房中进行实验,温度设为(25±1) ℃,光周期为16 h:8 h。整个实验过程无饵料藻投喂,24 h后观察,记录每个烧杯中溞个体死亡数(轻微晃动稍微15 s后,于烧杯底部不能自由游动者视为死亡)[18]。实验结果使用一元线性回归方程计算出NP对多刺裸腹溞的24 h 半数效应浓度(24 h-EC50)。
1.4 连续世代毒性实验
NP对连续世代多刺裸腹溞的毒性实验方法参照上述急性毒性实验的实验方法以及OECD(2004)大型溞繁殖实验标准修改,设计进行。实验进行前,选取同批次孤雌生殖单克隆株系幼体30只,于500 mL烧杯中进行扩大培养,选取第3胎次的新生幼体进行毒性实验。实验在50 mL比色管中进行,每个比色管加入40 mL培养液,加入1只幼溞(<12 h),根据24 h-EC50值和尽量降低受试生物死亡率的前提设计NP处理浓度,多刺裸腹溞各处理组浓度分别设置为0.02、0.04、0.06、0.08、0.10 mg·L-1,每个处理组设置,10个平行。每天更换1次培养液,并定时定量投喂饵料藻。从F0中取幼溞用于F1代实验,NP处理质量浓度与F0相同,实验一直持续到F2代。实验开始后,每天定时观察,记录每个世代的首胎繁殖时间、后代数目、成体蜕皮数已及死亡个体,每一世代毒性实验持续15 d后,测量存活个体体长,体长为个体眼部到甲壳末端的距离。
1.5 数据处理与分析
采用SSPS 17.0软件(SPSS Inc.)对实验数据进行方差分析和回归分析。采用ANOVA方法分析NP暴露组与空白对照组之间的差异,P < 0.05表示差异显著。
2 结果(Results)
2.1 急性毒性实验
NP对多刺裸腹溞的急性毒性实验结果见表1。实验结果显示NP对多刺裸腹溞的24 h-EC50为110.7 μg·L-1,表明NP对多刺裸腹溞有明显的毒性作用。
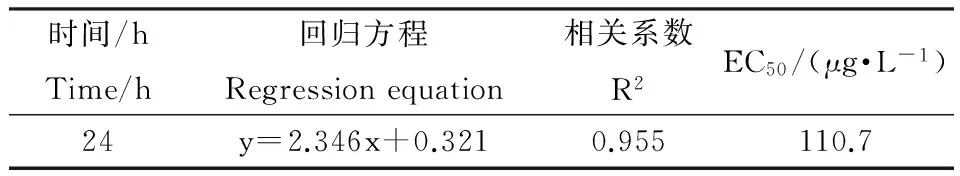
表1 壬基酚对多刺裸腹溞的急性毒性
根据化学物质对溞类的毒性评价标准[19],NP的毒性等级为极高毒。在实验进行的24 h内,0.5‰丙酮助溶剂对照组的多刺裸腹溞的存活率与空白对照组无明显差异,表明0.5‰丙酮助溶剂对多刺裸腹溞的存活无影响。
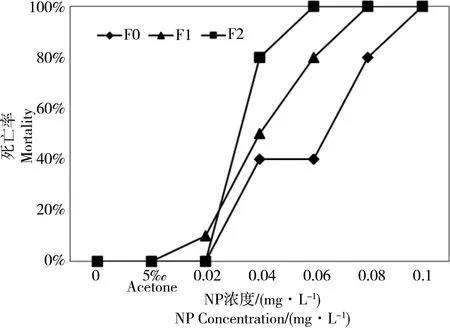
图1 NP暴露下多刺裸腹溞的死亡率Fig. 1 Mortality of M. marcocopa under NP exposure
2.2 NP对多刺裸腹溞死亡率的影响
不同质量浓度NP对连续3个世代多刺裸腹溞的死亡率的影响见图1。由图1可知,NP对F0受试生物有很强的致死毒性,且随着世代的增加,NP对于多刺裸腹溞的毒性呈逐渐增强的趋势,表现为母代F0处理组的多刺裸腹溞在处理浓度高于0.04 mg·L-1时,死亡率达到40%,并随着处理浓度的增加而显著升高,最高浓度处理组的死亡率达到100%;当暴露处理持续到子一代F1和子二代F2时,0.04 mg·L-1处理组的死亡率已经分别达到50%和80%,100%致死浓度也降低至0.08 mg·L-1和0.06 mg·L-1。由于最高浓度0.1 mg·L-1处理组受试个体死亡时没有后代个体产生,因此在生长繁殖的相关指标中不参与讨论。实验中,与空白对照组相比,0.5%丙酮助溶剂对照组对受试生物的首胎生殖时间、后代数目、成体蜕皮次数、死亡率和终点体长均无明显影响,以下不再讨论。
2.3 NP对多刺裸腹溞后代数目的影响
NP对连续世代多刺裸腹溞后代繁殖数的影响如图2所示。结果表明,NP对多刺裸腹溞具有生殖毒性,3个世代暴露处理后的多刺裸腹溞后代数量显著减少(P < 0.05),表现出明显的剂量-效应关系,并且随着世代的增加繁殖方面的毒性效应表现出明显的上升趋势。从图2可以看出,母代F0处理组,当NP暴露质量浓度为0.04 mg·L-1时, 与对照组相比,该处理组累积后代数目减少了11.2%;随着世代的增加,子一代F1繁殖数量减少更为显著,F1累计后代数目降低了42.6%;在子二代F2时,累计后代数目降低了57.3%。
2.4 NP对多刺裸腹溞首胎繁殖时间的影响
NP暴露处理对多刺裸腹溞首胎繁殖时间的影响如图3所示。由图3可以看出,NP暴露处理可以造成多刺裸腹溞首胎繁殖时间延后,并表现为随着处理浓度的增加滞后效应愈发显著。随着世代的增加,NP对多刺裸腹溞首胎繁殖时间的滞后效应明显增强,在0.04 mg·L-1暴露下,与空白对照组相比,F0、F1、F2处理组的首胎繁殖时间分别延长了13.8%、25.5%、44.5%;在0.06 mg·L-1NP暴露下时,F2首胎繁殖时间延迟高达空白对照组的112.6%,极大推迟了F2代的首胎繁殖时间。
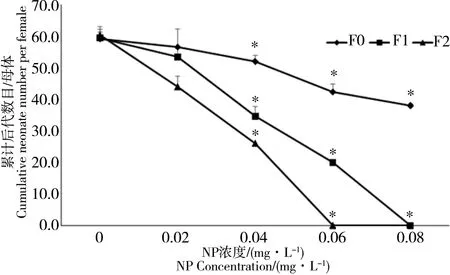
图2 NP暴露下多刺裸腹溞累计后代数目/母体 注:*表示与对照有显著差异(P<0.05);a结果为排除了死亡个体影响后,每处理10个平行的平均值(±标准差)。Fig. 2 Cumulative neonate number per female of M. marcocopa under NP exposure Note: * stands for significant difference compared with CK (P< 0.05); a Results are summarised as the mean of 10 replicates per treatment (±standard deviation) when excluding the dead.
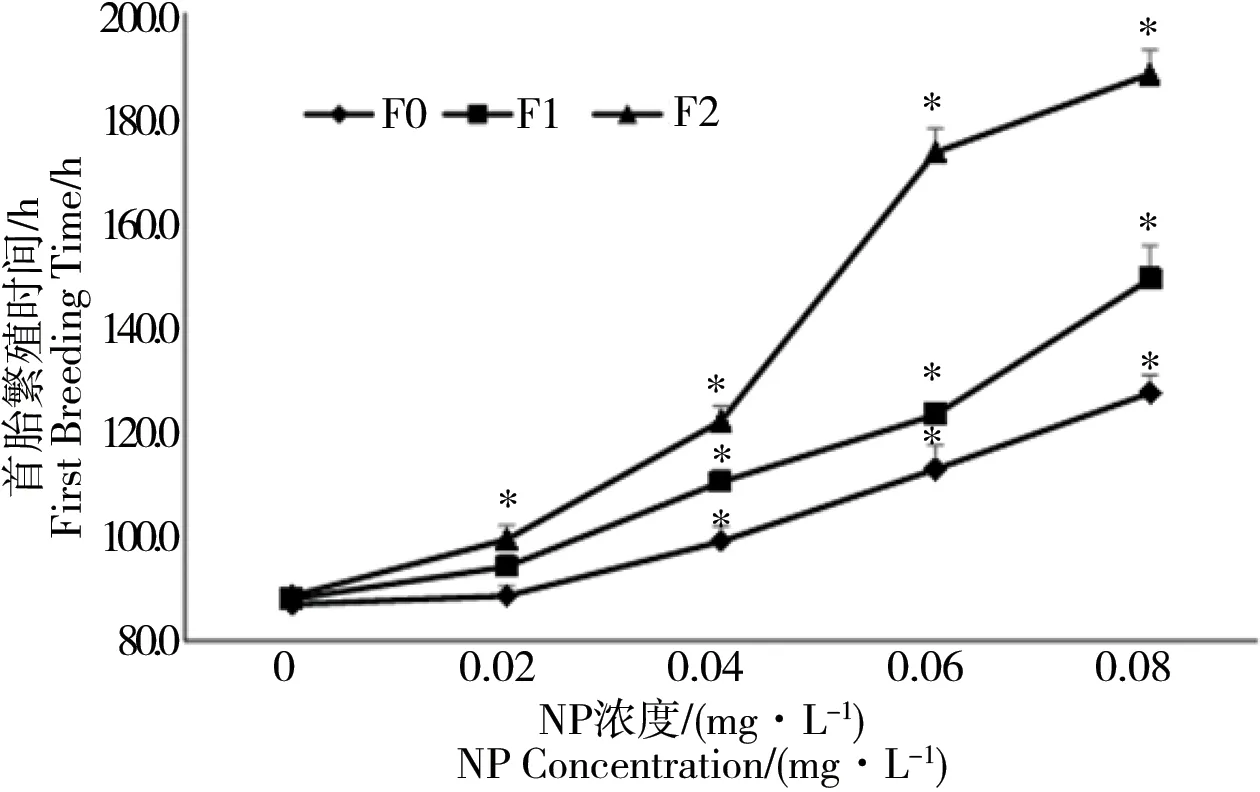
图3 NP暴露下多刺裸腹溞首胎繁殖时间 注:*表示与对照有显著差异(P<0.05);a结果为排除了死亡个体影响后,每处理10个平行的平均值(±标准差)。Fig. 3 First breeding time of M. marcocopa under NP exposure Note: * stands for significant difference compared with CK (P< 0.05); a Results are summarized as the mean of 10 replicates per treatment (±standard deviation) when excluding the dead.
2.5 NP对多刺裸腹溞成体蜕皮的影响
NP对多刺裸腹溞蜕皮的影响如图4所示。结果表明,与上述研究指标不同,在所有的NP暴露处理组中,多刺裸腹溞连续3个世代(F0、F1、F2)的蜕皮次数与空白对照组相比,均无显著变化,说明NP对多刺裸腹溞的蜕皮行为并不能造成表观上的影响。

图4 NP暴露下成体多刺裸腹溞的蜕皮次数 注:a结果为排除了死亡个体影响后,每处理10个平行的平均值(±标准差)。Fig. 4 Mouting frequencies of adult M. marcocopa under NP exposure Note: a Results are summarized as the mean of 10 replicates per treatment (±standard deviation) when excluding the dead.
2.6 NP对多刺裸腹溞终点体长的影响
连续3个世代多刺裸腹溞是在NP暴露处理下终点体长响应情况,如图5所示。NP暴露处理,与空白对照组相比,母代F0多刺裸腹溞的生长受到显著抑制(P <0.05),0.06 mg·L-1和0.08 mg·L-1处理组,终点个体体长较对照组分别减少了24.8%、33.6%。而就不同世代之间来言,与F0相比较,NP对F1受试生物生长的抑制增加,导致其终点体长减少更加显著。然而,在0.04 mg·L-1NP质量浓度暴露下,F2终点体长较F1增加了5%。

图5 NP暴露下成体多刺裸腹溞的终点体长 注:a结果为排除了死亡个体影响后,每处理10个平行的平均值(±标准差)。Fig. 5 Final body length of adult M. marcocopaunder NP exposure Note: a Results are summarized as the mean of 10 replicates per treatment (±standard deviation) when excluding the dead.
3 分析与讨论(Analyze and discussion)
近十年来,环境激素在我国湖泊、河流、河口以及海洋等众多水体中不断被检测出来[20-23],某些水域的环境激素污染十分严重[24-25],给整个水域生态系统带来极大的压力和危害。NP是环境激素污染物的典型代表,其通过工业污水、城市生活污水等多种途径进入水体环境,以其高毒性,难降解等特点对整个水域生态系统造成不良影响及潜在危害。目前已经有大量关于NP对水生生物和水生态系统污染和危害的报道。郭匿春和谢平[26]以隆线溞和微型裸腹溞为受试对象,研究了NP对其生活史的干扰效应,结果表明NP对隆线溞生活史、后代存活率有不利影响;Wang等[27]研究发现在NP暴露下,受试对象(Neocaridina heteropoda)的过氧化物歧化酶活性受到极大影响;Kang等[28]研究了NP对成年日本青鳉的繁殖力的影响,研究发现NP暴露导致青鳉产卵数目显著降低。
本文以在各国水体环境中广泛分布的枝角类浮游动物多刺裸腹溞为研究对象,研究了NP对多刺裸腹溞的急性毒性和连续3个世代亚慢性毒性。急性毒性实验结果显示NP对多刺裸腹溞24 h-EC50值为110.7 μg·L-1,此结果比Brennan等[29]测定的NP对大型溞24 h-EC50值150 μg·L-1小,主要原因是多刺裸腹溞个体更小,甲壳更薄,对污染物的敏感性更高[30]。同时,此值与胡雪雷等[31]测定的NP暴露下多刺裸腹溞24 h-EC50154 μg·L-1的差异可能是由培养条件的不同造成的。在胡雪雷等的研究中,受试生物的培养温度为(20±1) ℃,本文则为(25±1) ℃。
多刺裸腹溞成体死亡率的实验结果表明NP对F0代成体具有很强的致死毒性。且随着世代的增加,在相同NP质量浓度暴露下,与母代相比,子代受试生物死亡率增高,致死毒性放大。此研究结果与Brennan等[29]关于NP对大型溞连续两个世代死亡率影响的结果相对一致。多刺裸腹溞在NP暴露后,造成母代DNA损伤[32]或引起DNA完整性遭到破坏[33],导致子代在相同NP质量浓度暴露下更容易受到NP致死毒性的影响。此随着世代增加,NP致死效应扩大的现象表明了进行NP多世代毒性研究的必要性,如果仅研究NP单一世代的毒性特征,此毒性放大现象将会被忽略。
NP对连续3个世代多刺裸腹溞的繁殖力都有显著的抑制作用(P <0.05)。F0多刺裸腹溞后代数目的抑制程度与NP暴露质量浓度正相关,呈现出明显的剂量-效应关系。值得注意的是,环境激素对生物体的作用具有一定的多样性,低浓度的环境激素可能对生物体有一定的刺激效应,本研究结果表明低浓度NP对受试生物繁殖力无刺激作用,也可以间接说明NP对受试生物的高生殖毒性。随着世代递增,NP对子代繁殖力的抑制增强。Brennan等[29]关于NP对连续世代大型溞后代数目的实验结果与本结果相近;Villarroel等[34]研究了农药四氯杀螨砜对多世代大型溞后代数目的影响,其结果也与本文类似。NP对多刺裸腹溞繁殖力的抑制一方面可能是因为NP具有苯酚结构,干扰枝角类体内激素相关的葡萄糖、硫酸盐与类固醇的正常结合,引起生物体内激素水平异常,最终对诸如生殖等生理行为造成不利影响[35]。另一方面可能是因为NP干扰母代卵巢内卵母细胞对卵黄的吸收,扰乱卵细胞发育正常发育,抑制生物体繁殖[36]。而且,NP暴露下,受试生物摄食行为受到抑制,母体摄入的能量减少,能够分配用于繁殖的能量相对变少,后代数目也相对降低。
NP暴露下,多刺裸腹溞F0首胎繁殖时间明显推迟,NP暴露浓度与延迟程度呈正相关,呈现出剂量-效应关系。首胎繁殖时间延迟趋势也存在于F1和F2中,与上述NP对受试生物存活和繁殖力的毒性效应类似,随着世代增加,NP对首胎繁殖时间的延迟作用也存在放大效应。受试生物首胎繁殖时间的延迟可能是因为在NP暴露下,枝角类幼体的蜕皮受到抑制,生长延缓,发育至性成熟所需时间延长,造成首胎繁殖时间延后[37]。同时,幼体的生长发育受到NP干扰,与繁殖相关的蛋白质合成受到阻碍,首胎繁殖时间推迟。有文献指出,环境激素类污染物对受试生物的繁殖毒性,随着世代增加而增高[38-39];然而,也有研究表明,由于子代受试生物对污染物的适应,与母代相比,子代繁殖能力受污染物的抑制减弱,恢复到正常水平[40-41]。
蜕皮是枝角类浮游动物十分重要的生理过程,直接影响枝角类的生长和发育。本文关于受试生物成体蜕皮次数的结果显示,与空白组对照相比,连续3个世代多刺裸腹溞成体蜕皮次数均不受NP影响。Caspers[42]和Brennan等[29]的研究结果与本文相符合。枝角类的蜕皮由一个非常复杂的激素系统调控,其中蜕皮激素起关键作用,蜕皮激素在转录水平上和与DNA相连的蜕皮激素受体结合,调节生物体的蜕皮进程。但是,蜕皮激素受体对它们的配位体要求并不严格,甾族化合物、非甾族化合物都可以通过与蜕皮激素受体结合,干扰生物正常蜕皮。研究表明,外源化合物的化学结构与其是否能同蜕皮激素受体结合相关,高疏水性且含有循环结构的化合物更容易与蜕皮激素受体结合,干扰正常蜕皮[43]。
NP对多刺裸腹溞终点体长的影响是本文研究的最后一个指标。结果表明,在F0和F1中,与对照组相比,NP对多刺裸腹溞体长的抑制作用随着NP质量浓度的增加而增加。一般来讲,枝角类动物成体体长与其蜕皮次数相关,个体越大,需要的蜕皮次数越多。但是,实验结果显示受试生物在成体蜕皮次数并不受到NP干扰的情况下,终点体长仍然降低,说明NP通过干扰除蜕皮之外的其他生理过程抑制受试生物生长。F2代NP低浓度(0.04 mg·L-1)暴露组结果显示,受试生物终点体长比F1高5%,其原因一方面可能是在一定能量摄入的情况下,当生物的繁殖行为受到抑制,生物体可以分配用于生长的能量将增加;另一方面可能是随着世代的增加,受试生物开始适应低浓度NP暴露的环境,成体体长最终恢复甚至超过正常水平。
总的来讲,NP对多刺裸腹溞具有很强的毒性效应,且随着世代的增加,NP的毒性效应增强,并主要体现在繁殖方面。尽管NP暴露质量浓度比实际水体环境高中2~3个数量级,但鉴于多世代暴露下NP毒性的放大效应,其对水生态系统的危害不容忽视。
[1] Thiele B, Guenther K, Schwuger M J. Alkylphenol ethoxylates: Trace analysis and environmental behavior [J]. Chemical Reviews, 1997, 97(8): 3247-3272
[2] Wu W, Wu Y, Qu J H. Estrogenic activities and mutation effects of nonylphenol ethoxylates before and after biodegradation [J]. China Environmental Science, 2003, 23(5): 470-474
[3] Ying G G, Williams B, Kookana R. Environmental fate of alkylphenols and alkylphenol ethoxylates - A review [J]. Environment International, 2002, 28(3): 215-26
[4] Naylor C G, Mieure J P, Adams W J, et al. Alkylphenol ethoxylates in the environment [J]. Journal of Oil & Fat Industries, 1992, 69(7): 695-703
[5] Hu X, Zhou J, Duan S. Synergistic toxic effects of nonylphenol and nonylphenol ethoxylate on Moina macrocopa [J]. Ecology & Environmental Sciences, 2011, 20(11): 1725-1730
[6] Han X D, Tu Z G, Gong Y, et al. The toxic effects of nonylphenol on the reproductive system of male rats [J]. Reproductive Toxicology, 2004, 19(2): 215-221
[7] Chen J, Fu R. Chronic toxic effects of nonylphenol to male guppy [J]. Water Technology, 2012, 1(6): 1673-9353
[8] Arslan O C, Parlak H. Embryotoxic effects of nonylphenol and octylphenol in sea urchin Arbacia lixula [J]. Ecotoxicology, 2007, 16(6): 439-444
[9] Ren L, Marquardt M A, Lech J J. Estrogenic effects of nonylphenol on PS2, MUC1 and ER expressions in human breast cancer cells MCF7 [J]. Cancer Genetics & Cytogenetics, 1997, 98(2): 165
[10] Kuo C, Kuo D, Huang C, et al. Nonylphenol-induced apoptotic pathways in SCM1 human gastric cancer cells [J]. Drug Development Research, 2010, 71(2): 139-148
[11] Sommer U, Sommer F, Santer B, et al. Complementary impact of copepods and cladocerans on phytoplankton [J]. Ecology Letters, 2001, 4(6): 545-550
[12] Preuss T G, Telscher M, Ratte H T. Life stage-dependent bioconcentration of nonylphenol isomer in Daphnia magna [J]. Environmental Pollution, 2008, 156(3): 1211-1217
[13] Petrusek A. Moina (Crustacea: Anomopoda, Moinidae) in the Czech Republic: A review [J]. Acta Societatis Zoologicae Bohemicae, 2002, 66(3): 213-220
[14] Nandini S, Mayeli S M, Sarma S. Effect of stress on the life table-demography of Moina macrocopa [J]. Hydrobiologia, 2004, 526(1): 245-254
[15] Burak E S. Life tables of Moina macrocopa (Straus) in successive generations under food and temperature adaptation [J]. Hydrobiologia, 1997, 360(1-3): 101-107(7)
[16] Organisation for Economic Co-operation and Development (OECD). Guidelines for Testing of Chemicals. Daphnia sp. Acute Immobilisation Test [S]. OECD, 2004
[17] 中华人民共和国国家质量监督检验检疫总局; 中国国家标准化管理委员会. GB/T21830-2008化学品 溞类急性活动抑制试验[S]. 北京: 中国标准出版社, 2008
[18] Villegas-Navarro A, González M C R, López E R, et al. Evaluation of Daphnia magna as an indicator of toxicity and treatment efficacy of textile wastewaters [J]. Environment International, 1999, 25(5): 619-624
[19] 国家环境保护总局. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社, 2002: 1-784
[20] 王凌, 黎先春, 殷月芬, 等. 莱州湾水体中有机磷农药的残留监测与风险影响评价[J]. 安全与环境学报, 2007(3): 83-85
Wang L, Li X C, Yin Y F, et al. Organophosphate pesticide residue monitoring and risk assessment in the sea-water from Laizhou Bay [J]. Journal of Safety and Environment, 2007(3): 83-85 (in Chinese)
[21] 邵兵, 胡建英, 杨敏. 重庆流域嘉陵江和长江水环境中壬基酚污染状况调查[J]. 环境科学学报, 2004, 22(1): 12-16
Shao B, Hu J Y, Yang M. A survey of nonylphnol in aquatic environment of Chongqing valley [J]. Acta Scientiae Circumstantiae, 2004, 22(1): 12-16 (in Chinese)
[22] 吴兴让, 尹平河, 赵玲, 等. 珠江广州段水体微表层与次表层中多环芳烃的分布与组成[J]. 环境科学学报, 2010, 30(4): 868-873
Wu X, Yin P, Zhao L, et al. Distribution and composition of polycyclic aromatic hydrocarbons in the surface microlayer and the subsurface microlayer from the Guangzhou Section of the Pearl River [J]. Acta Scientiae Circumstantiae, 2010, 30(4): 868-873 (in Chinese)
[23] 王凌云, 张锡辉, 陶益. 城市污水处理厂内分泌干扰物浓度分布和去除规律[J]. 环境科学学报, 2012, 32(11): 2741-2747
Wang L Y, Zhang X H, Tao Y. Occurrence and removal of typical endocrine disrupting chemicals in sewage treatment plants [J]. Acta Scientiae Circumstantiae, 2012, 32(11): 2741-2747 (in Chinese)
[24] 邓利, 倪睿, 钟毅, 等. 深圳蛇口港及其临近海域海水有机锡污染[J]. 环境科学学报, 2008, 28(8): 1681-1687
Deng L, Ni R, Zhong Y, et al. Organotin compound contamination in Shekou harbor and its adjacent waters along the city of Shenzhen [J]. Acta Scientiae Circumstantiae, 2008, 28(8): 1681-1687 (in Chinese)
[25] 程军蕊, 徐继荣, 郑琦宏, 等. 宁波市城区河道水环境综合整治效果评价方法及应用[J]. 长江流域资源与环境, 2015, 24(6): 1060-1066
Cheng J R, Xu J R, Zheng Q H, et al.An evaluation framework for the effect of comprehensive treatments and application in Ningbo urban river [J]. Resources and Environment in the Yangtze Basin, 2015, 24(6): 1060-1066 (in Chinese)
[26] 郭匿春, 谢平. 双酚A和壬基酚对隆线溞和微型裸腹溞的毒性[J]. 水生生物学报, 2009, 33(3): 492-497
Guo N C, Xie P. The toxic effects of BPA and NP on D.carinata and M. micrura [J]. Acta Hydrobiologica Sinica, 2009, 33(3): 492-497 (in Chinese)
[27] Wang H W, Xu H M, Xiao G H, et al. Effects of selenium on the antioxidant enzymes response of Neocaridina heteropoda exposed to ambient nitrite [J]. Bulletin of Environmental Contamination & Toxicology, 2009, 84(1): 112-117
[28] Kang I J, Yokota H, Oshima Y, et al. Effects of bisphenol A on the reproduction of Japanese medaka (Oryzias latipes) [J]. Environmental Toxicology & Chemistry, 2002, 21(11): 2394-400
[29] Brennan S J, Brougham C A, Roche J J, et al. Multi-generational effects of four selected environmental oestrogens on Daphnia magna [J]. Chemosphere, 2006, 64(64): 49-55
[30] García G G, Nandini S, Sarma S S S. Effect of cadmium on the population dynamics of Moina macrocopa and Macrothrix triserialis (Cladocera) [J]. Bulletin of Environmental Contamination & Toxicology, 2004, 72(4): 717-724
[31] 胡雪雷, 周静韵, 段舜山. 壬基酚与壬基酚聚氧乙烯醚对多刺裸腹溞的复合毒性效应[J]. 生态环境学报, 2011, 20(11): 1725-1730
Hu X X, Zhou J Y, Duan S S. Synergistic toxic effects of nonylphenol and nonylphenol ethoxylate on Moina macrocopa [J]. Ecology and Environmental Sciences, 2011, 20(11): 1725-1730 (in Chinese)
[32] Atienzar F A, Billinghurst Z, Depledge M H. 4-n-nonylphenol and 17-beta estradiol may induce common DNA effects in developing barnacle larvae [J]. Environmental Pollution, 2002, 120(3): 735-738
[33] Li Z Y, Wei D. DNA damage caused by nonylphenol in oyster hemolymph cells [J]. Carcinogenesis Teratogenesis & Mutagenesis, 2006, 18(6): 469-471
[34] Villarroel M J, Ferrando M D, Sancho E, et al. Effects of tetradifon on Daphnia magna during chronic exposure and alterations in the toxicity to generations pre-exposed to the pesticide [J]. Aquatic Toxicology, 2000, 49(1-2): 39-47
[35] Baldwin W S, Graham S E, Shea D, et al. Metabolic androgenization of female Daphnia magna by the xenoestrogen 4-nonylphenol [J]. Environmental Toxicology & Chemistry, 1997, 16(9): 1905-1911
[36] Sumiya E, Ogino Y, Miyakawa H, et al. Roles of ecdysteroids for progression of reproductive cycle in the fresh water crustacean Daphnia magna [J]. Frontiers in Zoology, 2014, 11(1): 1-12
[37] Davies R, Zou E. Polybrominated diphenyl ethers disrupt molting in neonatal Daphnia magna [J]. Ecotoxicology, 2012, 21(5): 1371-1380
[38] Miriam Leon P, Erik S, Kraak M H S, et al. Multigeneration exposure of the springtail Folsomia candida to phenanthrene: From dose-response relationships to threshold concentrations [J]. Environmental Science & Technology, 2008, 42(18): 6985-90
[39] Kim H Y, Lee M J, Yu S H, et al. The individual and population effects of tetracycline on Daphnia magna in multigenerational exposure [J]. Ecotoxicology, 2012, 21(4): 993-1002
[40] Sánchez M, Andreu-Moliner E, Ferrando M D. Laboratory investigation into the development of resistance of Daphnia magna to the herbicide molinate [J]. Ecotoxicology & Environmental Safety, 2004, 59(3): 316-323
[41] Sabine D, Florian P, Franz B, et al. Single and combined toxicity of pharmaceuticals at environmentally relevant concentrations in Daphnia magna--A multigenerational study [J]. Chemosphere, 2010, 79(1): 60-66
[42] Caspers N. No estrogenic effects of bisphenol A in Daphnia magna straus [J]. Bulletin of Environmental Contamination & Toxicology, 1998, 61(2): 143-148
[43] Zou E, Fingerman M. Effects of estrogenic xenobiotics on molting of the water flea, Daphnia magna [J]. Ecotoxicology & Environmental Safety, 1997, 38(3): 281-285
◆
Toxic Effects of Nonyphenol on Successive Generations ofMoinamacrocopa
Tang Si, Liu Weijie, Duan Shunshan*
Center of Hydrobiology, Jinan University, Guangzhou 510632, China
Received 15 December 2015 accepted 1 March 2016
To explore the toxic effects of nonylphenol (NP), a typical environmental hormone, on Moina macrocopa through successive generations, three consecutive generations (F0, F1, F2) of this species were exposed to NP at concentrations ranging from 0.02 mg·L-1to 0.10 mg·L-1in laboratory, and adult mortality, first reproductive time, neonate number, adult molting frequencies and final body length were measured after a 15-d toxicity test. The results showed that NP caused marked mortality in F0animals. When treated with identical NP concentrations, the mortality of offspring generations increased with growing generations and the lethal effect was magnified compared to their mother generation. The reproductive abilities of three successive generation animals were remarkably inhibited (P < 0.05), and the reproductive inhibition in offspring generation was higher than parental generation. First reproductive time was significantly postponed in F0animals and the retardation was positively related to NP concentrations, indicating a dose-effect relationship; the delay trend in first reproductive time also existed in both F1and F2generations and exhibited a lengthening effect. However, there was little effect on adult molting frequencies in three successive generations. Final body length of F0and F1animals declined and showed a clear dose-effect relationship, but body length of F2animals showed an increasing trend compared to F1at low NP concentrations. The observations were interpreted as a result of damage in DNA or DNA integrity of mother generation after exposure to NP, leading to higher susceptibility to lethal effects of identical chemical concentration in offspring generation. The phenolic structure of NP can inhibit glucose and sulphate conjugation of steroids in cladocerans and cause abnormality in hormone level, which can adversely affect physiological processes such as reproduction. Adult molting frequencies were not affected by NP exposure, indicating that molting hormone system was not disturbed and the impacting mechanism of NP on growth may be controlled by a mechanism different from molting.
nonylphenol; Moina macrocopa; multigeneration
10.7524/AJE.1673-5897.20151215001
NSFC-广东联合基金重点项目(U1133003);国家自然科学基金项目(41176104,41476099)
唐思(1990-),男,硕士研究生,研究方向为浮游动物生理生态学,E-mail: si.tang1990@hotmail.com
*通讯作者(Corresponding author), E-mail: tssduan@jnu.edu.cn
2015-12-15 录用日期:2016-03-01
1673-5897(2016)2-275-08
X171.5
A
简介:段舜山(1955-),男,教授,博士生导师,主要从事藻类生理生态学研究,发表SCI等各类论文100多篇。
唐思, 刘伟杰, 段舜山. 壬基酚对多刺裸腹溞连续世代的毒性效应[J]. 生态毒理学报,2016, 11(2): 275-282
Tang S, Liu W J, Duan S S. Toxic effects of nonyphenol on successive generations of Moina macrocopa [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 275-282 (in Chinese)

