溶解有机质对生物富集因子计算的影响:以东江鱼体中多溴联苯醚的生物富集为例
罗孝俊,何明靖,曾艳红,吴江平,陈社军,麦碧娴
1. 中国科学院广州地球化学研究所 有机地球化学国家重点实验室和广东省环境资源利用与保护重点实验室,广州 510640 2. 西南大学资源环境学院,重庆 400716
溶解有机质对生物富集因子计算的影响:以东江鱼体中多溴联苯醚的生物富集为例
罗孝俊1,*,何明靖1,2,曾艳红1,吴江平1,陈社军1,麦碧娴1
1. 中国科学院广州地球化学研究所 有机地球化学国家重点实验室和广东省环境资源利用与保护重点实验室,广州 510640 2. 西南大学资源环境学院,重庆 400716
准确获取化合物的生物富集因子(BAF)对于判定化合物是否属于潜在毒害性污染物、评价其生态环境风险都具有重要的意义。为探究水体中溶解有机质(DOM)对BAF值的影响,以东江三角洲流域为研究区域,以多溴联苯醚(PBDEs)为目标化合物,研究了PBDEs各单体在3种鱼体中的富集特征。结果表明,PBDEs在3种鱼体中的浓度范围为42~825 ng·g-1脂肪,log BAF值位于5.0~7.4之间。由于脱溴代谢的种间差异,3种鱼类表现出2种PBDE的组成模式。在缺乏脱溴代谢途径的鱼体内,log BAF与化合物辛醇/水分配系数(log KOW)之间存在统计意义上的抛物线关系。但当BAF进行DOM的校正之后,二者之间抛物线形式的相关性消失,而呈现出显著的正线性相关性。以往研究对BAF值在化合物的log KOW达到一定程度后(7~8附近)出现下降的解释是高KOW化合物较大的分子体积降低了其穿过生物膜的可能性,但我们的研究结果表明,这种下降很可能是由于忽视了水体中DOM影响的结果。
多溴联苯醚;溶解有机质;东江;生物富集因子
Received 14 October 2015 accepted 16 November 2015
生物可富集性评价在化学品2个阶段的评估(毒害性污染物认证与环境风险评价)中均起到重要作用。满足什么样条件的物质被认为是生物可富集的物质迄今为止并没有一个明确的定义。目前采用最多的评价指标是生物浓缩(bioconcentration factor, BCF)或生物富集因子(bioaccumulation factor, BAF)。生物浓缩仅指生物通过呼吸系统及皮肤接触从环境中富集污染物的过程,而生物富集则包括所有的污染物暴露吸收过程(包括饮食暴露)[1]。《关于持久性有机污染物的斯德哥尔摩公约》中将BCF或BAF大于5 000的化合物定义为可生物富集物质[2]。欧盟、加拿大和美国环保部门大致都采用了相似的指标。除了利用BCF/BAF本身外,人们还根据BCF/BAF与表征化学物质的分子体积参数(如分子最大直径,Dmax和分子有效截面直径Deff)、分子量和辛醇/水分配系数(KOW)之间推导出的关系来确定判定化合物可生物富集的分子本身性质的参考值。如KOW大于100 000[2]、Dmax大于1.7 nm[3]、Deff大于0.95 nm[4]、分子量大于1 100[5]等都被用作判定一个化合物是否具有生物可富集性的基准值。
综上所述,准确的测定BAF或BCF对于正确评判一个化合物是否具有生物可富集性,对于判定分子性质的参考值是否合理都具有决定性的作用。对于水生生物而言,BCF/BAF是通过污染物在生物中的浓度及在水体中的浓度之比来计算的。其中水体中的浓度指的是真实的溶解态浓度。但在实际的测量过程中,真实的溶解态浓度很难准确的测定。众多的因素都会影响物质在水中的真实溶解态浓度如温度、水中颗粒物的浓度及组成、水中溶解有机质(DOM,以溶解有机碳含量DOC进行表征)的存在及组成等。Arnot和Gobas等[1]对已有的770个化合物,4 323个BCF值进行评估时发现至少42%的BCF数据存在一个或多个数据误差来源。而利用分子本身性质设定的参考值也会因为BCF值的变动而变化。Arnot等[6]通过对现有的分子体积参数及其基准值的综述发现,分子体积参数参考值有逐步增大的趋势。其主要原因就是一些高分子量化合物近年来不断被证实是可生物富集的。
水中DOM的存在会改变水体中化合物的真实溶解浓度,但现有相关BCF/BAF的计算都没有将这一因素纳入考虑范围。2012年经合组织重新修订的BCF标准测量方法也没有将水体DOM的影响考虑进去[7]。有关污染物在水相与颗粒相中分配的研究表明,DOM对化合物在两相中的分配起到非常重要的作用,特别是对高KOW的化合物[8]。为了了解DOM存在对测定的BAF的影响。我们采集了珠江三角洲东江流域水体中鱼和水样,以多溴联苯醚(PBDEs)为目标化合物,计算了不同PBDE单体在3种鱼中的BAF,并探讨了DOM对BAF的影响。
1 材料与方法 (Materials and methods)
1.1 样品采集与前处理
2010年在东江下游流域采集表层水样(水表面以下0.3~0.4 m)5个,每个水样约50 L,装在预先清洗干净的10 L棕色玻璃瓶中。在采集水样区域用捕鱼网采集鲮鱼(Cirrhina molitorella )9只,罗非鱼(Tilapia nilotica)15只和清道夫(Hypostomus plecostomus)10只。具体的采样点分布情况见图1
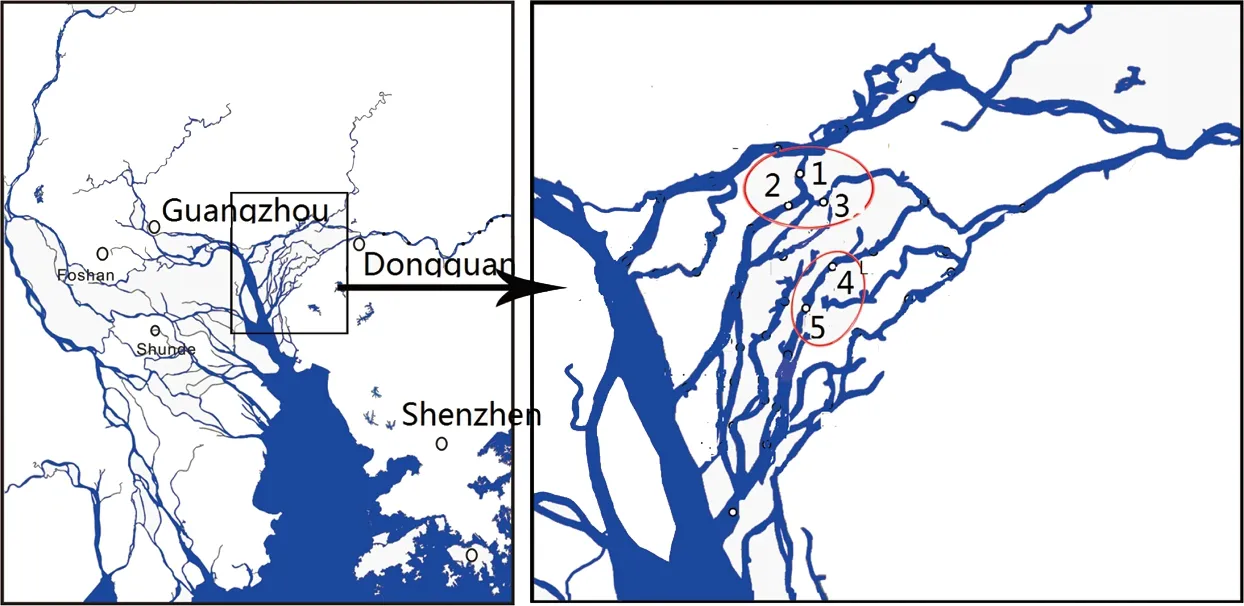
图1 采样点分布图 注:椭圆区域为鱼及水样的采集区。Fig. 1 Sampling sites in Dongjiang River Note: Fish and water samples were collected in circle areas.
水样及鱼样的详细前处理流程见参考文献[8]和[9]。此处仅作简介如下:水样经玻璃纤维膜过滤分为溶解相和颗粒相。溶解相注入替代内标(13C-PCB141、BDE77、BDE181)经过XAD色谱柱富集、用甲醇、二氯甲烷洗脱,再用二氯甲烷反相萃取3次。萃取液加蒸馏水再萃取去除剩余甲醇。合并所有的萃取液,旋转蒸发浓缩至1 mL左右。浓缩液再经过多层复合硅胶柱进行净化。净化后的洗脱液浓缩至1 mL左右,转换溶剂为正己烷,氮吹定容至200 μL,加入进样内标(BDE118、BDE128)。在采水样同时,另取1 L水样装入棕色玻璃瓶。水样经同样滤纸过滤后,取滤液测定DOC含量,分析仪器为Shimadzu TOC-VCPH analyzer。
鱼样解剖取出2 g肌肉组织、冷冻干燥并混匀后,注入替代内标,用正己烷/丙酮体积比为1:1的混合溶剂索氏抽提48 h,取十分之一的抽提液利用称重法测脂肪含量。余下抽提液经GPC除脂后过复合硅胶柱净化,然后浓缩并定容为200 μL,加入进样内标。
1.2 仪器测量及质量控制与质量保证
三至七溴取代PBDE单体(28, 47, 66, 99, 100, 153, 154, 138和183)采用Agilent 6890 GC-5975 MS在负化学电离、单离子扫描模式下进行定量分析,色谱柱为DB-XLB (30 m×0.25 mm×0.25 μm, J&W Scientific)毛细色谱柱,九至十溴取代PBDE单体(208,207,206和209)采用Shimadzu model 2010 GC- QP2010 MS (Shimadzu, Japan)在负化学电离、单离子扫描模式下进行定量分析,色谱柱为DB-5HT (15 m×0.25 mm×0.10 μm, J&W Scientific)毛细管柱。三至九溴单体监测离子为79和81,BDE209监测离子为486.7和488.7。具体的色谱柱升温程序参见参考文献[9]。
质量控制与质量保证包括空白样、空白加标、基质加标、添加替代内标等。空白样中有少量BDE47和BDE99检出,实际样品进行了相应扣除。空白加标和基质加标(鱼肉)PBDE单体(13种PBDE单体)的回收率分别为99%~114%和101%~118%。替代内标13C-PCB141、BDE77、BDE181的回收率分别为95.2% ± 1.0%、107.8%±1.0%、100.6%±1.7%。
1.3 生物富集因子的计算及溶解有机质校正
鱼体中各PBDE单体的BAF值按照下列公式计算:
(1)
其中CBio为化合物在生物中的浓度,单位换算为pg·kg-1脂肪,Cwater为水中溶解相浓度,单位为pg·L-1。以5个水样的平均浓度作为计算用浓度。以上计算得到的其实是表观生物富集因子,而不是真实的生物富集因子。真实的生物富集因子水中溶解态化合物的浓度仅指真实溶解相浓度。而测定的浓度中包含细颗粒(< 0.45 μm)中及在DOM中的PBDEs。这里忽略掉细颗粒物影响,只考虑DOM的影响,则存在如下公式:
Cappr-dis=Cdis+Cdis-DOC
(2)
式中Cappr-dis、Cdis和Cdis-DOC分别为表观溶解相浓度,真实溶解相浓度和溶解有机质中化合物的浓度。
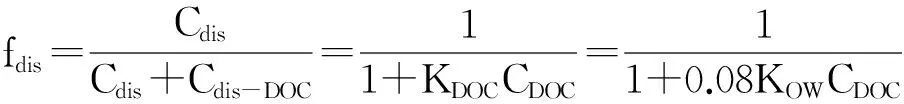
(3)
上式中KDOC是化合物在水和DOM间的分配系数,大致为0.08KOW[10];CDOC指水体中DOM(以DOC来表征)的含量。真实的BAF值为表观BAF值除以fdis。

表1 5个站点水中DOC及PBDE各单体的表观溶解态浓度 (DOC单位为mg·L-1,PBDE单位为pg·L-1)
注:ND表示浓度低于检测限。
Note: ND indicated that the level was lower than MDL.
2 结果(Results)
2.1 水体及鱼中PBDE的浓度及组成
本研究共检测了13种PBDE单体(BDE28、47、66、100、99、154、153、138、183、206、207、208和209)。水体中除BDE138以外,其他单体均有检出,各点位不同单体的浓度见表1。溶解相中∑LPBDE(3-7溴单体之和)和∑HPBDE(9-10溴单体之和)的浓度范围分别为48~68 pg·L-1和58 ~ 99 pg·L-1。水体溶解相中BDE209是最主要单体,相对丰度约20%,与BDE47的相对丰度相当(约17%)。在水相中BDE209仍是相对丰度最高的单体与水相中的细颗粒物和DOM的存在有关。高溴代单体BDE209易在颗粒物中富集,而高KOW化合物在DOM中的分配会大大增加相关化合物在水相中的表观溶解浓度[8]。
水体环境中检测到的13种PBDE单体在所采集的3种鱼中均有检出。在低溴代PBDEs单体中(三溴代到七溴代),BDE138的检出率为68%,其他几种PBDEs单体检出率为100%。∑LPBDE在鲮鱼、罗非鱼和清道夫3种鱼中的浓度范围分别为42~210、35~160和40~560 ng·g-1脂重,其浓度中值分别为35、37和68 ng·g-1脂重。高溴代PBDEs单体的检出率明显低于低溴代单体的检出率,鲮鱼、罗非鱼和清道夫中九溴代(BDE208、207和206)单体的检出率分别为40%、44%和30%。对于BDE209,在清道夫中检出率和浓度(100%,0.85~220 ng·g-1脂重)明显高于鲮鱼(78%,nd~5.0 ng·g-1脂重)和罗非鱼(67%,nd~23 ng·g-1脂重)。
3种鱼体内PBDE的单体组成特征存在非常明显的差别。对于鲮鱼和罗非鱼,BDE47是主要的PBDE单体(图2),分别占到了总PBDE的59%和56%;其次是BDE100(分别为8.2%和9.6%)。清道夫体内BDE47和BDE99是2个最主要的PBDE单体,分别占总PBDE含量的31%和28%;第三高丰度的单体为BDE209。清道夫体内PBDE的单体组成特征与水体中PBDE的组成特征更为接近,而鲮鱼和罗非鱼则与水体中PBDE组成存在明显差别。
2.2 生物富集因子(BAF)与化合物KOW之间的关系
PBDEs各单体在3种鱼中计算出来的log BAFs范围分别为5.0 ~ 7.4。这些值与Streets等[11]报道的美国Michigan湖鲑鱼的log BAFs范围相当,明显高于北京一接受污水处理厂的出水的湖泊中各淡水生物中的log BAFs值(2.2~6.2)[12]和加拿大Winnipeg湖各种鱼类的log BAFs值(2.1~4.5)[12]。当化合物的BAF值大于5 000(log BAFs > 3.7)时,就可以被认为具有生物富集能力[2]。在本研究中,所有的PBDE单体的log BAFs值均大于3.7,说明了这些污染物都具有生物富集能力。

图2 3种鱼体内PBDE的单体组成特征Fig. 2 PBDE congener profiles in three fish species
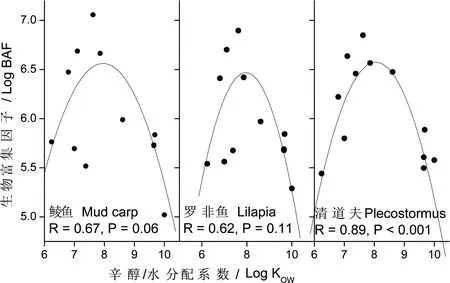
图3 未经溶解有机质(DOM)校正时生物富集因子与化合物KOW之间的关系Fig. 3 Correaltion between apparent BAF and KOW of chemicals
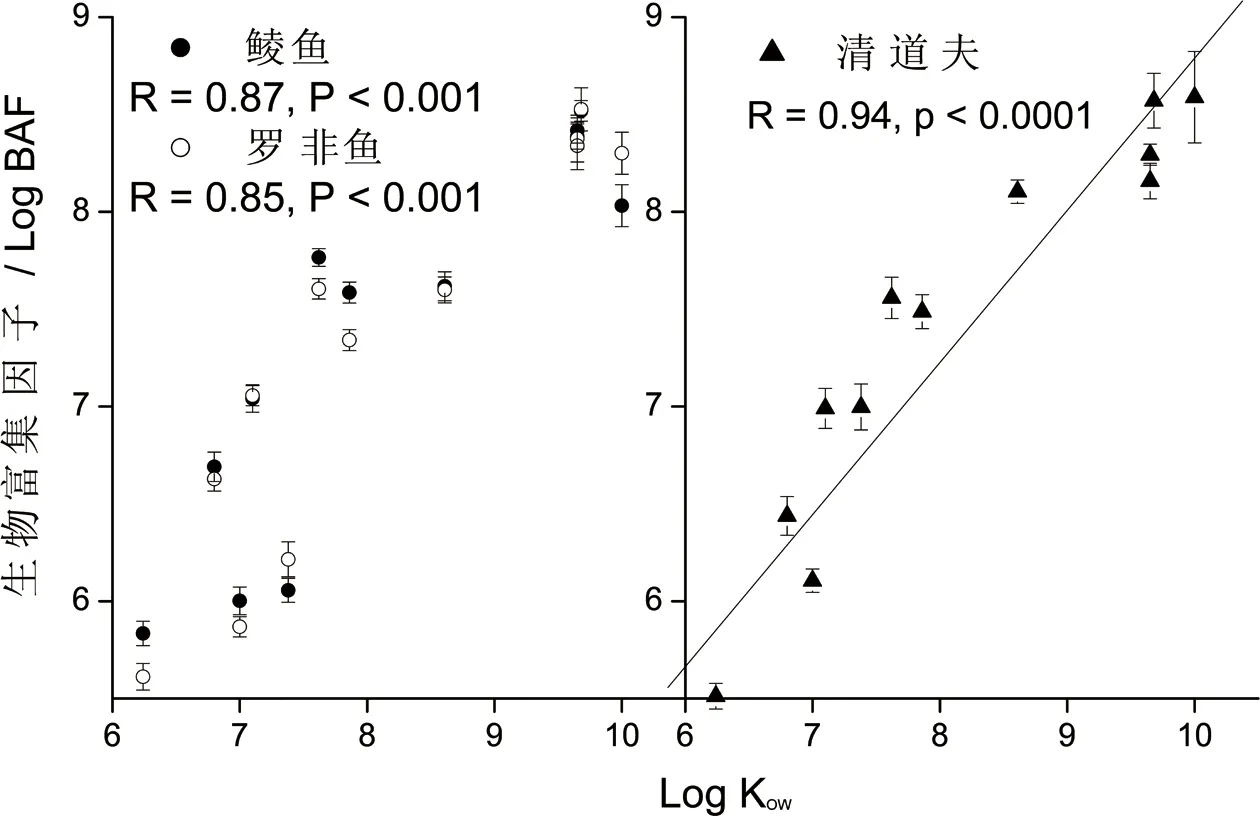
图4 经溶解有机质(DOM)校正后的生物富集因子与化合物KOW间的关系Fig. 4 Correlation between BAF corrected by DOM and KOW of chemicals
BAF与log Kow的相关性见图3,对于清道夫而言,BAF与log Kow存在具有统计意义的抛物线形式的相关性,对于鲮鱼与罗非鱼,这种回归分析虽然不具有统计学意义,但主要趋势仍然存在。当BAF值经过DOM校正以后,无论是鲮鱼、罗非鱼还是清道夫,抛物线形式的相关性不复存在,反之,log BAF与log KOW之间呈现出统计意义上的显著线性相关性(图4)。
3 讨论(Discussion)
3.1 鱼体中PBDE的组成模式
3种鱼存在2种不同的PBDE单体组成模式。清道夫的PBDE单体组成模式更接近水体中的PBDE单体组成模式,而鲮鱼和罗非鱼则明显偏离水体PBDE单体组成模式。这种PBDE单体组成模式的种间差别主要是由于不同鱼种对PBDE脱溴代谢不同所致。我们最近在室内模拟了PBDE在四间鱼、地图鱼和红尾鲶3种鱼中的代谢与食物链传递过程。这3种鱼分别属于鲤科鱼、丽科鱼和鲇科鱼。本次研究中采集的的3种鱼也分别属于鲤科鱼(鲮鱼)、丽科鱼(罗非鱼)和鲇科鱼(清道夫)。室内的研究结果表明,四间鱼和地图鱼具有相同的脱溴代谢模式,既BDE99脱溴生成BDE47,BDE183脱溴生成BDE154等。但红尾鲶则未表现出任何脱溴代谢的迹象。在清远电子垃圾回收区采集的鲮鱼和鲶鱼的研究也发现,鲶鱼中BDE99和BDE209的相对峰度要远高于鲮鱼[15]。这些室内外的结果都表明,鲇科鱼缺乏脱溴代谢的途径。因此,BDE99和BDE209在野外环境中的鲶鱼和清道夫体内具有较高的相对丰度。3种PBDE工业品的鲤鱼喂养实验表明,鲤科鱼对BDE99和结构上存在双相邻的间位或对位溴原子取代的单体具有明显的脱溴代谢作用[16]。因此,BDE99和BDE209在鲮鱼和罗非鱼体内具有较低的丰度。
3.2 脱溴代谢与溶解有机质对生物富集因子的影响
鲮鱼和罗非鱼体内PBDE单体的表观BAF与log Kow值没有表现出统计意义上的相关性主要是由于相关单体的脱溴代谢作用所致。如上所述,BDE99在这2种鱼体内存在脱溴生成BDE47的过程,这使得相应单体的BAF值偏离了其本身的真实BAF值。而清道夫体内由于没有相关脱溴代谢过程,所以log BAF与log KOW之间表现出具有统计意义的相关性。显然,如果不考虑其他代谢途径的影响,清道夫的log BAF值与log Kow之间的关系应更能真实反映化合物理化性质与生物可富集潜力之间的关系。
从表观生物富集系数与KOW的关系可见,在log KOW大约在8左右时,log BAF值与log KOW的关系出现了由正线性相关向负线性相关的转化,这与早期其他研究的结果一致。早期的预测模型表明当log Kow < 7时,log BAF随着log Kow的增大而逐渐增大,而当log Kow > 7时,log BAFs随着log Kow的增大而逐渐减小[17]。对于发生这种转折的原因一般认为随着log KOW值增加,化合物的分子体积也相应增加,增加到一定程度后,其穿透生物膜的能力大大降低,从而导致其生物可富集潜力下降。但我们的研究结果表明,这一解释可能是存在问题的。从图4可看出,经过溶解有机质校正后,实际上化合物的log KOW与log BAF之间仍呈正线性关系。表明高KOW化合物仍具有较高的生物可富集潜力。这与Arnot等[6]对现存分子体积参数作为生物可富集性评价指标研究进行综述后得到的结果是一致的。
实测的log BAF与log KOW之间这种正负相关性的转折往往发生在log KOW= 7附近[18]。这种转折可以从公式(3)中得到很好的解释。从fdis的计算公式可以看出,fdis主要受KDOC×CDOC的影响。对于实际水体,CDOC的含量大约在mg·L-1这一数量级。如在本研究中,东江水体的DOC含量范围为1.14~1.43 mg·L-1,换算为数字为10-6左右,而KDOC为0.08 KOW,两者相乘大致为KOW×10-7左右,当化合物的Log KOW等于7时,真实的溶解相浓度占表观浓度的50%,如果小于7,如等于6,则真实溶解相浓度将占到表观溶解度的90%,既溶解在有机质中的化合物基本上可以忽略。但当KOW大于7后,KOW每增加一个数量级,则真实的溶解态含量降低一个数量级,从而导致表观生物富集系数减小约10倍。因此,以往计算所得到的BAF值的下降更有可能是由于没有考虑溶解有机质的影响的结果。至于转折的KOW点出现一定的偏移,这取决于具体点位水体中DOM的含量与组成。
我们的研究结果说明了水体中的DOM和化合物在生物体内的代谢过程都会影响实际计算所获得的BAF。对于低KOW化学物质,水中DOM的影响基本可以忽略,但对于高KOW的物质,DOM对水体中物质的真实溶解度的影响非常大。真实环境中观测到高KOW物质具有较低的生物富集潜力可能并不是其分子体积过大导致其穿过生物膜的可能性降低,而是水相中的其他相(如DOM、颗粒相)与生物对污染物的竞争分配所致。
[1] Arnot J A, Gobas F A P C. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms [J]. Environment Review, 2006, 14: 257-297
[2] UNEP. UNEP Stockholm Convention on Persistent Organic Pollutants [EB/OL]. http://chm.pops.int/
[3] Dimitrov S, Dimitrov N, Parkerton T F, et al. Base-line model for identifying the bioaccumulation potential of chemicals [J]. SAR and QSAR in Environmental Research, 2005, 16: 531-554
[4] Opperhuizen A, van der Velde E W, Gobas F A P C, et al. Relationship between bioconcentration in fish and steric factors of hydrophobic chemicals [J]. Chemosphere, 1985, 14: 1871-1896
[5] European Chemicals Agency. Guidance on Information Requirements and Chemical Safety Assessment Chapter R.11: PBT/vPvB Assessment [S]. European Chemicals Agency, 2014: 54
[6] Arnot J A, Arnot M I, Mackay D, et al. Molecular size cutoff criteria for screening bioaccumulation potential: Fact or fiction? [J] Intergrated Environmental Assement and Management, 2009, 6(2): 210-224
[7] Organization for Economic Co-operation and Development (OECD). Bioaccumulation in Fish: Aqueous and Dietary Exposure. OECD Guidelines for Testing of Chemicals 305 [S]. OECD, 2012
[8] Chen M Y, Yu M, Luo X J, et al. The factors controlling the partitioning of polybrominated diphenyl ethers and polychlorinated biphenyls in the water-column of the Pearl River Estuary in South China [J]. Marine Pollution Bulletin, 2011, 62: 29-35
[9] Xiang C H, Luo X J, Chen S J, et al. Polybrominated diphenyl ethers in biota and sediments of the Pearl River Estuary, South China [J]. Environmental Toxicology Chemistry, 2007, 26: 616-623
[10] Burkhard L P. Estimating dissolved organic carbon partition coefficients for nonionic organic chemicals [J]. Environmental Science and Technology, 2000, 34: 4663-4668
[11] Streets S S, Henderson S A, Stoner A D, et al. Partitioning and bioaccumulation of PBDEs and PCBs in Lake Michigan [J]. Environmental Science and Technology, 2006, 40: 7263-7269
[12] Wang Y W, Li X M, Li A, et al. Effect of municipal sewage treatment plant effluent on bioaccumulation of polychlorinated biphenyls and polybrominated diphenyl ethers in the recipient water [J]. Environmental Science and Technology, 2007, 41: 6026-6032
[13] Law K, Halldorson T, Danell R, et al. Bioaccumulation and trophic transfer of some brominated flame retardants in a Lake Winnipeg (Canada) food web [J]. Environmental Toxicology Chemistry, 2006, 25: 2177-2186
[14] Luo X J, Zeng Y H, Chen H S, et al. Application of compound-specific stable carbon isotope analysis for the biotransformation and trophic dynamics of PBDEs in a feeding study with fish [J]. Environmental Pollution, 2013, 176: 36-41
[15] Zhang Y, Luo X J, Wu J P, et al. Contaminant pattern and bioaccumulation of legacy and emerging organhalogen pollutants in the aquatic biota from an e-waste recycling region in South China [J]. Environmental Toxicology and Chemistry, 2010, 29: 852-859
[16] Zeng Y H, Luo X J, Chen S J, et al. Gastrointestinal absorption, metabolic debromination and hydroxylation of PBDE in common carp exposed to three commercial PBDE mixtures [J]. Environmental Toxicology Chemistry, 2012, 31: 731-738
[17] Thomann R V. Bioaccumulation model of organic chemical distribution in aquatic food chains [J]. Environmental Science and Technology, 1989, 23: 699-707
[18] Wu J P, Luo X J, Zhang Y, et al. Bioaccumulation of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in wild aquatic species from an electronic waste (e-waste) recycling site in South China [J]. Environment International, 2008, 34: 1109-1113
◆
Influence of Dissolved Organic Matter on Bioaccumulation Factor: A Case Study of Bioaccumulation of Polybrominated Diphenyl Ethers (PBDEs) in Fish from Dongjiang River
Luo Xiaojun1,*, He Mingjing1,2, Zeng Yanhong1, Wu Jiangping1, Chen Shejun1, Mai Bixian1
1. State Key Laboratory of Organic Geochemistry and Guangdong Key Laboratory of Environmental Protection and Resources Utilization, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China 2. College of Resource and Environment, Southwest University, Congqing 400716, China
Bioaccumulation factor (BAF) plays key role in identification of bioaccumulative substance and in assessment of chemical risk. In order to reveal the effect of dissolved organic matter (DOM) on the calculated bioaccumulation factor, water and fish samples were collected from Dongjiang River and polybrominated diphenyl ethers (PBDEs) were measured. The concentrations of PBDEs in three fish species varied from 42 to 825 ng·g-1lipid weight and the BAFs were between 5.0 and 7.4. There are two distinct PBDE congener profiles among three fish species due to the difference in metabolic debromination. A statistically significant parabolic relationship between log BAF and log KOWwas found for fish exhibited no metabolic debromination. However, after correction with DOM, the log BAF was positively correlated with log KOW. Previous studies demonstrated that the BAF decreases with increasing log KOWwhen log KOWof chemical was larger than certain values such as 7 or 8. It is suggested that the larger molecular size of chemical block or retard the chemical to penetrate cell membrane. However, the results of the present study indicated that the decreasing trend of BAF with increasing lipophilicity of chemicals can be ascribed to the influence of DOM on the calculated BAF.
PBDEs; dissolved organic matter; Dongjiang River; bioaccumulation factor
10.7524/AJE.1673-5897.20151014002
国家自然科学基金(41473102,41273118,41230639)
罗孝俊(1972-),男,研究员,研究方向为毒害性有机污染物的环境地球化学,E-mail: luoxiaoj@gig.ac.cn;
2015-10-14 录用日期:2015-11-16
1673-5897(2016)2-188-06
X171.5
A
简介:罗孝俊(1972—),男,环境科学博士,研究员,主要研究方向毒害性有机污染物的环境地球化学,发表学术论文150余篇。
罗孝俊, 何明靖, 曾艳红, 等. 溶解有机质对生物富集因子计算的影响:以东江鱼体中多溴联苯醚的生物富集为例[J]. 生态毒理学报,2016, 11(2): 188-193
Luo X J, He M J, Zeng Y H, et al. Influence of dissolved organic matter on bioaccumulation factor: A case study of bioaccumulation of polybrominated diphenyl ethers (PBDEs) in fish from Dongjiang River [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 188-193 (in Chinese)

