小剂量氢化可的松治疗严重脓毒症患者的疗效观察
李 亮,曹昌魁,聂时南
·论 著·
小剂量氢化可的松治疗严重脓毒症患者的疗效观察
李 亮,曹昌魁,聂时南
目的 观察小剂量氢化可的松对严重脓毒症患者预后和炎症反应的影响。方法 按照是否进行小剂量氢化可的松治疗将符合入选标准的患者随机分为治疗组和对照组,对两组患者进行急性生理与慢性健康(APACHE Ⅱ)评分,治疗组在常规治疗基础上加用小剂量氢化可的松治疗。比较两组患者死亡率、血管活性药物使用天数、住EICU和总住院时间及0、1、3、5 d血清白介素-6(interleukin,IL-6)浓度。结果 共入选治疗组56例,对照组50例。两组患者入院时的年龄、性别和APACHE Ⅱ评分差异无统计学意义,治疗后两组患者的死亡率、血管活性药物使用天数、住急诊监护病房(EICU)时间和总住院时间差异无统计学意义(P>0.05)。治疗组患者的IL-6水平明显低于对照组。结论 小剂量氢化可的松治疗能减轻严重脓毒症患者的炎症反应,但不能明显改善严重脓毒症患者的预后。
严重脓毒症;氢化可的松;预后;炎症因子
严重脓毒症是急诊监护病房(emergency intensive care unit, EICU)中的常见疾病,也是EICU患者的重要死亡原因,虽然相关医疗手段不断完善,严重脓毒症患者的死亡率仍很高[1]。在过去的数十年中,脓毒症的诊治取得了重大进展,激素在严重脓毒症患者中的应用日益成为研究热点[2-4]。严重脓毒症患者常合并绝对或相对的肾上腺功能不全和或相应受体耐受[5-6],这是脓毒症糖皮质激素治疗的理论基础。氢化可的松具有强大的抗炎作用,关于氢化可的松用于脓毒症患者治疗的研究很多[7],然而,多数研究表明,大剂量(2~8 g/d)的氢化可的松治疗并未使患者获益,且大剂量激素治疗或许会导致患者致命性感染的发生[8]。有证据显示,小剂量(300 mg/d)氢化可的松治疗能改善患者脉管系统对血管活性药物的敏感性,同时减轻炎症反应,对患者有益[9]。
目前,小剂量氢化可的松对治疗严重脓毒症患者的研究报道较少,本文以我院EICU严重脓毒症患者为对象,研究小剂量氢化可的松对严重脓毒症患者预后和炎症反应的影响。
1 对象与方法
表1 两组严重脓毒症患者基本情况比较
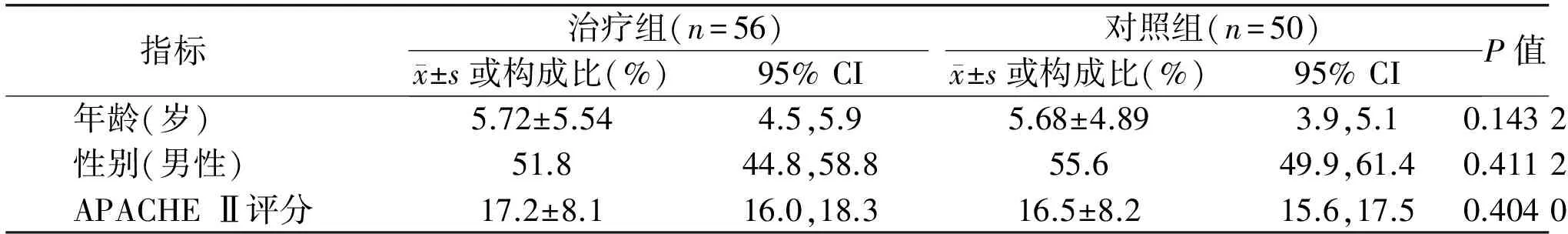
指标 治疗组(n=56)对照组(n=50) x±s或构成比(%)95%CI x±s或构成比(%)95%CIP值年龄(岁)5.72±5.544.5,5.95.68±4.893.9,5.10.1432性别(男性)51.844.8,58.855.649.9,61.40.4112APACHEⅡ评分17.2±8.116.0,18.316.5±8.215.6,17.50.4040
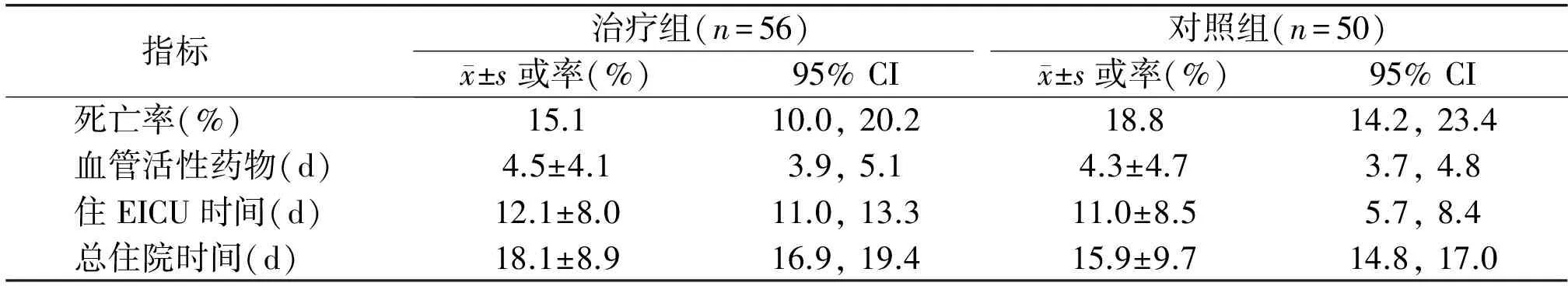
表2 两组严重脓毒症患者预后指标的比较
1.1 入选标准 严重脓毒症的诊断标准[10]:患者在可疑或已证实的感染中出现全身炎症反应综合征即诊断为脓毒症,在脓毒症的基础上出现心血管功能障碍,或急性呼吸窘迫综合征,或两个以上其他脏器功能障碍即诊断为严重脓毒症[11]。出现下列情况中的两种(必须包括白细胞计数或体温异常)即诊断为全身炎症反应综合征[12-13]:①体温:中心体温大于38.5 ℃或小于36.0 ℃;②心动过速或心动过缓:排除其他导致心动过速的情况,患者平均心率大于同年龄组正常值心率的2个标准差为心动过速;在排除其他导致心动过缓的情况,出现平均心率小于同年龄组正常值第10百分位数为心动过缓;③呼吸:患者需机械通气或平均呼吸频率大于各年龄组正常值2个标准差;④白细胞异常:白细胞计数异常或未成熟嗜中性粒细胞大于10%。排除标准:①患者存在免疫缺陷性疾病;②合并原发性肾上腺疾病;③发病前15 d内使用糖皮质激素治疗。
1.2 方法 根据入选标准选择合适患者,将入选患者随机分为对照组和治疗组,在治疗前对两组患者进行急性生理与慢性健康(APACHE Ⅱ)评分,并记录患者的性别和年龄。两组患者均按照2012年严重脓毒症指南[2]进行常规治疗。治疗组患者在常规治疗的基础上,给予氢化可的松5 mg/(kg·d),分3次给予,在应用3~5 d后根据患者病情减量,5~7 d后根据病情停用[14]。治疗后,比较患者死亡率、血管活性药物使用天数、住EICU天数、总住院天数及0、1、3、5 d血清IL-6的浓度。

2 结 果
2.1 入选病例 以2013 年1月-2015 年1月在南京军区南京总医院急诊监护病房住院的患者为研究对象,根据上述纳入及排除标准,共入选106例严重脓毒症患者,其中,治疗组56例,对照组50例,严重脓毒症患者常见感染部位依次为呼吸系统、皮肤软组织、消化系统及神经系统。
2.2 两组患者基本情况比较 入院分组后统计两组患者的年龄、性别,并进行APACHE Ⅱ评分,两组患者在年龄、性别和APACHE Ⅱ评分方面的差异无统计学意义(P>0.05),见表1。
2.3 两组患者预后指标的比较 在两组患者出院时统计各项预后指标,两组患者在死亡率、血管活性药物使用时间、住EICU时间和总住院时间的差异无统计学意义(P>0.05),见表2。
2.4 两组患者血清IL-6浓度的比较 分别测定入院后患者0、1、3、5 d血清IL-6的浓度,两组患者随着病情的延长血清IL-6呈下降趋势,但治疗组患者血清IL-6浓度明显低于对照组,差异具有统计学意义(P<0.05),见图1。
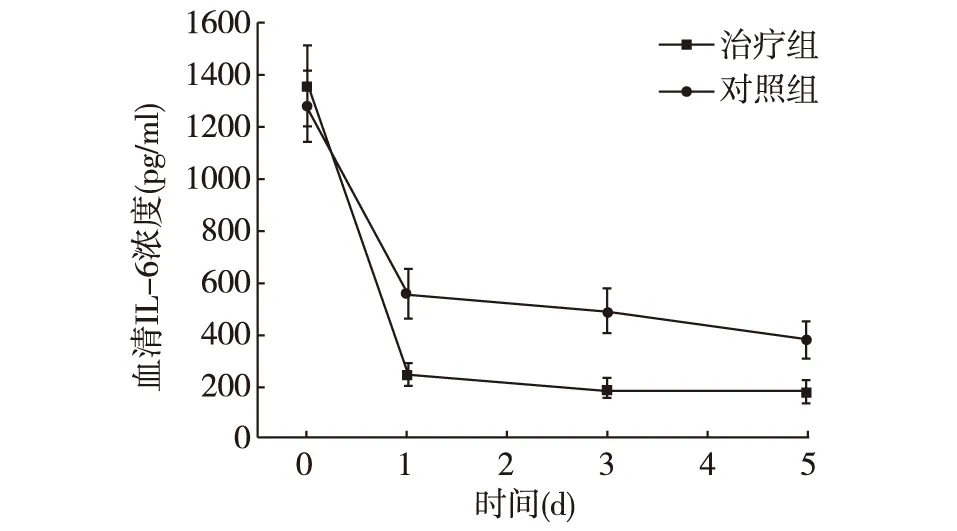
图1 两组患者血清IL-6浓度的比较
3 讨 论
严重脓毒症(severe sepsis)是严重威胁患者健康的疾病,虽然抗感染治疗和脏器功能支持技术得到了长足的发展,但脓毒症尤其是严重脓毒症患者的死亡率仍居高不下[15-16]。
目前普遍认为,脓毒症是机体促炎反应和抗炎反应失平衡的结果[17]。致病因素促使机体产生大量TNF-α、IL-6、IL-1β等炎症介质,这些炎症因子进一步触发其他大量炎症因子的大量释放和激活,大量炎性介质“瀑布样”释放是导致全身炎症反应综合征及严重脓毒症的重要原因[18-19]。下丘脑-垂体-肾上腺轴(hypothalamus-pituitary-adrenal axis, HPAA)在对抗脓毒症中发挥重要作用[20],HPAA的激活使机体释放糖皮质激素,糖皮质激素具有广泛的抑制炎症反应的作用,可下调炎症介质的表达和激活,能抑制早期炎症细胞及其介导的炎症介质“瀑布样”释放,从而减少了严重脓毒症的发生[8]。
严重脓毒症患者可现对糖皮质激素产生相对减少和或反应性降低[21]。近来研究发现,大约25%的脓毒症患者存在肾上腺功能不全[22],这是脓毒症患者激素治疗的理论依据,但糖皮质激素在严重脓毒症治疗中的应用存在诸多争议,尤其是其疗效及用药时机、剂量和疗程[23]。
本实验按照是否行小剂量氢化可的松治疗将患者随机分为治疗组和对照组,分别记录两组患者的性别、年龄,并根据APACHE Ⅱ评分标准对两组患者进行评分,结果发现:治疗前两组患者的性别、年龄和APACHE Ⅱ评分的差异无统计学意义。APACHE Ⅱ评分能较好地反应患者病情严重程度[13],两组患者在性别、年龄和病情严重程度方面无差异,故两组患者具有可比性。按照指南给予两组患者常规治疗,治疗组在常规治疗基础上加用小剂量氢化可的松,结果发现两组患者死亡率、血管活性药物使用天数、住EICU和总住院时间的差异无统计学意义,和对照组相比,小剂量氢化可的松治疗并未能改善严重脓毒症患者的预后,不能使一般严重脓毒症患者获益。可能原因:治疗组中仅有一定比例的患者存在肾上腺功能不全,小剂量氢化可的松治疗仅改善了该部分患者的预后,筛选出存在肾上腺功能不全的患者,重新进行分组,针对这些患者进行小剂量氢化可的松治疗可能明显改善预后,本课题组也正在进行这方面的研究。
炎症介质的释放和激活在脓毒症的发生发展中发挥重要作用[24],由T、B淋巴细胞、单核巨噬细胞和血管内皮细胞等产生的前炎症细胞因子IL-6在脓毒症的炎症级联反应中处于中心地位[25],IL-6的浓度和其他炎症因子的动态平衡决定着脓毒症的发展方向[12],也有研究发现血清IL-6浓度和脓毒症患者的死亡率呈正相关[26-27]。
本研究检测了两组患者入院后0、1、3、5 d血清IL-6浓度,结果发现随着病情的进展,两组患者血清IL-6浓度均呈下降趋势,和对照组相比,治疗组患者血清IL-6浓度下降更明显,差异具有统计学意义。小剂量氢化可的松治疗明显降低患者血清IL-6浓度,抑制了患者的炎症反应,这能为脓毒症治疗中炎症介质的调节提供了理论依据。
综上所述:小剂量氢化可的松治疗未能改善严重脓毒症患者的预后。对严重脓毒症患者行进一步的肾上腺功能检查,筛选出具有肾上腺功能不全的患者,针对这部分患者行小剂量氢化可的松治疗或许能获益,在未行肾上腺功能检查时,即对患者行小剂量氢化可的松治疗不能改善整体患者的预后,本课题组正在进行这方面的研究。同时,小剂量氢化可的松治疗能明显降低严重脓毒症患者血清IL-6的水平,可作为严重脓毒症免疫治疗的理论依据。
[1] Zahar JR, Timsit JF, Garrouste-Orgeas M, et al. Outcomes in severe sepsis and patients with septic shock: pathogen species and infection sites are not associated with mortality[J]. Crit Care Med, 2011, 39(8): 1886-1895.
[2] Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013, 39(2): 165-228.
[3] 廖延年,黄 骞,黎介寿.晚期糖基化终末产物受体在腹腔感染脓毒症中的研究进展[J].医学研究生学报,2015,28(6):656-660.
[4] 刘文飞,朱振新,颜荣林.AMPK/mTOR通路参与脓毒症亮氨酸抵抗的研究进展[J].医学研究生学报,2014,27(12):1311-1314.
[5] Albert SG, Ariyan S, Rather A. The effect of etomidate on adrenal function in critical illness: a systematic review[J]. Intensive Care Med, 2011, 37(6): 901-910.
[6] 刘 瑜,方 放,黄 方. 糖皮质激素受体基因多态性与脓毒症临床转归的相关性研究[J]. 东南国防医药,2015, 17(6):575-578.
[7] Angus DC, van der Poll T. Severe sepsis and septic shock[J]. New England J Med, 2013, 369(9): 840-851.[8] Annane D, Bellissant E, Bollaert PE, et al. Corticosteroids in the treatment of severe sepsis and septic shock in adults: a systematic review[J]. JAMA, 2009, 301(22): 2362-2375.
[9] Keh D, Boehnke T, Weber-Cartens S, et al. Immunologic and hemodynamic effects of “low-dose” hydrocortisone in septic shock: a double-blind, randomized, placebo-controlled, crossover study[J]. Am J Resp Crit Care Mede, 2003, 167(4): 512-520.
[10]盛志勇, 姚咏明. 努力提高脓毒症的认识水平[J]. 感染、炎症、修复, 2003, 4(1): 3.
[11]Levy B, Collin S, Sennoun N, et al. Vascular hyporesponsiveness to vasopressors in septic shock: from bench to bedside[M]. Appl Physiol Intensive Care Med, 2012: 251-261.
[12]Gustot T. Multiple organ failure in sepsis: prognosis and role of systemic inflammatory response[J]. Curr Opin Crit Care, 2011, 17(2): 153-159.
[13]李 林, 赵亚伟. APACHEⅡ 评分在外科 ICU 中的应用[J]. 中国危重病急救医学, 2002, 14(5): 308-310.
[14]高 戈, 冯 喆, 常志刚,等. 2012 国际严重脓毒症及脓毒性休克诊疗指南[J]. 中华危重病急救医学, 2013, 25(8): 501-505.
[15]Mayr FB, Yende S, Angus DC. Epidemiology of severe sepsis[J]. Virulence, 2014, 5(1): 4-11.
[16]马朋林. 认识与挑战: 脓毒症流行病学变化的启示[J]. 解放军医学杂志, 2012, 37(11): 1015-1018.
[17]Kibe S, Adams K, Barlow G. Diagnostic and prognostic biomarkers of sepsis in critical care[J]. J Antimicrob Chemother, 2011, 66(suppl 2): 33-40.
[18]Kang CI, Song JH, Chung DR, et al. Risk factors and pathogenic significance of severe sepsis and septic shock in 2286 patients with gram-negative bacteremia[J]. J Infect, 2011, 62(1): 26-33.
[19]Fry DE. Sepsis, systemic inflammatory response, and multiple organ dysfunction: the mystery continues[J]. Am Surg, 2012, 78(1): 1-8.
[20]Michalaki M, Margeli T, Tsekouras A, et al. Hypothalamic-pituitary-adrenal axis response to the severity of illness in non-critically ill patients: does relative corticosteroid insufficiency exist?[J]. Eur J Endocrinol, 2010, 162(2): 341-347.
[21]Marik PE. Glucocorticoids in sepsis: dissecting facts from fiction[J]. Crit Care, 2011, 15(3): 158-163.
[22]Arabi YM, Aljumah A, Dabbagh O, et al. Low-dose hydrocortisone in patients with cirrhosis and septic shock: a randomized controlled trial[J]. Canadian Med Assoc J, 2010, 182(18): 1971-1977.
[23]Barochia AV, Cui X, Vitberg D, et al. Bundled care for septic shock: an analysis of clinical trials[J]. Crit Care Med, 2010, 38(2): 668.
[24]Stearns-Kurosawa DJ, Osuchowski MF, Valentine C, et al. The pathogenesis of sepsis[J]. Ann Rev Pathol, 2011, 6: 19-48.
[25]Krüttgen A, Rose-John S. Interleukin-6 in sepsis and capillary leakage syndrome[J]. J Interferon Cytokine Res, 2012, 32(2): 60-65.
[26]Whiteley W, Jackson C, Lewis S, et al. Inflammatory markers and poor outcome after stroke: a prospective cohort study and systematic review of interleukin-6[J]. PLoS, 2009, 6(9): 145-151.
[27]Vouloumanou EK, Plessa E, Karageorgopoulos DE, et al. Serum procalcitonin as a diagnostic marker for neonatal sepsis: a systematic review and meta-analysis[J]. Intensive Care Med, 2011, 37(5): 747-762.
(本文编辑:齐 名; 英文编辑:王建东)
A clinical research of low-dose hydrocortisone treatment in severe sepsis
LI Liang, CAO Chang-kui, NIE Shi-nan.
DepartmentofEmergencyMedicine,NanjingGeneralHospitalofNanjingMilitaryCommand,PLA,Nanjing,Jiangsu210002,China
Objective To research the effect of low-dose hydrocortisone treatment on prognosis and inflammation of severe sepsis patient. Methods Severe sepsis patient who met the inclusion criteria were randomly divided into treatment group and control group. The two groups were evaluated with APACHE Ⅱ and given routine therapy. The treatment group was treated with additional low-dose hydrocortisone. To compare mortality, time of using of vasoactive agent, emergency intensive care unit length of stay, hospital length of stay and the concentration of interleukin-6 at 0,1,3,5 days between the two groups. Results 56 patients were enrolled in treatment group and 50 in control group. There was no significant difference of age, gender and mean APACHE Ⅱ scores in the two groups. After treatment, there was no significant difference of mortality, time of using of vasoactive agent, emergency intensive care unit length of stay, hospital length of stay and the concentration of interleukin-6 at 0,1,3,5 days in the two groups. Concentration of interleukin-6 of treatment group was decreased compared to the control group. Conclusion Low-dose hydrocortisone treatment can reduce inflammatory response in patients with severe sepsis. No definitive improvement in outcomes can be attributable to adjunctive low-dose hydrocortisone therapy.
severe sepsis; hydrocortisone; prognosis; inflammatory factor
国家自然科学基金青年基金课题(81401583);全军后勤面上项目(CNJ14L002);全军医学科技青年培育项目(13QNP038);南京军区面上项目(14MS111)
210002江苏南京,南京军区南京总医院急救医学科
聂时南,E-mail:shn_nie@sina.com
李 亮,曹昌魁,聂时南.小剂量氢化可的松治疗严重脓毒症患者的疗效观察[J].东南国防医药,2016,18(5):455-457,482.
R459.7
A
10.3969/j.issn.1672-271X.2016.05.002
2016-04-18;
2016-05-30)

