VEGF siRNA和吉西他滨联用对膀胱尿路上皮癌T24细胞株增殖和凋亡的影响
范海涛,杨 潇,郭 航,张 明
(吉林大学第二医院 泌尿外科,吉林 长春130041)
VEGF siRNA和吉西他滨联用对膀胱尿路上皮癌T24细胞株增殖和凋亡的影响
范海涛,杨 潇,郭 航,张 明*
(吉林大学第二医院 泌尿外科,吉林 长春130041)
目的 探讨VEGF si RNA联合化疗药物吉西他滨(GEM)对人膀胱癌细胞株T24增殖和凋亡的作用。方法 用GEM处理VEGF siRNA表达质粒稳定转染的T24细胞,采用噻唑蓝(MTT)比色法观察细胞增殖率,吖啶橙染色和流式细胞仪(FCM)检测细胞凋亡率,并对凋亡蛋白caspase-3的活性进行对比分析。结果 VEGF siRNA和GEM单独及联合应用均能不同程度的降低细胞增殖率,上调细胞凋亡率。FCM检测数据显示,VEGF siRNA和GEM单独应用的细胞凋亡率分别为5.1±1.3%和16.2±1.8%,与VEGF siRNA和GEM联合应用的35.4±2.7%相比较,差异有显著统计学意义(P<0.01)。两者在诱导caspase-3活性方面也具有良好的协同增效作用。结论 VEGF siRNA和GEM对人膀胱癌细胞株T24的增殖和凋亡均有不同程度的影响,但两者联合应用效果更好,这提示分子靶向用药的基因治疗与细胞毒药物的化疗联合治疗可能是提高疗效、减少膀胱癌术后复发风险的主要途径。
膀胱肿瘤;血管内皮生长因子;RNA干扰;吉西他滨;细胞增殖;凋亡
(ChinJLabDiagn,2016,20:1830)
血管内皮生长因子(vascular endothelial growth factor,VEGF)作为活性强、特异性高的促血管生成因子对膀胱癌发生发展以及预后的影响已被以往大量的研究所证实,而且在以其为靶点的膀胱癌抗血管生成治疗中也取得了一定成绩,但总体疗效并不理想[1]。由于RNA干扰(RNA interference,RNAi)技术有高效性,高特异性,高稳定性和可遗传性等特点,与其他抑制基因表达的技术相比具有明显优势,目前已被广泛采用[2]。近年来,肿瘤综合治疗模式日益受到人们的关注和重视,其中分子靶向用药的基因疗法与细胞毒药物的化疗联合治疗策略是迄今肿瘤治疗研究的热点之一[3,4]。本研究对VEGF siRNA+吉西他滨(gemcitabine,GEM)共用抑制膀胱尿路上皮癌(以下简称膀胱癌)细胞生长,促进细胞凋亡的作用进行了初步探索,现报告如下。
1 材料与方法
1.1 一般材料 人膀胱癌细胞株T24(中国科学院上海细胞所),RPMI-1640培养基和标准小牛血清(Hyclone公司),PGC-siVE-GF质粒和对照质粒PGC-CONT(本实验室构建),Caspase-3萤光分析试剂盒(clontech公司),流式细胞仪(Coulter公司),酶标仪(Bio-Rad公司),GEM(江苏豪森药业)。
1.2 实验方法 ①细胞培养:PGC-siVEGF质粒和对照质粒PGC-CONT稳定转移的T24细胞(T24/PGC-siVEGF,T24/PGC-CONT)由本实验室传代保存。采用含10%小牛血清,青霉素100 u/ml和链霉素100 μg/ml的RPMI-1640培养液,在37℃,5%CO2饱和湿度培养箱中培养;②噻唑蓝(MTT)比色法检测细胞增殖率:将T24,T24/PGC-CONT、T24/PGC-siVEGF细胞以1×103细胞/孔的密度接种于96孔板,培养12 h后加入PBS或终浓度0.05 g/L的GEM,把细胞分为5组,即空白对照组、载体对照组、VEGF siRNA组、GEM组和联合用药组(VEGF siRNA+GEM)。细胞培养12、24、36、48 h后加入MTT,4 h后加入DMSO振荡溶解结晶,在酶标仪上检测570 nm处的吸光度值(A),计算各组细胞的增殖率。细胞增殖率=实验组平均A值/空白对照组平均A值×100%。实验连续重复3次;③吖啶橙染色和流式细胞仪(FCM)分别检测细胞凋亡率:用0.1%的吖啶橙加入用胰酶消化后的悬液T24细胞,涂片,荧光显微镜观察细胞形态及颜色。凋亡细胞变圆,核/浆比例增大,胞浆颗粒增多,胞核皱缩变形,大小不均,早期凋亡细胞核呈圆缩状的绿色荧光,晚期凋亡细胞核呈枯缩状的桔黄色荧光。凋亡细胞计数,计算凋亡率。实验连续重复3次。将T24细胞或转染T24细胞分别接种于6孔板。各自加入PBS或GEM处理48 h后收集,用胰酶消化制成单细胞悬液,PBS洗涤后逐滴缓慢加入-20℃预冷的70%乙醇中4℃固定24 h,PBS洗涤去除固定液,加入RNaseA和碘化丙啶染液(PI)重悬细胞,避光染色2 h时用FCM检测,MultiCycler软件分析结果;④ 检测凋亡蛋白caspase-3活性:在加入GEM后2、4、6、8、12、24 h后分别收集细胞,每组6个样本数,每个样本所用的T24细胞浓度均为1×106.用荧光分光光度计检测荧光底物AFC的强度,以此确定caspase-3活性。按照clontech公司caspase-3荧光分析试剂盒操作说明书进行检测,结果绘制成标准曲线,计算出caspase-3活性。

2 结果
2.1 对T24细胞增殖的影响 MTT比色法检测各组细胞在12、24、36、48 h的增殖率,结果表明VEGF siRNA和GEM单独处理的细胞增殖率从24 h开始明显低于对照组(P<0.05),而联合用药(VEGF siRNA+GEM)组细胞增殖率在12 h时即明显低于对照组(P<0.05),载体和空白对照两组的细胞增殖率差异无统计学意义(P>0.05)。如图1所示。
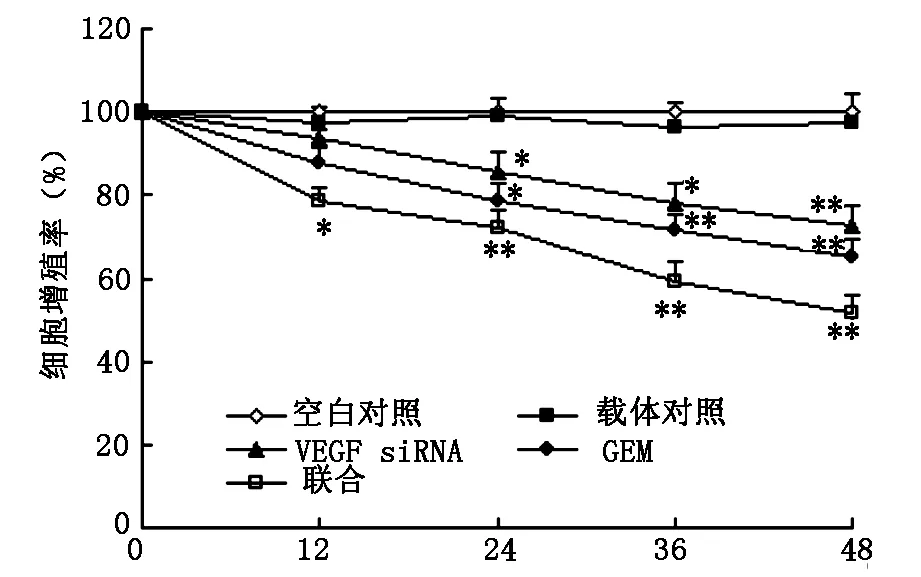
图1 细胞增殖曲线;※P<0.05,※※P<0.01vs
2.2 对T24细胞凋亡的作用 吖啶橙染色结果显示:VEGF siRNA组,GEM组和VEGF siRNA+GEM组的细胞凋亡率依次为6.4%、19.2%和38.1%;FCM检测细胞凋亡结果的数据分别为VEGF siRNA组5.1±1.3%,GEM组16.2±1.8%,VEGF siRNA+ GEM组35.4±2.7%。两种检测结果均指出,单独用药或联合治疗均能不同程度的诱导与促进T24细胞凋亡,但联合用药作用更大,效果更好。组间比较差异有统计学意义(P<0.05)。与载体组和空白对照组相比,差异有显著统计学意义(P<0.01)。如图2和图3所示。
2.3 对caspase-3活性的影响 在VEGF siRNA和GEM诱导细胞凋亡的过程中,caspase-3活性上调均具有时效相关性,但变化趋势不同。随时间延长VEGF siRNA组caspase-3活性升高,GEM组在作用4 h后caspase-3活性达最高峰,随后逐渐下降,但始终高于载体对照组。VEGF siRNA+GEM组在1 h和2 h时与GEM组比较:caspase-3活性无明显差异,但自4 h始,其活性一直高于GEM组(P<0.05)。caspase-3活性变化顺次为:VEGF siRNA+GEM组>GEM组>VEGF siRNA组>载体对照组,组间比较均具有统计学意义(P<0.05)。如表1所示。

图2 吖啶橙染色检测细胞凋亡率(X400)
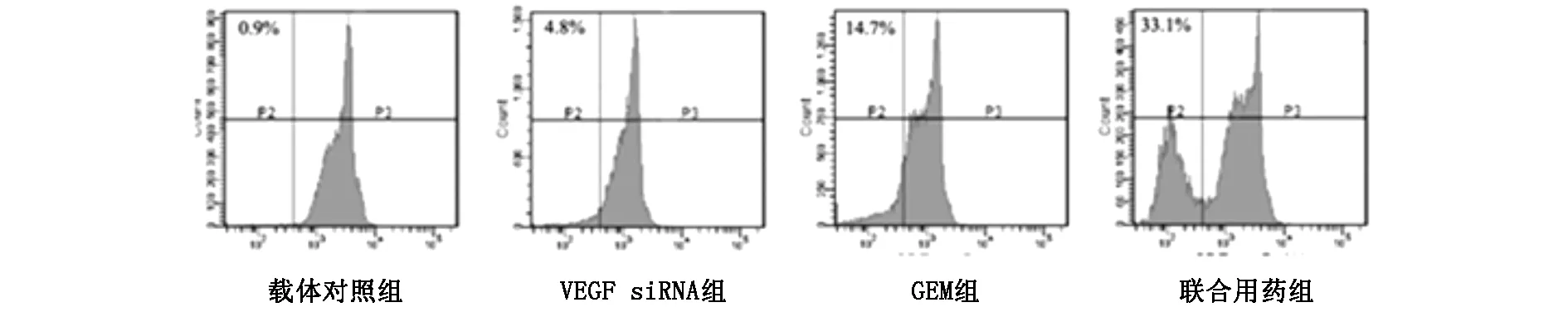
图3 FCM检测细胞凋亡率

组别时间(h)12481624载体对照242.5±6.5241.3±8.6242.3±10.5243.1±8.9241.4±9.0242.8±7.9VEGFsiRNA248.5±11.6254.7±9.8287.2±13.6320.5±10.8*395.3±8.6*428.7±12.8*GEM319.8±11.5*407.6±17.3*729.6±12.1*458.3±15.5*422.7±9.4*396.2±10.8*联合用药403.7±12.2*483.3±16.6*785.3±20.5*△693.1±18.2*△675.2±17.3*△671.8±13.5*△
*与载体对照组比较,P<0.05;△与GEM组相比,P<0.05
3 讨论
临床资料统计结果表明,无论是以VEGF为靶点的抗血管生成的基因疗法还是针对癌细胞的细胞毒药物的化疗,在恶性肿瘤的治疗中,特别是在预防肿瘤术后复发的后续治疗过程中均取得了一定成绩和获得了不同程度的疗效。但是,根据近年来的相关数据显示,由于单纯基因治疗和单纯化疗的总体有效率仍较低,并且肿瘤临床缓解时间及患者术后生存时间较短[5,6]。因此,研究人员普遍认为只有探索更为高效和更为合理地联合治疗方案,才能提高疗效从而更好地改善恶性肿瘤患者的生活质量并延长其生存时间。目前广受青睐的分子靶向治疗与化疗药物联用似有着巨大潜力和良好前景。
本实验通过VEGF siRNA沉默VEGF和通过GEM诱导细胞凋亡的作用达到了较好抑制肿瘤血管生成和遏制肿瘤生长的效果。在将两种不同性质的药物联合应用时,其疗效大大提高,这是我们初步认为,以RNA干扰为基础的基因治疗与化疗联用可能是膀胱癌治疗尤其是提高术后疗效的新的有效手段之一。
另外,鉴于caspase-3属细胞凋亡效应因子,其在激活形成凋亡信号传导的级联反应和介导凋亡的过程中起着非常重要的作用[7]。由于细胞凋亡与肿瘤的生长转移关系密切,故实验同时对caspase-3的活性进行了检测,检测结果证实,VEGF siRNA和GEM均能不同程度的上调caspase-3活性。VEGF siRNA的这种作用很可能是通过降低凋亡抑制因子survivin表达来实现的[8]。而GEM是一种破坏细胞复制的二氟核苷素抗代谢物抗癌药,本身即有通过诱导细胞凋亡来抑制肿瘤生长的作用。这可能也是VEGF siRNA+GEM组作用最大、效果最好的根本原因。
本实验数据结果初步显示,靶向VEGF的RNAi和化疗药物GEM联用具有1+1>2的疗效,有望为临床膀胱癌的治疗水平带来新的提高。
[1]Feng J,Zhang Y,Xing D.Low power laser irradiation (LPLI) promotes VEGF expres- sion and vascular endothelial cell prolifer- ation through the activation of ERK/spl pathway[J].Cell Signal,2012,24(6):1116.
[2]Carthew RW,Sontheimer EJ.Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136 (4) :642.
[3]Costantini C,millard F.Updated on chem- otherapy in the treatment of urothelial carcinoma[J].Scientific World Journal,2011,11:1981.
[4]Ghosh M,Brancato SJ,Agarwal PK,et al.Targeted therapies in urothelial carci- noma[J].Curr Opin Oncol,2014,26 (3):305.
[5]Garg M.Prognostic and therapeutic applications of the molecular events in clinical management of urothelial carci- noma of bladder[J].J Exp Ther Oncol,2014,10(4):301.
[6]Utki H,Watanabe M,Kaku H,et al.A novel gene expression system for detecting viab-le bladder cancer cells[J].Int J Oncol,2012,41 (1) :135.
[7]Coffey RN,Watson RW,Fltzpatrick JM.Signaling for the caspase:their role in prostate cell apoptosis[J].J Urol,2001,165:5.
[8]Sun YW,Xuan Q,Shu QA,et al.Correlation of tumor relapse and elevated expression of survivin and vascular endothelial grow- th factor in superficial bladder transitional cell carcinoma[J].Gene mol Res,2013,12 (2):1045.
Influence of proliferation and apoptosis of bladder cancer cell line T24 by VEGF siRNA combining with gemcitabine
FANHai-tao,YANGXiao,GUOHang,etal.
(DepartmentofUrology,theSecondHospitalofJilinUniversity,Changchun130041,China)
Objective To study the role of VEGF siRNA combining with gemcitabine (GEM) in inducing the apoptosis of human bladder cancer cell line T24.Methods process T24 cell that transfected stably by VEGF siRNA expressed plasmid.Using MTT assay observing the survival of cell,using acridine orange staining and flow cytometry (FCM) detecting the apoptosis rate of cells,and analyze the activity apoptotic protein caspase-3.Results VEGF siRNA and GEM alone or in combination can both can induce the survival of cell and increase the apoptosis rate of cell in varying degrees.The FCM detecting date indicates,the apoptosis rate of cells by using VEGF siRNA or GEM alone is 5.1 ± 1.3% and 16.2 ± 1.8%,compared with the apoptosis rate by using VEGF siRNA and GEM in combination is 35.4±2.7%,the difference had statistical significance(P<0.01).Both has a good synergy in the induction of caspase-3 activity.Conclusion VEGF siRNA and GEM has promoting roles in the apoptosis of human bladder cancer cell line T24 in varying degrees but it has a better effect when they combine with each other.This suggests the combined therapy of gene therapy of molecularly targeted therapy and chemotherapy of drug cytotoxic drugs may be the main pathway to improve the efficacy and reduce the risk of recurrence of bladder cancer after surgery.
Bladder tumor;Vascular endothelial growth factor;RNA interference;Gemcitabine;Cell proliferation;apoptosis
吉林省自然科学基金项目(编号:20150101195JC)
1007-4287(2016)11-1830-04
R737.14
A
范海涛,医学博士,副教授,研究方向:泌尿系肿瘤的治疗与预防.
2015-08-11)
*通讯作者

