过表达eNOS的MSCs移植抑制肺动脉高压大鼠NF-κB表达
赵科研,郭晓东,李红岩,佟昌慈,张玉彪,王辉山,侯明晓*
(沈阳军区总医院 1.心血管外科;2.急诊医学部,辽宁 沈阳110840)
*通讯作者
过表达eNOS的MSCs移植抑制肺动脉高压大鼠NF-κB表达
赵科研1,郭晓东1,李红岩1,佟昌慈2,张玉彪2,王辉山1,侯明晓2*
(沈阳军区总医院 1.心血管外科;2.急诊医学部,辽宁 沈阳110840)
目的 研究过表达eNOS的骨髓间充质干细胞(MSCs)移植对肺动脉高压(PAH)大鼠的NF-κB影响。方法 构建过表达eNOS基因骨髓间充质干细胞;成年雄性Sprague Dawley大鼠,建立分流性PAH模型36只,每组12只, Shunt组;MSCs组;MSCs+eNOS 组,正常大鼠为Control 组。由中心静脉注入细胞,2周后进行测定血流动力学指标及肺组织病理变化,westernblot及荧光定量PCR测定肺组织表达NF-κB的变化。结果 MSCs移植能降低右心室收缩压,减轻肺病理改变, MSCs+eNOS组下降更明显。NF-κB的mRNA和蛋白表达在Shunt组表达最强,Control 组表达较弱,MSCs组、MSCs+eNOS 组较Shunt组明显降低,且MSCs+eNOS 组更显著。结论 MSCs和eNOS抑制高血流量PAH大鼠的NF-κB表达对高血流量的发挥治疗作用。
NF-κB;内皮型一氧化氮合成酶;分流性;动物模型; 肺动脉高压
(ChinJLabDiagn,2016,20:1827)
NF-κB是一种核转录因子,存在于真核生物体内,参与生物体内很多重要的生理反应[1],NF-κB在肺动脉高压(PAH)的形成进程中扮演着重要的角色,在肺动脉血管重构中也发挥一定的生物学作用[2]。干细胞移植治疗的再生手段和基因治疗等研究不断应用于PAH的治疗,以打断PAH的恶性循环[3-5],是研究的热点。采用骨髓间充质干细胞(MSCs)转染eNOS基因,移植肺动脉高压大鼠,NF-κB如何变化,我们进行如下研究。
1 材料与方法
1.1 实验材料
1.1.1 实验对象 成年雄性Sprague Dawley (SD)大鼠48只,体重150-200 g,周龄6周。购自沈阳军区总医院实验动物中心。
1.1.2 主要药品试剂与仪器 NOS-3(eNOS)抗体(Santa),GAPDH(Santa)和NF-κB (Abcam),RT-PCR试剂盒(大连宝生物Takara公司),DNA 扩增仪(PT一200型)为美国PE公司产品,荧光定量PCR扩增仪(美国Applied Biosystems公司GeneAmp7300)。
1.2 方法
1.2.1 细胞准备 构建过表达eNOS(人类NOS3)慢病毒载体(上海吉凯公司),含有GFP标记。慢病毒转染eNOS到SD大鼠MSCs(Cyagen公司),第三代MSCs以0.25%的含EDTA的胰酶消化,PBS冲洗,1 000个细胞/μL浓度以PBS悬浮,置于冰上直到进行移植。
1.2.2 实验动物分组及细胞移植 采用左侧颈总动脉与左颈外静脉吻合分流[6]建立高血流肺动脉高压模型,12周后再次麻醉,每组12只:Shunt组;MSCs组;MSCs+eNOS 组;同一批正常大鼠12只做为Control 组。通过游离的右侧颈外静脉进行移植:MSCs组:1×106MSCs;MSCs+eNOS 组:1×106转染eNOS的MSCs ;Shunt组及Control 组:等容积PBS。缝合颈部切口,大鼠清醒后常规饲养。
1.2.3 系统血流动力学指标 右心微导管测右心室收缩压(RVSP),压力波形经BL-420E系统记录并保存。
1.2.4 病理学检查 取大鼠的肺组织,置于10%中性福尔马林液中固定,经常规乙醇脱水,二甲苯透明,石蜡包埋,切片,经HE染色,光镜显微镜观察肺组织。分离心脏组织,测定右心室/(左心室+室间隔)质量比。
1.2.5 MSCs肺组织定位 细胞移植2周后,处死MSCs+eNOS 组大鼠时,取右上肺,在暗光下操作,采用OCT包埋,冰冻切片,采用多聚甲醛固定,DAPI 50 mg/L复染,甘油封片,荧光显微镜下观察GFP表达。
1.2.6 western blot 检测 提取肺组织蛋白,进行SDS-PAGE电泳,转膜,封闭加入特异性一抗4°C杂交过夜,次日用1×TBST洗膜3次(10 min/次),然后用1∶5000稀释的辣根过氧化物酶标记的二抗,室温缓慢摇晃杂交2 h。l×TBST洗膜3次(10 min/次)。ECL(Bio-rad)发光,Western Blot成像系统采集图像。
1.2.7 荧光定量PCR 设计eNOS上游引物:5′- AGT GGC TGG TAC ATG AGC AC -3′,下游引物5′-GGT GAC TTT GGC TAG CTG GT-3′ ;NF-κB上游引物5′-CGG CCA TGG ACG AAC TGT TC-3′,下游引物5 ′-GAA CAG TTC GTC CAC ATG GCC CAC TTC -3′;GAPDH上游引物:5 ′- ACG GCA AGT TCA ACG GCA CAG -3′,下游引物:5′- GAC GCC AGT AGA CTC CAC GAC A -3′。提取总RNA,采用目的基因和内参基因进行荧光定量PCR反应,经逆转录反应,荧光定PCR法检测上述基因mRNA表达。
2 结果
2.1 MSCs的eNOS表达
细胞均呈长梭形生长,极性较好,生长速度较快,转染携带慢病毒后,可见细胞呈细胞浆绿色表达。移植2周后,肺脏中可见明显绿色荧光表达。
2.2 移植后病理变化
细胞移植2周后MSCs组RVSP明显下降,且转染eNOS的MSCs能进一步降低RVSP。Shunt组肺小动脉中膜增厚、管腔狭窄,炎症细胞增多,而MSCs组和MSCs+eNOS 组肺小动脉中膜增厚程度明显减轻。 心室体重比及右心室肥厚指数在MSCs组和MSCs+eNOS 组较分流组明显下降,转染eNOS基因未进一步减轻双心室的肥大。
2.3 NF-κB通路表达变化
荧光定量RT-PCR 和Westernblot 分析结果显示,细胞移植2周后,NF-κB的mRNA和蛋白表达在Shunt组表达最强,Control 组表达较弱,MSCs组、MSCs+eNOS 组较Shunt组明显降低,且MSCs+eNOS 组更显著(P<0.05)(图1)。
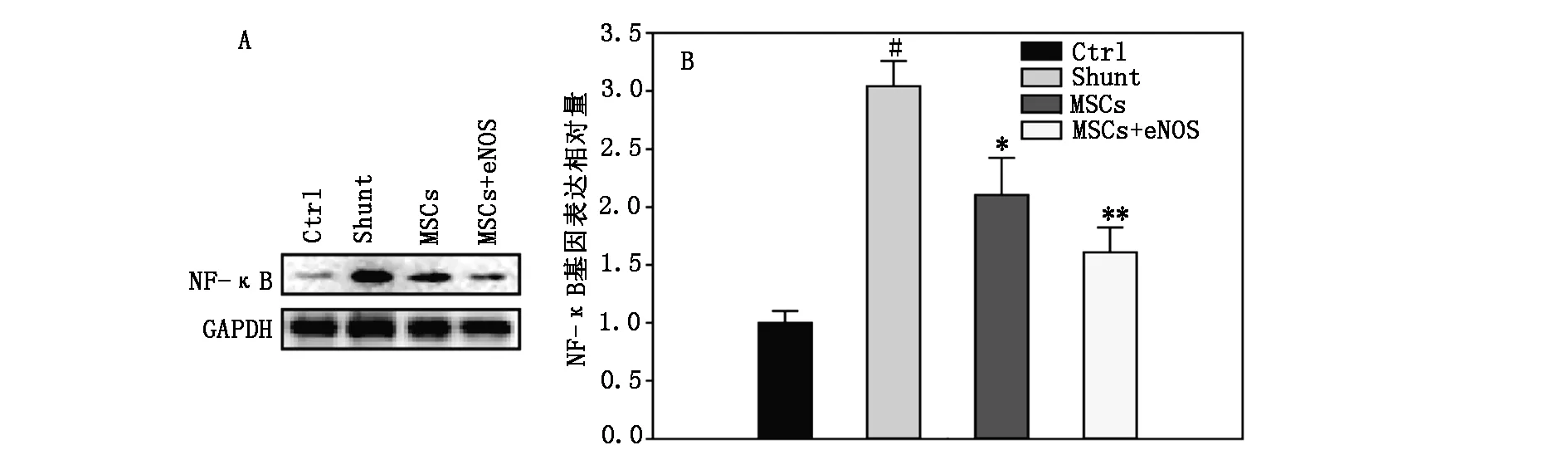
图1 细胞移植后NF-κB mRNA和蛋白表达变化
3 讨论
NF-κB最初由Sen等[1]在B淋巴细胞中发现,对体内的绝大多数细胞因子的产生、活化起调控作用,进而影响细胞功能,是凋亡、炎症及免疫反应等过程中的重要调节因子[7]。NF-κB参与生物体内很多重要的生理反应,该信号通路促进平滑肌细胞增殖、抑制调亡。
本实验发现,MSCs移植及联合eNOS移植均能够降低RVSP,改善肺组织小动脉内膜及中层厚度,增殖减缓,抑制了肺动脉高压的进展,具有明显的肺组织重构作用。结果显示NF-κB mRNA和蛋白表达水平在分流组明显最高,正常对照组低,实验组MSCs移植则明显降低,转染eNOS移植则进一步降低,说明移植后通过抑制NF-κB通路激活,参与体内基因的转录,从而抑制细胞的增殖,MSCs及eNOS通过调控NF-κB表达发挥作用。
[1]Sen R,Baltimore D.Inducibility of kappa immunoglobulin enhancer-binding protein NF-kappaB by a posttranslational mechanism[J].Cell,1986,47(6):921.
[2]Hosokawa S,Haraguchi G,Sasaki A,et al.Pathophysiological roles of nuclear factor kappaB (NF-kB) in pulmonary arterial hypertension:effects of synthetic selective NF-kB inhibitor IMD-0354[J].Cardiovasc Res,2013 ,99(1):35.
[3]Campbell AIM,Kuliszewski MA,and Stewart DJ.Cell-Based Gene Transfer to the Pulmonary Vasculature Endothelial Nitric Oxide Synthase Overexpression Inhibits Monocrotaline-Induced Pulmonary Hypertension[J].Am J Respir Cell Mol Biol,1999,21(5):567.
[4]Zhao Q,Liu Z,Wang Z,et al.Effect of Prepro-Calcitonin Gene-Related Peptide-Expressing Endothelial Progenitor Cells on Pulmonary Hypertension[J].Ann Thorac Surg,2007,84(2):544.
[5]Liu R,Wu S,Cao G,et al.Transfection of human hepatocyte growth factor gene inhibits advancing pulmonary arterial hypertension induced by shunt flow in a rabbit model[J].Transplant Proc,2013,45(2):705.
[6]ZHAO Ke-yan,WANG Hui-shan,SHANG Chang-qing,et al.Establishment model of new pattern and arteriovenous shunt of pulmonary artery hypertension in rats[J].Chin J Lab Diagn,2014,18(10):1586.
[7]Siebenlist U,Brown K,Claudio E.Control of lymphocyte development by nuclear factor-kappaB[J].Nat Rev Immunol,2005,5 (6):435.
Implantation of mesenchymal stem cells over-expressing eNOS prevents expression of NF-κB in rats with pulmonary arterial hypertension
ZHAOKe-yan,GUOXiao-dong,LIHong-yan,etal.
(DepartmentofCardiacSurgery,ShenyangNorthernHospital,Shenyang110840,China)
Objective To observe effects of mesenchymal stem cells (MSCs)over-expressing eNOS on NF-κB in rats with pulmonary artery hypertension (PAH).Methods MSCs were transfected by lentivirus expressing eNOS gene.Adult male Sprague Dawley rats were made as shunted PAH models,then were randomly divided into three groups:group shunt,group MSCs and goup MSCs+eNOS(n=12,respectively).The control group was matched normal rat.MSCs were injected through central vein.Two weeks later,hemodynamic index and lung biopsy were determined.Fluorescence quantitative PCR (FQ-PCR)and Westernblot were used to determine the level of NF-κB.Results MSCs can reduce right ventricular systolic pressure and attenuated lung’s lesions.And it was more obviously in group MSCs+eNOS.The level of mRNA and protein of NF-κB was highest in group shunt,lower in group MSCs but lowest in group MSCs+eNOS.Conclusion MSCs and eNOS act on rats with high flow PAH by preventing the expression of NF-κB.
NF-κB;eNOS;shunt;animal model;pulmonary artery hypertension
1007-4287(2016)11-1827-03
R543.2
A
2016-03-18)

