Bcl-2抑制剂S1通过内质网途径对小鼠黑色素瘤B16细胞移植瘤生长抑制作用
李亚平,吴 瑶,颜晓羽,薛亚楠,路圣垚,苏 静*
(1.吉林省人民医院 皮肤科,吉林 长春130021;2.吉林大学基础医学院 病理生理学系,吉林 长春130021)
Bcl-2抑制剂S1通过内质网途径对小鼠黑色素瘤B16细胞移植瘤生长抑制作用
李亚平1,吴 瑶2,颜晓羽2,薛亚楠2,路圣垚2,苏 静2*
(1.吉林省人民医院 皮肤科,吉林 长春130021;2.吉林大学基础医学院 病理生理学系,吉林 长春130021)
目的 建立小鼠黑色素瘤B16细胞移植瘤模型,探讨Bcl-2抑制剂S1对其生长的影响及其作用机制。方法 将小鼠黑色素瘤B16细胞种植至小鼠腋下,14天后开始用药物治疗,隔天给药。实验分为对照组、S1组(0.6 mg/kg),28天后处死。测量移植瘤的重量。并采用免疫组化法检测内质网应激、凋亡相关蛋白等蛋白表达水平的变化。结果 与对照组相比,S1处理组能够明显降低移植瘤体积、重量,差异有统计学意义(P<0.05);应用S1后移植瘤中Caspase3表达增加、抗凋亡蛋白Bcl-2表达减少、内质网应激相关蛋白GRP78以及内质网应激-凋亡相关蛋白CHOP表达水平明显上升,差异有统计学意义(P<0.05)。结论 小分子化合物S1可以抑制小鼠黑色素瘤B16细胞移植瘤的生长,其作用途径可能同内质网凋亡信号通路相关。
内质网应激;细胞凋亡;Bcl-2抑制剂
(ChinJLabDiagn,2016,20:1805)
黑色素瘤是临床上较为常见的皮肤粘膜和色素膜恶性肿瘤,传统放疗、化疗疗效不佳,患者预后极差,亟待寻找新的治疗方法以及有效药物靶点[1,2]。B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia2,Bcl2)家族蛋白分为抗凋亡Bcl-2蛋白和促凋亡Bcl-2蛋白,Bcl-2蛋白家族不仅参与调控线粒体途径的凋亡,而且可能还参与调控内质网的稳定,介导内质网应激相关凋亡[3]。前期研究表明Bcl-2小分子抑制剂S1能够通过线粒体途径诱导人卵巢癌细胞凋亡[4],但S1在体内是否能够对黑色素瘤具有抑制作用尚未报道。本文以小鼠黑素色素瘤移植瘤为研究对象,观察Bcl2抑制剂S1对其生长速度、内质网应激水平以及凋亡相关蛋白的影响,探讨S1对于小鼠黑色素瘤体内移植瘤的抑制作用及其机制。
1 材料与方法
1.1 材料
BALB/C 小鼠购自吉林大学动物实验中心,雄性,平均体重18g;S1 由大连理工大学精细化工国家重点实验室设计并提供;anti-GRP78 抗体、anti-Bcl-2抗体、anti-Caspase3抗体、anti-CHOP抗体购自美国 Santa Cruz公司;羊抗鼠 IgG-HRP 和羊抗兔IgG-HRP 购自碧云天公司。B16细胞由吉林大学基础医学院病理生理学系保存,含 10%胎牛血清的IMDM培养基培养。
1.2 小鼠黑色素瘤B16细胞皮下移植瘤模型的建立
将对数生长期的B16细胞与生理盐水混合,制成单细胞悬液,按每只1×107个细胞注入小鼠腋下,共20只。14天后,出现可触摸的质硬肿块。待移植瘤生长至约 0.3 cm2,随机分为2组,每组10只。对照组腹腔注射生理盐水, 治疗组(给药组) 腹腔S1注射(生理盐水稀释,浓度0.6 mg/kg)。28天后结束实验,麻醉处死小鼠,手术切除肿瘤组织。
1.3 免疫组织化学染色及结果判定
应用免疫组织化学染色的方法,对石蜡包埋的病理切片进行特异性抗体标记染色。免疫组化染色以细胞胞浆内和/或核内出现棕黄色颗粒者为阳性,阳性细胞范围分为0-3级:无阳性细胞为0;1%-10%为1;11%-50%为2;51%以上为3;染色强度分为0-3级,阴性为0,弱阳性为1,中度阳性为2,强阳性为3。两者之和即为某蛋白表达的免疫组化评分。
2 结果
2.1 S1对小鼠黑色素瘤移植瘤生长的影响
接种小鼠黑色素瘤B16细胞后,20只小鼠均存活并有肿瘤形成,成瘤率100%。随机分组时,对照组和治疗组肿瘤体积大致相同。处死后称重,对照组和治疗组瘤重分别为(5.36±0.49)g和(3.41±0.37) g,两者相比,有显著性差异(P<0.05)。治疗组同对照组相比,肿瘤生长明显受抑制,S1对小鼠黑色素B16移植瘤的生长有抑制作用。
2.2 S1对小鼠黑色素瘤移植瘤凋亡相关蛋白表达的影响
免疫组织化学法检测对照组和S1治疗组移植瘤组织内凋亡相关蛋白Caspase3表达的水平。结果显示,蛋白在对照组的表达评分的平均分为2.35±0.30,在治疗组的表达评分为4.63±0.47。治疗组的Caspase3蛋白的表达同对照组相比,表达水平升高,差异具有统计学意义(P<0.05)。见图1。
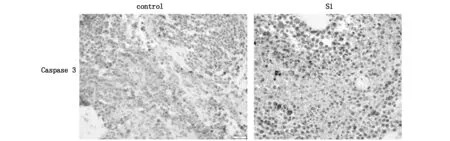
图1 免疫组化检测移植瘤组织Caspase3蛋白表达(×400)
2.3 S1对抗凋亡蛋白Bcl-2蛋白表达水平的影响
免疫组织化学法检测对照组和S1治疗组移植瘤组织内抗凋亡蛋白Bcl-2表达的水平。结果显示,Bcl-2蛋白在对照组的表达评分为5.36±0.52,在治疗组的表达评分为2.16±0.39。治疗组的Bcl2蛋白表达同对照组相比,表达水平降低,差异具有统计学意义(P<0.05)。见图2。
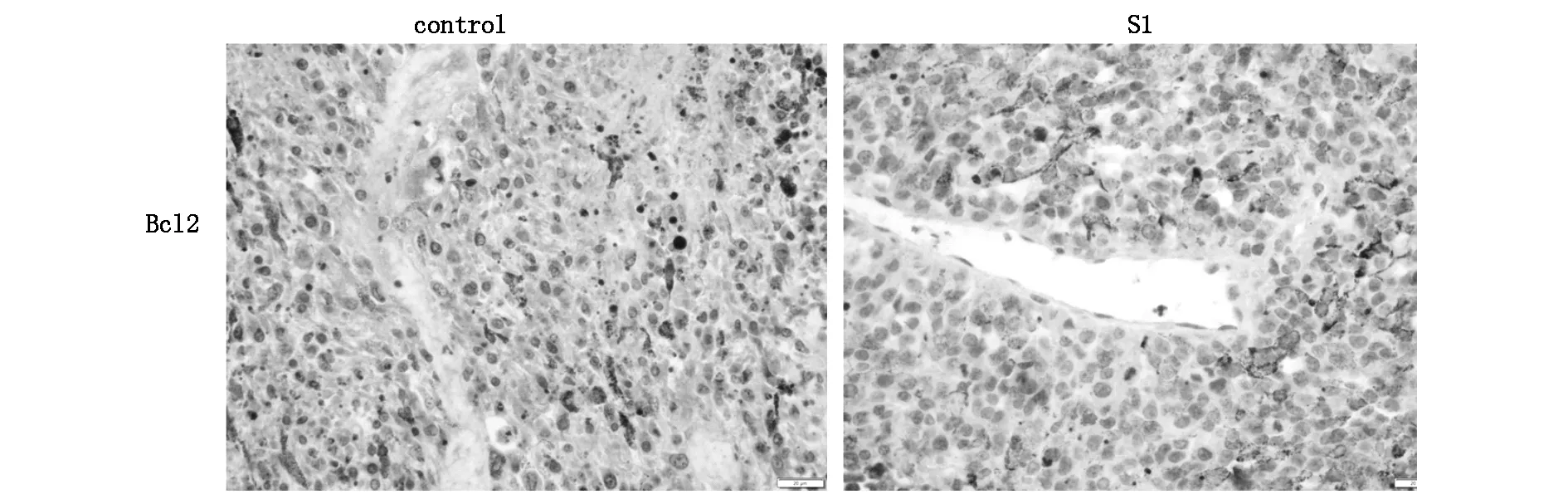
图2 免疫组化检测移植瘤组织Bcl-2蛋白表达(×400)
2.4 S1对内质网应激相关蛋白GRP78、CHOP的表达水平的影响
免疫组织化学法检测对照组和S1治疗组移植瘤组织内质网应激相关蛋白GRP78、CHOP蛋白表达的水平。GRP78、CHOP蛋白在对照组的表达评分分别为2.76±0.58,2.82±0.43,在治疗组的表达评分为5.25±0.67,4.69±0.36。 治疗组的GRP78、CHOP蛋白表达同对照组相比,表达水平升高,差异具有统计学意义(P<0.05)。见图3。
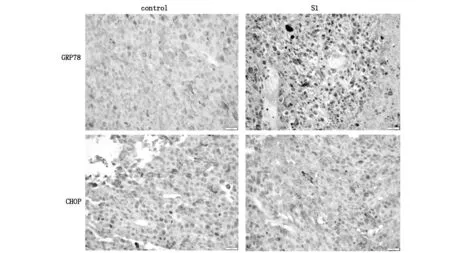
图3 免疫组化检测移植瘤组织GRP78、CHOP蛋白表达(×400)
3 讨论
黑色素瘤是常见的皮肤肿瘤,放化疗效果差,患者预后不佳。寻找有效治疗黑色素瘤的靶点可能是黑色素瘤治疗的突破点[5]。小分子抑制剂S1是大连理工大学精细化工国家重点实验室自主设计的靶向药物,研究表明S1能够通过线粒体途径、内质网应激途径以及自噬通路等多种途径促进肿瘤细胞凋亡,其对卵巢癌细胞、恶性胶质瘤细胞均具有抑制作用。另有研究表明内质网应激可以通过PERK-ATF4-CHOP/Bim 以及IRE1a-ASK1-JNK-AP-1/HSF1-HSP70通路在抗肿瘤药物诱导黑色素瘤的凋亡中发挥作用[6,7]。
内质网具有多种管家功能(housekeeping functions),是调节细胞稳态的重要细胞器。内质网分子伴侣Bip,GRP78(78-kDa glucose-regulated protein),在内质网稳态下同PERK、IREK1、ATF6等结合,使其失活[8];当缺氧饥饿感染等状态,能够诱发内质网应激,内质网应激时GRP78同这些感受因子解离使其进一步活化下游分子,由PERK、IREK1、ATF6等感受因子以及JNK(c-Jun N-terminal kinase 1)及其下游转录因子XBP1、ATF4、CHOP等信号网络调控并发挥作用。轻度应激状态下这些蛋白能够修复细胞稳态,但是在长期激烈刺激存在,诱导内质网相关性细胞凋亡。此外有报道表明内质网应激时GRP78蛋白表达能够上调,通过Bcl-2家族蛋白(Bim,Noxa,Puma)诱导线粒体途径的细胞死亡[9]。
本研究中应用靶向抗肿瘤药物BH3-only蛋白模拟物S1,以小鼠黑色素移植瘤为研究对象,探讨其抗肿瘤作用及其机制[10]。实验研究发现,S1能够明显抑制B16移植瘤的生长速度和体积大小,免疫组化染色结果显示S1能够引起移植瘤中Caspase3蛋白表达增高,提示S1对移植瘤的抑制作用可能是由凋亡引起的。进一步研究发现S1能够使黑色素移植瘤中的Bcl2蛋白表达下降,表明S1能够诱导其发生凋亡;而同对照组相比,应用S1治疗组内质网应激相关蛋白GRP78、CHOP等蛋白表达增加,提示内质网应激可能参与S1诱导的小鼠黑色素瘤移植瘤细胞凋亡以及抑制肿瘤生长作用。
[1]中国黑色素瘤诊治指南(2011版)[J].临床肿瘤学杂志,2012,2:159.
[2]郭 军.黑色素瘤治疗研究进展[J].科技导报,2014,26:15.
[3]Wang X,Olberding KE,White C,et al.Bcl-2 proteins regulate ER membrane permeability to luminal proteins during ER stress-induced apoptosis[J].Cell Death and Differentiation,2011,18:38.
[4]周翔宇,刘 宁,闫 珊,等.S1通过线粒体途径诱导人卵巢癌细胞凋亡[J].中国老年学杂志,2014,01:122.
[5]练 炼,马德亮,陶 敏.恶性黑色素瘤的分子靶向治疗进展[J].实用肿瘤杂志,2010,02:109.
[6]Selimovic D,Badura HE,El-Khattouti A,et al.Vinblastine-induced apoptosis of melanoma cells is mediated by Ras homologous A protein (Rho A) via mitochondrial annonmitochondrial-dependent mechanisms[J].Apoptosis,2013,18:980.
[7]Selimovic D,Porzig BB,El-Khattouti A,et al.Bortezomib/proteasome inhibitor triggers both apoptosis and autophagydependent pathways in melanoma cells[J].Cell Signal ,2013,25:308.
[8]Wang W,Groenendyk J,Michalak M.Endoplasmic reticulum stress associated responses in cancer[J].Biochim Biophys Acta,2014,1843(10):2143.
[10]Pl tz M,Eberle J.BH3-only proteins: possible proapoptotic triggers for melanoma therapy[J].Exp Dermatol,2014 ,23(6):375.
Inhibitory Effects of Bcl-2 inhibitor S1 on Growth of mouse melanoma B16 Cell Xenografts mediated by Endoplasmic Reticulum Stress
LIYa-ping,WUYao,YANXiao-yu,etal.
(People’sHospitalofJilinProvince,Changchun130021,China)
Objective This study was to establish tranplanted mouse melanoma models and investigate the inhibitory effects of Bcl-2 inhibitor S1 on them.Methods Mouse melanoma B16 cells were implanted into the mice under the armpit.The mice were treated with S1 every two days after 14 days,and were killed 28 days latter.Tumor volume and weight were measured.The experssion of proteins involed in Endoplasmic Reticulum Stress(ERS) and apoptosis were observed by immunohistochemistry.Results Compared with the control group,the average tumor volume was smaller and the average tumor weight were lighter in S1 group;the average experssion of Capase3 was higher,the experssion of Bcl-2 was lower,the experssion of proteins relating with ERS-GRP78 and CHOP were higher.Conclusion S1 inhibits the growth of B16 cells xenografts in mice,ERS may be related to the process.
Endoplasmic Reticulum Stress;apoptosis;Bcl-2 inhibitor
国家自然科学基金面上项目(81472419,81272876)
1007-4287(2016)11-1805-04
R392
A
2016-03-21)
*通讯作者
——疾病防治的新靶标

