短尾高原鳅繁殖力初步研究
王树森, 谢佳燕, 任程, 裴文韬, 余晓丽, 刘继前, 朱小旺
(武汉轻工大学生物与制药工程学院,武汉430023)
短尾高原鳅繁殖力初步研究
王树森, 谢佳燕*, 任程, 裴文韬, 余晓丽, 刘继前, 朱小旺
(武汉轻工大学生物与制药工程学院,武汉430023)
对短尾高原鳅Triplophysabrevicauda的繁殖力进行了研究。结果表明,短尾高原鳅雌性个体的成熟系数显著高于雄性。雌性繁殖群体的个体绝对繁殖力为1 028~5 508粒,平均为2 804粒±1 282粒。体长相对繁殖力为42粒/mm±16粒/mm,体质量相对繁殖力为1 006粒/g±292粒/g。短尾高原鳅的绝对繁殖力分别与体长、体质量及性腺质量呈极显著线性正相关;体长相对繁殖力分别与体质量及性腺质量呈极显著线性正相关;体质量相对繁殖力与这些生物学参数均不相关。在雌性短尾高原鳅性腺中,卵径的分布呈“单峰型”,推测短尾高原鳅属不分批产卵类型。
短尾高原鳅;繁殖力;生物学特性
近年来,人类活动的加剧、梯级水库的构建和大量外来鱼类的入侵导致高原河流水体中鱼类组成和资源状况发生了巨大的改变(唐文家,何德奎,2015)。由于水温低,栖息于高原地区的鱼类鱼体生长缓慢、性成熟晚和繁殖力低,其种群一旦受到破坏,将很难恢复(陈毅峰,曹文宣,2000)。短尾高原鳅Triplophysabrevicauda隶属于鲤形目Cyprinidformes鳅科Cobitidae条鳅亚科Nemacheilinae高原鳅属Triplophysa,集中分布于西亚、青藏高原及其邻近地区(朱松泉,1989)。高原鳅属鱼类是青藏高原地区鱼类中种类和数量仅次于裂腹鱼,并对高原环境适应性极强的类群(武云飞,吴翠珍,1991;陈宜瑜等,1996),是鱼类中唯一分布到海拔5 000 m以上的属(何长才,1996)。高原鳅属鱼类种内特征分化明显,分布海拔高,构成高原鱼类群体中极为重要的类群(朱松泉,1989;武云飞,吴翠珍,1991;何德奎等,2006)。因此,对高原鱼类的深入研究,不仅对鱼类的系统进化和生物地理学等具有重要的科学意义,对发展当地特色养殖业也具有重要的实用价值。何德奎等(2006)对高原鳅属鱼类的系统分类和地理分布已进行了相应的研究。有关高原鳅属鱼类生物学方面的研究仅涉及少数物种(郭焱等,2002;宋昭彬等,2005;吐尔逊等,2005;戚文华等,2008;王华等,2008;陈生熬等,2013),而有关短尾高原鳅生物学方面的研究较少。因此,本研究对短尾高原鳅的繁殖特性进行了研究,旨在为进一步深入探讨高原环境条件下高原鳅属鱼类的繁殖规律及其生理生态适应性等问题积累基础资料。
1 材料与方法
1.1 样本采集与处理
2014年1—5月于雅鲁藏布江中游曲水段采集短尾高原鳅样本共计121尾,其中雌性个体62尾,雄性个体44尾,性别不确定个体15尾。测量全长(TL)、体长(SL)、体质量(W),并解剖、鉴定性别,称量性腺质量(GW),长度精确至0.01 mm,质量精确至0.01 g,样本用8%甲醛溶液浸泡保存。
1.2 实验方法
鱼样个体绝对繁殖力采用质量计数法进行测量,Leica显微镜下计数并测量卵径(殷名称,1995)。绝对繁殖力(absolue fecundity,F)为Ⅲ期以上卵巢所怀卵粒的总数;根据绝对繁殖力与体长或体质量的比值来确定体长相对繁殖力(FL=F/SL)及体质量相对繁殖力(FW=F/W);卵径为测量发育期为Ⅲ期和Ⅳ期卵巢中随机200粒卵的数据。同时计算成熟系数(gonadosomatic index, GSI)=(GW/W)×100%。
1.3 数据处理与分析
数据处理采用Excel,不同平均值间进行独立性t检验(independentt-test),并以相关分析、回归分析统计繁殖力与体长、体质量、性腺质量和GSI之间的关系,采用线性函数进行拟合分析,分析均采用SPSS 14.0。
2 结果
2.1 群体组成
短尾高原鳅样本的体长为42.13~94.21 mm,平均为58.80 mm±12.79 mm;体质量为0.49~6.05 g,平均为2.10 g±1.22 g。雌鱼优势体长组为42.13~60.00 mm,占雌鱼总数的66.13%,优势体质量组为1.00~2.00 g,占雌鱼总数的57.14%;卵巢质量为0.002 6~1.02 g,平均为0.24 g±0.30 g。雄鱼优势体长组为42.17~80.00 mm,占雄鱼总数的84.09%,优势体质量组为1.00~4.00 g,占雄鱼总数的70.45%;精巢质量为0.002 1~0.057 g,平均为0.02 g±0.01 g。
2.2 成熟系数
对短尾高原鳅样本的GSI进行统计分析(表1)。结果表明,短尾高原鳅样本的GSI平均值为5.84±8.66,其中,雌性样本的GSI平均值为9.53±9.73,雄性样本的为0.57±0.28,雌性样本的GSI平均值显著高于雄性(P<0.05)。对不同体长组雌雄两性个体的GSI进行分析表明,短尾高原鳅雌雄两性个体的GSI随体长的增长表现为递增的趋势,但无统计学意义(P>0.05)。
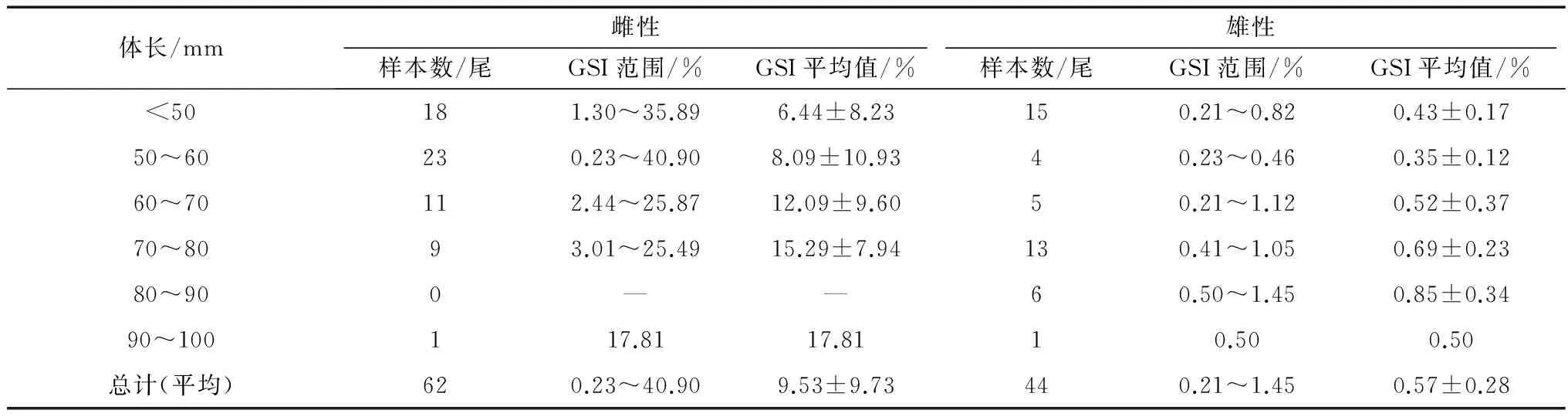
表1 短尾高原鳅不同体长组的成熟系数
2.3 繁殖力
对短尾高原鳅繁殖样本群体的繁殖力进行了统计分析。结果表明,短尾高原鳅繁殖群体的个体绝对繁殖力为1 028~5 508粒,平均为2 804粒±1 282粒。体长相对繁殖力为(21~75)粒/mm,平均为42粒/mm±16粒/mm;体质量相对繁殖力为(485~1 495)粒/g,平均为1 006粒/g±292粒/g。将绝对繁殖力、相对繁殖力与体长、体质量、性腺质量和GSI 4个参数进行相关分析并进行线性函数拟合,结果发现,短尾高原鳅的绝对繁殖力与体长、体质量及性腺质量均呈极显著正相关(其线性函数方程分别为F=-1 667.57+69.41SL,R2=0.36;F=503.12+811.63W,R2=0.52;F=699.14+3 438.90GW,R2=0.51;所有的P<0.01);体长相对繁殖力与体质量及性腺质量均呈极显著正相关(线性函数方程分别为FL=19.97+7.93W,R2=0.31;FL=19.54+37.45GW,R2=0.37;所有的P<0.01);而体质量相对繁殖力与这4个参数均不相关(P>0.05)。
2.4 卵径
对短尾高原鳅成熟雌性个体的卵径大小进行测量(图1)。结果表明,短尾高原鳅雌性个体的卵径为0.16~1.32 mm,平均为0.72 mm±0.13 mm,卵径多集中分布在0.60~0.80 mm,占卵总数的44%,其分布呈现单峰型。
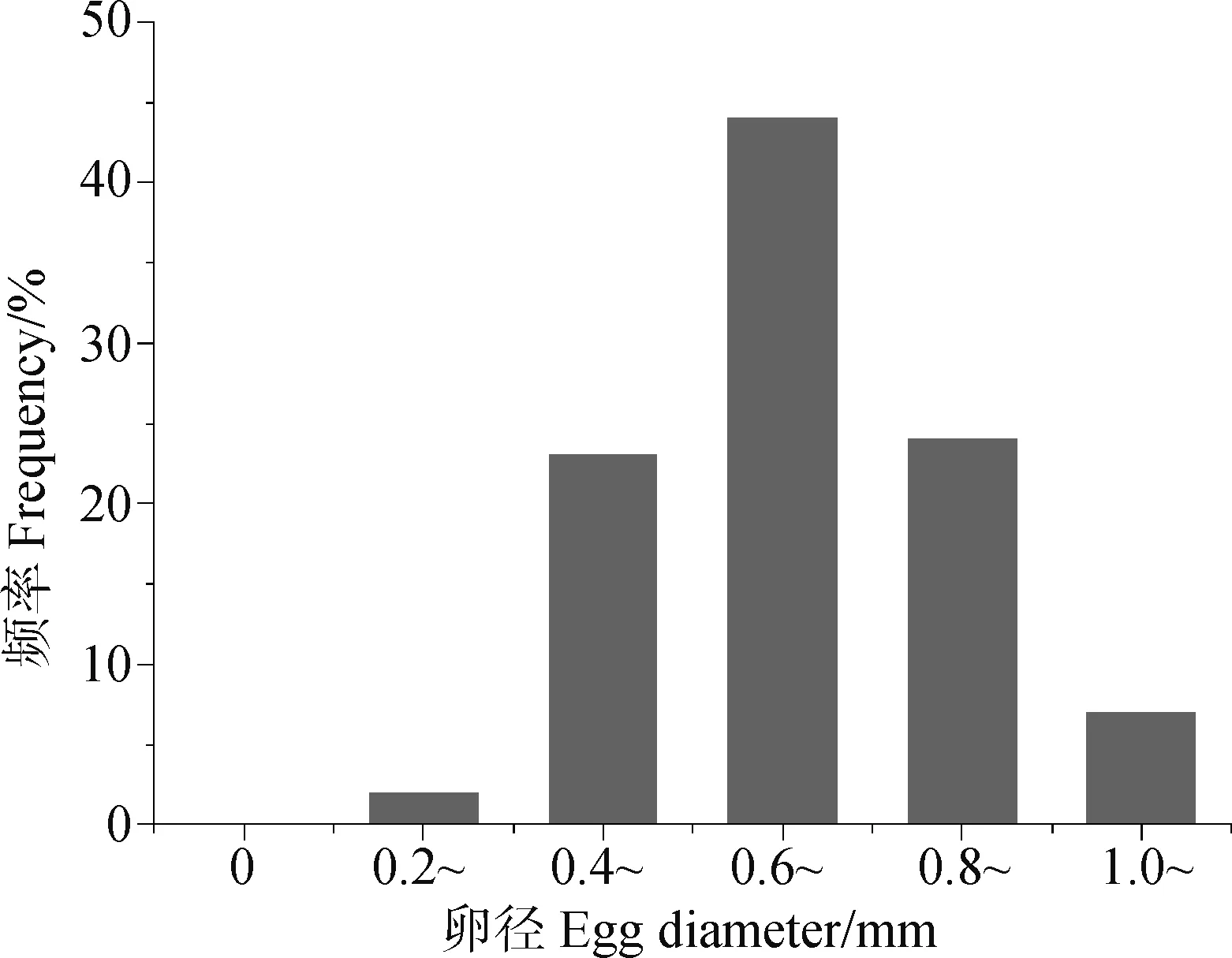
图1 短尾高原鳅的卵径分布
3 讨论
鱼类的繁殖特征是内源性遗传因素和外源性环境因素共同作用的结果,是其对周围环境的一种响应(殷名称,1995)。青藏高原是世界上海拔最高的区域,发育有为数众多的内外流水体和湖泊,构成极为复杂的水系格局,特殊的地质条件和高寒气候对生活在此的鱼类产生显著的影响(陈宜瑜等,1996)。高原鳅属鱼类是高原鱼类群体中极为重要的类群(朱松泉,1989)。本研究发现,短尾高原鳅的性腺特征与其他高原鳅类似(郭焱等,2002;吐尔逊等,2005;王华等,2008;曾霖,唐文乔,2010),其卵巢位于肠道背部,左右卵巢不分离,连接为一整体,这在其他鲤科鱼类中不常见。精巢分为左右两叶,前端彼此分离,后部汇合成输精管。GSI是衡量性腺发育程度和鱼体能量在性腺和躯体之间比例的重要指标(殷名称,1995),短尾高原鳅雌性个体的GSI显著高于雄性,表明雌性亲体的能量比雄性亲体以更高的比例转化为性腺,这与两性个体在生殖投入中存在差异密切相关(殷名称,1995;Lemosetal.,2011)。其他高原鳅属鱼类也发现雌性个体的GSI显著高于雄性(郭焱等,2002;刘鸿艳等,2009)。
繁殖是鱼类生活史中一个重要的阶段,是鱼类保证种群生存和繁衍的基础,它保证物种及其后代对所生存的环境具有最大的适应(殷名称,1995)。高原鳅属鱼类的绝对繁殖力存在种间差异,与高原鳅属已发表的几种鳅类相比(郭焱等,2002;吐尔逊等,2005;刘鸿艳等,2009;曾霖,唐文乔,2010;王志坚等,2013),本研究中短尾高原鳅的绝对繁殖力处于中等水平。研究也发现短尾高原鳅的绝对繁殖力与体长、体质量及性腺质量均呈极显著正相关,表明鱼类繁殖力受到体质量等多个因素的共同影响(Thorpeetal.,1984;Morita & Takashima,1998;Fleming & Gross,1990)。此外,与短尾高原鳅个体繁殖力相关性最大的参数是卵巢质量和体质量,表明繁殖力的种内变动虽受多个环境因子的影响,但性腺发育仍是主要的作用因子(刘鸿艳等,2009)。短尾高原鳅卵径的频率分布呈单峰形,推测为不分批产卵类型,这与叶尔羌高原鳅T.yarkandensis的产卵类型一致(曾霖,唐文乔,2010)。
陈生熬, 马春晖, 丁慧萍, 等. 2013. 塔里木河叶尔羌高原鳅繁殖生物学研究[J]. 水生生物学报, 37(5): 810-816.
陈宜瑜, 陈毅峰, 刘焕章. 1996. 青藏高原动物地理区的地位和东部界线问题[J]. 水生生物学报, 20(2): 97-103.
陈毅峰, 曹文宣. 2000. 裂腹鱼亚科[M]// 乐佩琦. 中国动物志 硬骨鱼纲 鲤形目 下卷. 北京: 科学出版社.
郭焱, 蔡林钢, 吐尔逊, 等. 2002. 赛里木湖新疆高原鳅生物学研究[J]. 水产学杂志, 15(2): 6-11.
何德奎, 陈咏霞, 陈毅峰. 2006. 高原鳅属Triplophysa鱼类的分子系统发育和生物地理学研究[J]. 自然科学进展, 16(11): 1395-1404.
何长才. 1996. 两种海拔最高的鱼类及其分布[J]. 四川动物, 15(3): 116-117.
刘鸿艳, 谢从新, 郑跃平, 等. 2009. 西藏高原鳅个体繁殖力的研究[J]. 淡水渔业, 39(4): 12-16.
戚文华, 郭延蜀, 王华, 等. 2008. 四川辖曼自然保护区硬刺高原鳅生物学研究[J]. 四川动物, 27(6): 1157-1162.
宋昭彬, 杨晔, 岳碧松. 2005. 西溪高原鳅生物学研究[J]. 水利渔业, 25(1): 27-29.
唐文家, 何德奎. 2015. 青海省外来鱼类调查(2001-2014年)[J]. 湖泊科学, 27(3): 502-510.
吐尔逊, 任波, 张人铭, 等. 2005. 阿克苏河长身高原鳅Triplophysa(Triplophysa)teunis(Day)生物学研究[J]. 水产学杂志, 18(2): 65-69.
王华, 郭延蜀, 戚文华, 等. 2008. 白龙江上游黑体高原鳅生物学研究[J]. 水产学杂志, 21(1): 42-48.
王志坚, 黄静, 张耀光, 等. 2013. 大宁河贝氏高原鳅的繁殖特性[J]. 淡水渔业, 43(5): 8-13.
武云飞, 吴翠珍. 1991. 青藏高原鱼类[M]. 成都: 四川科学技术出版社.
殷名称. 1995. 鱼类生态学[M]. 北京: 中国农业出版社.
曾霖, 唐文乔. 2010. 叶尔羌高原鳅的年龄、生长与繁殖特征[J]. 动物学杂志, 45(5): 29-38.
朱松泉. 1989. 中国条鳅志[M]. 南京: 江苏科学技术出版社: 68-133.
Fleming IA, Gross MR. 1990. Latitudinal clines: a trade-off between egg number and size in Pacific salmon[J]. Ecology, 71: 1-11.
Lemos VM, Varela Jr. AS, Velasco G,etal. 2011. The reproductive biology of the plata pompano,Trachinotusmarginatus(Teleostei: Carangidae) in southern Brazil[J]. Zoologia, 28(5): 603-609.
Morita K, Takashima Y. 1998. Effect of female size on fecundity and egg size in white-spotted char: comparison between searun and resident forms[J]. Journal of Fish Biology, 53: 1140-1142.
Thorpe JE, Miles MS, Keay DS. 1984. Developmental rate, fecundity and egg size in Atlantic salmon,SalmosalarL.[J]. Aquaculture, 43: 289-305.
陕西汉中发现小鸦鹃和乌鹃
2015年6月21日,在陕西省汉中市汉台区汉江桥闸北桥头(33°04′90.13″N,107°06′74.23″E,海拔500 m)发现并拍摄到小鸦鹃Centropusbengalensis,发现时仅1只个体,但在该地活动时间超过1周。2015年9月17日,在汉中市汉台区天爷庙巷(33°07′57.22″N,107°01′52.33″E,海拔500 m)发现并拍摄到1只乌鹃Surniculusdicruroides。两者均为鹃形目Cuculiformes鸟类,分属于杜鹃科Cuculidae鸦鹃属Centropus和乌鹃属Surniculus,后者为专性寄生杜鹃(约翰·马敬能等,2000;Erritzeetal.,2012;Yangetal.,2012)。此次记录是该2种杜鹃科鸟类首次在陕西省被发现,也扩展了这2种杜鹃科鸟类在国内的分布范围。
此次发现的乌鹃为亚成鸟,推测应为繁殖鸟。被发现时正在草地上觅食,全身体羽亮黑色,头、颈、背散布白色斑点,飞羽及其上覆羽羽尖白色,虹膜褐色,嘴淡黑色(图1:A)。本种共计7个亚种,在中国仅分布有华南亚种S.d.dicruroides,分布于西藏东南部、云南、四川北部、重庆、贵州、江苏、湖北、浙江、福建、广东、澳门、广西、海南,主要为夏候鸟,仅在滇南山区部分地区及海南岛为留鸟,国外分布于印度及中南半岛(赵正阶,2001;郑光美,2011;Erritzeetal.,2012)。
发现的小鸦鹃的头、颈、上背、胸及腹黑色,两翅栗色,尾长且呈淡黑色,嘴和脚均为黑色,似褐翅鸦鹃,但体型较小(图1:B)。本种共计6个亚种(Erritzøeetal.,2012),在中国仅有C.b.lignator亚种,为国家Ⅱ级重点保护野生鸟类(郑光美,王岐山,1998),分布于河北、河南南部、云南、贵州南部、湖北、湖南、安徽南部、江西、江苏、上海、浙江、福建、广东、香港、澳门、广西、海南、台湾,为留鸟(赵正阶,2001;郑光美,2011)。

图1 乌鹃Surniculus dicruroides亚成鸟(A)(赵纳勋 摄)和小鸦鹃Centropus bengalensis(B)(廖国庆 摄)
赵纳勋1,粟通萍2, 3,冯科1,梁伟2*
(1.陕西长青国家级自然保护区管理局, 陕西汉中723000;
2.热带动植物生态学省部共建教育部重点实验室, 海南师范大学生命科学学院, 海口571158;
3.北京林业大学自然保护区学院, 北京100083)
作者简介: 赵纳勋(1963—), 男, 高级工程师, 从事野生动物保护与管理工作, E-mail:zhnx_fp@163.com
*通信作者, E-mail:liangw@hainan.net
Research of Reproductive Characteristics inTriplophysabrevicauda
WANG Shusen, XIE Jiayan*, REN Cheng, PEI Wentao, YU Xiaoli, LIU Jiqian, ZHU Xiaowang
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Fecundity ofTriplophysabrevicaudafrom Qushui county in the Yarlung Zangbo River, China was estimated in this study.The gonadosomatic index of femaleT.brevicaudawas significantly higher than that of male.Absolute fecundity ofT.brevicaudawas ranged from 1 028 to 5 508 eggs, and the mean value was 2 804 eggs±1 282 eggs.The relative fecundity of body length and body weight were (42±16) eggs per mm and (1 006±292) eggs per gram, respectively.Significant positive relationship was observed between the absolute fecundity and three variables including body length, body weight, and gonad weight.A significant relationship between the relative fecundity of body length and body weight and gonad weight was found.However, no correlation between the relative fecundity of body weight and any of those parameters of fish size and weight was found.Distribution of egg diameter showed a single peak, which might indicateT.brevicaudadid not spawn by batches.
Triplophysabrevicauda; fecundity; biological characteristics
2015-10-28 接受日期:2016-03-24 基金项目:国家自然科学基金项目(31201729); 武汉轻工大学大学生创新创业训练项目(CXXL2014017)及大学生科研项目; 湖北省高校省级大学生创新创业训练计划项目(201410496017)
王树森(1993—), 男, 本科生
*通信作者Corresponding author,女, 博士, 副教授, 主要从事分子生态学的研究, E-mail:xjyaphid@163.com
10.11984/j.issn.1000-7083.20150339
Q959.4; S961.1
A
1000-7083(2016)03-0440-04
国家自然科学基金项目(31272328; 31472013)

