重金属胁迫下稀有鲫抑制消减杂交文库的筛选与分析
王春伶,张富铁,曹文宣,王剑伟
(1.中国科学院水生生物研究所,武汉430072;2.中国科学院水生生物多样性与保护重点实验室,武汉430072;3.中国科学院大学,北京100049)
王春伶1, 2, 3,张富铁1, 2*,曹文宣1, 2,王剑伟1, 2
(1.中国科学院水生生物研究所,武汉430072;2.中国科学院水生生物多样性与保护重点实验室,武汉430072;3.中国科学院大学,北京100049)
重金属包括镉和铅等污染严重威胁人类健康。为从基因水平研究鱼类应答重金属胁迫的分子机理,本研究利用抑制消减杂交技术构建稀有鲫Gobiocyprisrarus对镉处理反应的正、反向抑制消减文库。文库质量检测表明消减效率达210倍,通过对正、反向文库中部分表达序列标签进行序列测定,获得9条表达丰度较高的表达序列标签,平均长度为438 bp。利用快速扩增cDNA末端技术克隆获得核糖体蛋白s18(Rps18)基因的完整编码区,序列长度为525 bp,其中编码区459 bp,编码152个氨基酸,3’非翻译区38 bp,5’非翻译区28 bp。并利用实时荧光定量技术对Rps18基因在铅胁迫下的表达谱进行了研究,结果表明稀有鲫肝组织中Rps18基因的表达量变化较明显。
稀有鲫;重金属;抑制消减杂交;核糖体蛋白s18
镉(Cd)和铅(Pb)等重金属污染对生物的生理活动、生长发育及基因表达产生重要影响(Zhuetal.,2011)。水体重金属污染不仅影响生活在其中的水生生物,还威胁人类健康,这种情况已经受到我国政府的高度重视。本研究将稀有鲫Gobiocyprisrarus作为实验对象,希望阐述其应答重金属胁迫的分子机理,寻找适合监测水体重金属污染的分子标记物。
抑制消减杂交(suppression subtractive hybridization,SSH)是Diatchenko等(1996)在mRNA差别显示基础上建立的一种新的消减杂交方法,它具有灵敏度高、操作简单、假阳性低、速度快及效率高等特点,是目前克隆差异表达基因的重要手段之一,可以克隆出极为重要的基因。James等(2010)对印度明对虾Fenneropenaeusindicus感染白斑综合症病毒后的肝胰腺组织进行研究,发现抗菌肽相关的克隆在所建消减库中最为丰富,另外还包括信号转换、能量传导以及抗氧化酶类方面的克隆,这为甲壳类动物先天免疫及差异表达基因作用的研究奠定了基础。
核糖体是合成蛋白质的细胞器,主要成分是核糖体RNA(rRNA)和核糖体蛋白(ribosomal protein,RP),它们在蛋白质合成中发挥重要作用,也参与复制、转录、RNA加工、DNA修复等过程(Wool,1996)。有文献报道,RP基因家族在肿瘤发生和发展过程中发挥重要作用,RP的异常表达将引发各种疾病,包括肿瘤发生、免疫疾病、代谢病等(陈宏等,2005;李英华等,2012)。目前有研究表明,部分核糖体大亚基和小亚基蛋白能参与调控p53信号传递反应。p53是重要的肿瘤抑制因子,具有DNA损伤修复、促进细胞凋亡、分化及增殖抑制等功能,并通过调控细胞周期行进和促进细胞凋亡,发挥肿瘤抑制功能(李小光等,2013),其过表达或激活可引发细胞死亡,低表达或失活会导致肿瘤发生(Mirzayansetal.,2012)。在斑马鱼Daniorerio中,核糖体S7、S8、S15a、S18、S29、L7、L13、L23a、L35、L36等基因发生突变会导致斑马鱼癌症的产生(Amsterdametal.,2004),这可能与RP执行的相关功能有关。
1 材料方法
1.1 试验鱼饲养
1.2 RNA提取
将1.1中的组织放入研磨器中加RNA Lysis Buffer进行充分研磨,取175 μL裂解液移至1.5 mL EP管中,加入350 μL RNA Dilution Buffer,按SV Total RNA Isolation System(Promega,USA)试剂盒说明书进行操作,用紫外分光光度仪和0.8%琼脂糖凝胶电泳对RNA进行定量定性分析。
1.3 mRNA分离纯化
用约300 μg合并后的总RNA分离纯化mRNA,按照PolyATtractRmRNA Isolation Systems说明书进行mRNA分离。
1.4 抑制消减杂交
具体操作按Clontech PCR-SelectTMcDNA Subtraction Kit说明书进行。以重金属处理组为试验方(tester),以对照组为驱动方(driver)进行正向消减杂交;以对照组为试验方,重金属处理组为驱动方进行反向消减杂交。
1.5 cDNA消减文库的构建
分别从正向和反向消减杂交的2次PCR产物中各取2 μL与1 μL PGEM-T Vector连接,4 ℃过夜。从体系中取5 μL转化受体菌(大肠杆菌EscherichiacoliDH5α),于氨苄抗性筛选的琼脂糖平板上挑取单克隆于LB培养基中培养过夜,按常规保存菌种。
1.6 PCR鉴定插入片段
取1 μL细菌培养液作PCR模板,以插入片段两侧的载体序列M13F和M13R作引物,PCR扩增插入片段。PCR体系(20 μL):10×PCR Buffer 2 μL,M13F和M13R(10 mmol·L-1)各0.6 μL,dNTP Mix(2.5 mmol·L-1)0.5 μL,Mg2+2 μL,Taq酶0.3 μL,菌液1 μL,灭菌水13 μL。PCR反应条件:94 ℃预变性5 min;94 ℃30 s,49 ℃40 s,72 ℃1 min, 35个循环;最后72 ℃延伸8 min。
1.7 快速扩增cDNA末端(RACE)技术获得Rps18基因序列
RACE操作过程按照Clontech SMARTTMRACE cDNA Amplification Kit具体说明进行。基因特异引物(GSPs)分别为:GSP1:5’-AGTAGTCTTTGCGCGGAACCAGC-3’;GSP2: 5’-GTCACCACCCTCTCAACCTCATCCT-3’。5’-RACE过程:第一链由总RNA、5’-CDS primer A和SMARTⅡA oligo经过GSP1和10×universal primer A mix PCR反应获得;3’-RACE过程:第一链由总RNA和3’-CDS primer A经过GSP2和10×universal primer A mix PCR反应获得,PCR反应条件:94 ℃30 s,56 ℃30 s,72 ℃3 min。反应产物克隆至载体PGEM-T中进行测序。所得序列经BLAST分析比对,并用Clustal X和MEGA 4.0分别对不同物种Rps18基因的核苷酸序列和氨基酸序列进行分析。
1.8 qPCR技术分析Rps18基因表达情况
用SuperReal PreMix(SYBR Green)(TIANGEN)对Pb处理后肝组织和肌肉组织不同时间点的Rps18基因表达情况进行分析。qPCR在CFX96TMReal-Time System(Bio-Rad)上进行,β-actin作为内参基因(Liuetal.,2008;Suetal.,2008)。qPCR体系(20 μL):2×SuperReal PreMix 10 μL,引物各0.5 μL,模板1 μL。目的基因和内参基因的引物见表1。PCR反应条件:95 ℃15 min;95 ℃15 s,60 ℃15 s,72 ℃25 s,39个循环;熔解曲线:65 ℃5 s至95 ℃。内参基因和管家基因引物的扩增效率分别为96.8%和97.5%。用2-△△Ct计算目的基因的相对表达量变化,其中Ct为达到阈值时扩增的循环数,具体公式为:相对表达量变化=2-△△Ct,△△Ct=[Ct(目的)-Ct(内参)]处理组-[Ct(目的)-Ct(内参)]对照组(Livak & Schmittgen,2001)。

表1 实时荧光定量PCR引物
1.9 数据分析
用SPSS进行数据分析,采用单因素方差分析统计方法(One-Way ANOVA)和Duncan’s多重比较方法对数据进行分析,当P<0.05时差异有统计学意义。
译文2:そういえば子供のころ、筋向かいの豆腐屋に、楊おばさんという人が一日じゅう座っていて、「豆腐屋小町」と呼ばれていたっけ。(竹内好译)
2 结果
2.1 消减文库筛选结果
2.2 Rps18基因的序列分析
从SSH文库筛选出245 bp Rps18基因的表达序列标签。经3’-RACE和5’-RACE扩增得到2段长度分别为418 bp和306 bp的片段,利用DNAMAN及BLAST进行序列分析、比对及拼接,最后得到Rps18基因序列长度为525 bp(GenBank 登录号为KF836434)。克隆得到的稀有鲫Rps18基因包括3’非翻译区38 bp,5’非翻译区28 bp,编码区459 bp,编码152个氨基酸残基,起始密码子为ATG,终止密码子为TAA(图4)。该序列中A、T、G、C的含量分别为28.4%、20.6%、22.6%和28.4%。

图1 PCR检测β-actin cDNA的消减效率电泳图
M.100 bp DNA marker; 1~4.未消减cDNA在20, 25, 30和35个循环的产物 PCR products of unsubtracted cDNA in 20, 25, 30 and 35 cycles, respectively; 5~8.消减后cDNA在20, 25, 30和35个循环的产物 PCR products of subtracted cDNA in 20, 25, 30 and 35 cycles, respectively.

图2 消减cDNA文库外源插入片段的检测
M.100 bp DNA marker; 1~12.cDNA片段 cDNA fragments.

图3 稀有鲫经Cd暴露后肝组织不同时间点
M.100 bp DNA marker; 1.暴露24 h时空白组的mRNA丰度 24 h in the blank; 2.暴露24 h时实验组的mRNA丰度 24 h-post exposure to Cd; 3.暴露48 h时空白组的mRNA丰度 48 h in the blank; 4.暴露48 h时实验组的mRNA丰度 48 h-post exposure to Cd.
使用MEGA 4.0软件的邻接法(Neighbor-joining, NJ)构建系统进化树,并用 bootstraps 进行了500次重复(图6)。绘制进化树所用物种包括:人Homosapiens、家犬Canisfamiliaris、牛Bostaurus、野猪Susscrofa、黑鼠Rattusrattus、褐家鼠R.norvegicus、热带爪蟾X.(Silurana)tropicalis、非洲爪蛙、长牡蛎、痢疾变形虫Entamoebahistolytica、果蝇Drosophilamelanogaster和斑马鱼,结果表明稀有鲫Rps18基因和斑马鱼Rps18基因聚在一起,亲缘关系最近。

图4 稀有鲫Rps18基因核苷酸和氨基酸序列
2.3 Rps18基因qPCR分析
3 讨论
SSH技术通过去除试验方和驱动方中相同基因,并富集差异表达基因来筛选目的基因,这种方法可以消除cDNA群体内部各分子间丰度的差异,从而分离与低丰度转录对应的cDNA克隆(Diatchenko Hs.人Homosapiens, Cf.家犬Canisfamiliaris, Bt.牛Bostaurus, Ssc.野猪Susscrofa, Rr.黑鼠Rattusrattus, Rn.褐家鼠R.norvegicus, Xt.热带爪蟾Xenopus(Silurana)tropicalis, Xl.非洲爪蟾X.laovis, Cg.长牡蛎Crassostreagigas, Eh.痢疾变形虫Entamoebahistolytica, Dm.果蝇Drosophilamelanogaster.Dr.斑马鱼Daniorerio.etal., 1996)。因此,对于筛选稀有鲫经重金属暴露后差异表达的基因有很大帮助。本研究从消减文库中获得多个差异表达的cDNA片段,序列分析表明,这些片段均与防御反应有关。主要包括Apolipoprotein C-I、金属硫蛋白、Nuclear factor (erythroid-derived 2)-like 2a、Na+/K+ATPase、heat shock protein 27、phosphoenolpyruvate carboxykinase及ribosom-al protein S18基因等。这说明稀有鲫为应对重金属暴露的刺激,自身产生防御反应,引起一些基因的表达量变化。

图5 稀有鲫的Rps18基因和其他物种Rps18基因的氨基酸序列比对
Fig.5 Comparison ofGobiocyprisrarusRps18 amino acid sequence with other species

图6 构建的核糖体蛋白基因家族进化树

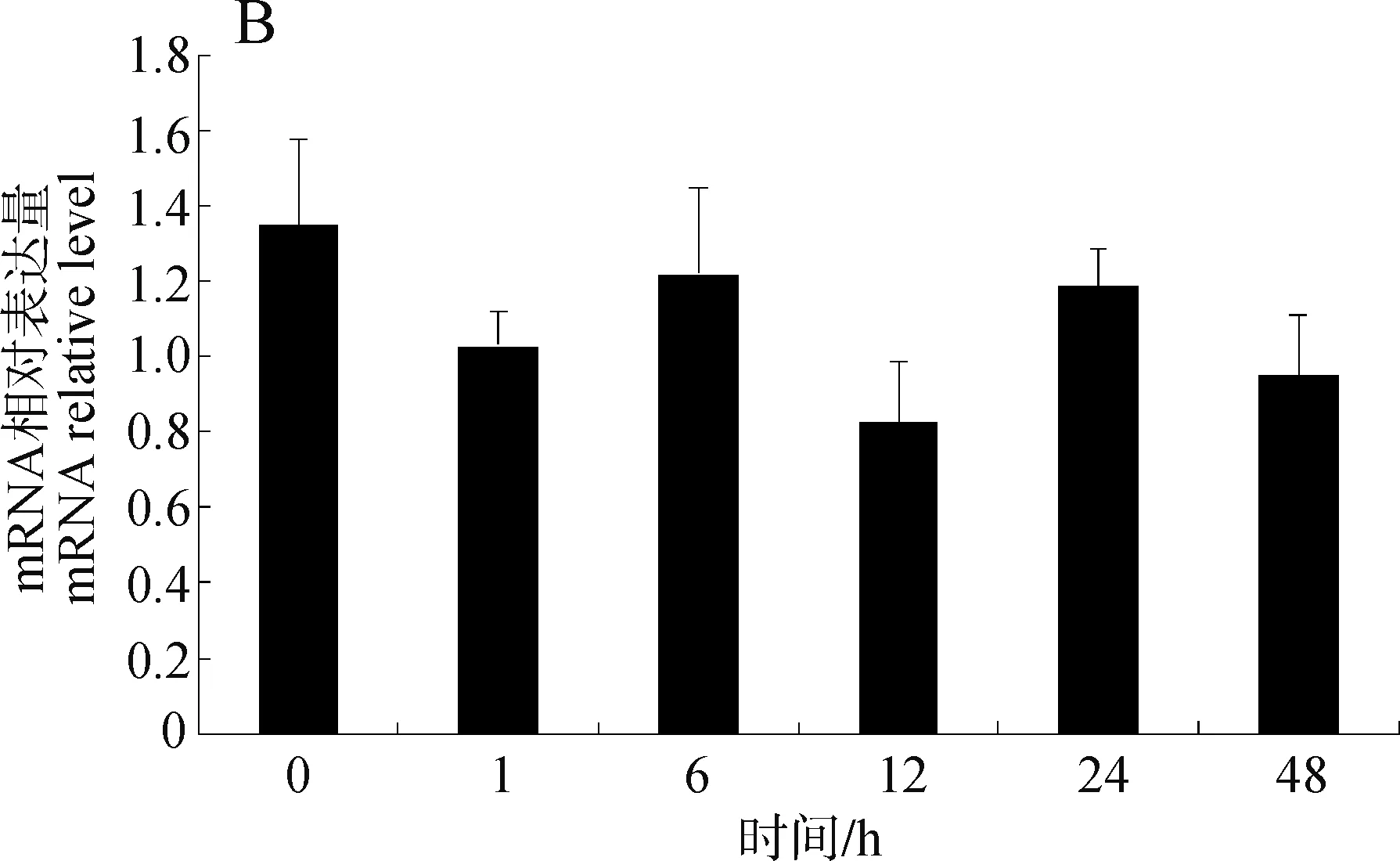
图7 稀有鲫铅(3.9 mg·L-1)暴露后肝脏组织(A)和肌肉组织(B)中不同时间点Rps18基因的相对表达量
陈宏, 姜浩, 谢兆霞. 2005. 核糖体蛋白在肿瘤中的改变及作用[J]. 国际病理科学与临床杂志, 25(5): 393-396.
李小光, 宋伦, 袁胜涛. 2013. 核糖体蛋白参与调控p53诱导活化的分子机制[J]. 生物技术通讯, 24(3): 423-426.
李英华, 胡振林, 张俊平. 2012. 核糖体蛋白S3a在肿瘤细胞增殖分化和凋亡调控作用的研究概况[J]. 药学实践杂志, 30(3):165-167.
Amsterdam A, Sadler KC, Lai K,etal. 2004. Many ribosomal protein genes are cancer genes in zebrafish[J]. PLoS Biology, 2: 690-698.
Cao L, Huang W, Shan X,etal. 2012. Tissue-specific accumulation of cadmium and its effects on antioxidative responses in Japanese flounder juveniles[J]. Environmental Toxicology and Pharmacology, 33: 16-25.
Diatchenko L, Lau C, Campbell AP,etal. 1996. Suppression subtractive hybridization: a method for generating differentially regulated or tissue-specific cDNA probes and libraries[J]. Proceedings of the National Academy of Sciences of the United States of America, 93: 6025-6030.
James R, Thampuran N, Lalitha KV,etal. 2010. Differential gene expression profile of the hepatopancreas of white spot syndrome virus infectedFenneropenaeusindicusby suppression subtractive hybridization[J]. Fish & Shellfish Immunology, 29: 884-889.
Lai K, Amsterdam A, Farrington S,etal. 2009. Many ribosomal protein mutations are associated with growth impairment and tumor predisposition in zebrafish[J]. Developmental Dynamics, 238(1): 76-85.
Liu Y, Wang JS, Wei YH,etal. 2008. Molecular characterization of cytochrome P450 1A and 3A and the effects of perfluorooctanoic acid on their mRNA levels in rare minnow (Gobiocyprisrarus) gills[J]. Aquatic Toxicology, 88: 183-190.
Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(T) (-Delta Delta C)method[J]. Methods, 25: 402-408.
Mirzayans R, Andrais B, Scott A,etal. 2012. New insights into p53 signaling and cancer cell response to DNA damage: implications for cancer therapy[J]. Journal of Biomedicine and Biotechnology, doi:10.1155/2012/170325.
Su JG, Zhu ZY, Wang YP. 2008. Molecular cloning, characterization and expression analysis of the PKZ gene in rare minnow (Gobiocyprisrarus)[J]. Fish & Shellfish Immunology, 25: 106-113.
Rajasekhar VK, Viale A, Socci ND,etal. 2003. Oncogenic Ras and Akt signaling contribute to glioblastoma formation by differential recruitment of existing mRNAs to polysomes[J]. Molecular Cell, 12: 889-901.
Wool IG. 1996. Extraribosomal functions of ribosomal proteins[J]. Trends In Biochemical Sciences, 21(2): 164-165.
Zhu B, Wu ZF, Li J,etal. 2011. Single and joint action toxicity of heavy metals on early developmental stages of Chinese rare minnow (Gobiocyprisrarus)[J]. Ecotoxicology and Environmental Safety, 74: 2193-2202.
Construction and Analysis of the Subtractive cDNA Library ofGobiocyprisrarusTreated by Cd and Pb
WANG Chunling1, 2, 3, ZHANG Futie1, 2*, CAO Wenxuan1, 2, WANG Jianwei1, 2
(1.Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China;2.The Key Laboratory of Aquatic Biodiversity and Conservation, Chinese Academy of Sciences, Wuhan 430072, China;3.University of Chinese Academy of Sciences, Beijing 100049, China)
Heavy metals, such as cadmium (Cd), lead (Pb), can pose serious toxin to human and aquatic organisms.Suppression subtractive cDNA library ofGobiocyprisrarustreated by Cd was constructed to investigate the underlying mechanism.The efficiency of subtractive cDNA was reach up to 210folds.A total of 9 expressed sequence tags with average sequence length of 438 bp and enriched in the cDNA library were obtained.The complete coding sequence of ribosomal protein s18 (Rps18) fromG.raruswas amplified by rapid amplification of cDNA ends technology, and it is found that this gene comprised of 5’-UTR (28 bp), ORF region (459 bp) that encoded 152 amino acids (aa) and 3’-UTR (38 bp).Then the expression of Rps18 inG.rarusafter exposure to Pb was determined by real-time PCR, and the results showed that the expression difference of Rps18 was more obvious in liver than in muscle after Pb treatment.
Gobiocyprisrarus; heavy metal; suppression subtractive hybridization; ribosomal protein s18
2015-12-17 接受日期:2016-03-24 基金项目:国家自然科学基金项目(30900154); 中国科学院水生生物研究所青年人才创新项目(Y15E011101); 中国长江三峡集团公司项目(0799522)
王春伶(1984—), 女, 博士, 实验师, 主要从事鱼类遗传学方面的研究, E-mail:chwang@ihb.ac.cn
*通信作者Corresponding author,男, 博士, 副研究员, 主要研究方向为鱼类保护遗传学、分子生态学及分子生物学, E-mail:futiezhang@ihb.ac.cn
10.11984/j.issn.1000-7083.20150403
Q9594; Q78
A
1000-7083(2016)03-0372-06

