探讨细菌16S rRNA基因检测对新生儿败血症早期诊断的意义
贾永锋 朱金梅
探讨细菌16S rRNA基因检测对新生儿败血症早期诊断的意义
贾永锋①朱金梅②
目的:探讨细菌16S核糖体核糖核酸(16S rRNA)基因检测对新生儿败血症早期诊断的意义。方法:对126例疑似新生儿败血症患儿的血标本进行16S rRNA基因聚合酶链反应(PCR)检测,并同时做血培养,比较分析两种方法检测细菌病原体的快速性、敏感性和特异性。结果:126例疑似新生儿败血症患儿的血标本经血培养检测阳性率为13.8%(17/126);经PCR检测阳性率为22.2%(28/126),PCR检测阳性率明显高于血培养检测阳性率,差异显著(x2=10.234,P=0.004)。以血培养为“金标准”,PCR检测灵敏度为88.2%(15/17)、特异度为88.1%(96/109)。从操作时间分析,血培养和PCR检测的平均时间分别为(28.9±4.3)h和(7.5±1.2)h,PCR检测速度明显快于血培养。结论:细菌16S rRNA基因PCR检测方法速度快、敏感性高且特异性强,不受抗生素的干扰,可为新生儿败血症的早期诊断提供可靠依据。
16S rRNA基因;新生儿败血症;早期诊断;聚合酶链反应
[First-author’s address] Neonatology Department, Shangluo Central Hospital, Shangluo 721000, China.
新生儿败血症(septicemia of newborn)是新生儿常见疾病之一,指新生儿期致病菌经各种途径侵入其血循环系统,并在其中生长繁殖、产生毒素,最终造成全身性的炎症反应[1]。该病的病因较复杂,常见致病菌有大肠杆菌、金黄色葡萄球菌、表皮葡萄菌、克雷白杆菌及B组链球菌等,主要通过宫内感染、产时感染及产后感染[2]。新生儿时期该病的发生率和病死率均较高,但因缺乏典型的临床表现和体征,往往病情进展迅速,严重威胁新生儿的生命,故早期诊断明确病原菌与及时应用有效抗菌药物亦非常重要。
目前,临床上的血培养检测细菌常用方法由于检测时间长,且阳性率较低,难以达到早期诊断的目的[3]。聚合酶链反应(polymerase chain reaction,PCR)技术已被广泛用于检测细菌等微生物,并成为细菌16S核糖体核糖核酸(16S rRNA)基因检测的重要方法[4-7]。为此,本研究对126例疑似新生儿败血症患儿的血标本进行细菌16S rRNA基因PCR检测,旨在探讨新生儿败血症快速、可靠的早期诊断方法,为临床提供诊断依据。
1 资料与方法
1.1一般资料
参照中华医学会儿科分会新生儿学组制定的《新生儿败血症诊疗方案》[8]诊断标准,选取2014年1月至2015年1月商洛市中心医院新生儿科拟诊断的126例新生儿败血症患儿,其中男患儿79例、女患儿47例;年龄2 h至30 d。分别对所有患儿的血标本进行细菌培养及细菌16S rRNA基因检测,抽取每例患儿2 ml静脉血做血培养,同时抽取1 ml静脉血做细菌16S rRNA基因检测。同期抽取25名正常新生儿相同血标本做质量控制,对照菌株为:大肠埃希菌(ATCC25923)、金黄色葡萄球菌(ATCC25922)由细菌室提供,分别选择所有细菌、革兰氏阴性细菌及革兰氏阳性细菌的16S设计合成三对共同引物,由上海细胞生物学研究所癌基因室合成。本研究使用BacT/ALERT 120全自动血培养系统进行细菌培养。
1.2纳入与排除标准
(1)纳入标准:①符合诊断标准中拟诊断的新生儿败血症患儿;②未感染其他血液性疾病的患儿。
(2)排除标准:①检测前已确诊的新生儿败血症患儿;②抽取或检测过程中受污染的血标本。
1.3仪器设备
采用FTC-2000A型荧光定量PCR仪(西安赛维斯生物科技有限公司);DYY-8C稳流稳压电泳仪(成都明萱电子科技有限公司):2~600 V、1~200 mA,稳流、稳压且连续可调,数显,双输出,可同时带2个电泳槽,用于常压电泳;JD-801专业数码凝胶成像与分析系统(南京瞰森仪器有限公司);BacT/ALERT 120全自动血培养系统(上海祥和科学技术有限公司)。
1.4操作方法
1.4.1血标本DNA提取
(1)抗凝全血加PBS液,离心、弃上清。使用TE缓冲液[Tris盐酸缓冲液中加入乙二胺四乙酸四钠(EDTA)制成]、蛋白酶K溶液及10%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液悬浮沉淀,于56 ℃水浴5 h。冷却至4℃时,加入等体积的Tris-HCl(pH值8.0)酚,颠倒混匀,以10000 r/min的速度离心15 min,吸取上层水相。
(2)加入等体积氯仿和(或)异戊醇,颠倒混匀,4℃10000 r/min离心10 min。取上层水相加入10%体积的3 mol/L的乙酸钠(pH值5.2),混匀后,加入2.5倍体积的100%的乙醇,颠倒混匀,-20 ℃孵育过夜,4℃ 10000 r/min离心20 min,弃上清。
(3)去尽乙醇,加入70%的乙醇1 ml,混匀,4 ℃5000 r/min离心10 min,弃上清,室温干燥10 min,至白色沉淀物周边变白,加入20 μlTE缓冲液溶解,-20 ℃冰箱保存。
1.4.2细菌DNA提取
挑取菌落用TE缓冲液制成0.5 ml的悬浮液,加入100 μl溶菌酶溶液,于37 ℃孵育30 min,再加入10%的SDS液150 μl、20 μl蛋白酶K溶液,充分混匀后,于56 ℃孵育3 h至沉淀物完全溶解,震摇数次使之混匀。后续步骤同血标本DNA的提取,同时以200 μl的TE缓冲液按上述方法提取后作为PCR操作的阴性对照。
1.4.3PCR反应
用引物扩增对照菌株:大肠埃希菌、金黄色葡萄球菌,并用DNA提取过程中同步操作的TE缓冲液作为阴性对照,10×PCR缓冲液5 μl,4种dNTP混合物4μl,上游引物0.5μl,下游引物0.5μl,水生嗜热菌(thermus aquaticus,Taq)DNA聚合酶0.5μl,模板2 μl,加入37.5 μl已消毒过滤的去离子水,混匀后离心数秒后按预变性95 ℃ 10 min、94 ℃ 45 s、60 ℃ 30 s以及72 ℃ 60 s参数扩增,共35个循环,于72 ℃延伸10 min,置于4 ℃保存待检。
1.4.4PCR结果判断
使用琼脂糖凝胶电泳判断PCR产物中有无DNA。将混合物及DNA Marker加至样品槽中,80 V电泳30 min,凝胶置于凝胶成像系统中拍照并保留记录,370 bp处有荧光者为阳性。
1.5观察指标及评价标准
观察血标本经血培养与PCR检测后的阳性例数、两种方法的检测时间;计算两种方法的检测阳性率;以传统检测的血培养为评价“金标准”,计算PCR检测的灵敏度和特异度。
1.6统计学方法
采用SPSS19.0统计软件对所有数据进行分析处理,计量资料用均数±标准差(x-±s)表示,计数资料用率(%)表示。两种方法的检测结果采用配对x2检验进行差异性比较,a=0.05为检验水准,以P<0.05为差异有统计学意义。
2 结果
(1)对126例疑似新生儿败血症患儿的血标本进行血培养检测,其中阳性率为13.8%(17/126);经PCR检测,阳性率为22.2%(28/126),PCR检测阳性率明显高于血培养检测阳性率,差异有统计学意义(x2=10.234,P<0.05)。以血培养为“金标准”,PCR检测灵敏度和特异度分别为88.2%(15/17)和88.1%(96/109),血培养与PCR法两者的阳性符合率为11.9%(15/126),见表1。
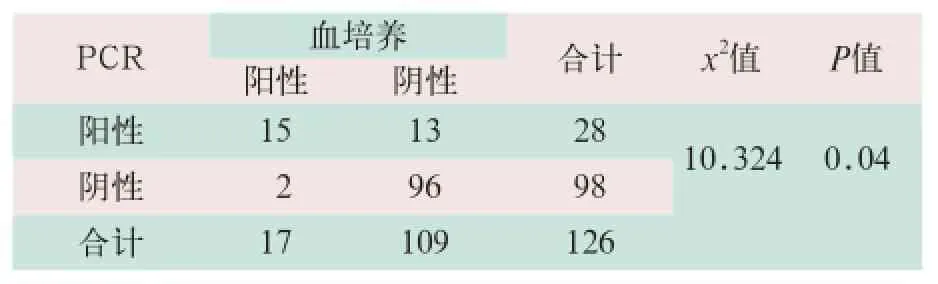
表1 血培养与PCR方法检测结果比较(例)
(2)两种方法检测28例正常对照者的血标本均为阴性。从操作时间分析,血培养和PCR检测的平均时间分别为(50.9±4.3)h和(7.5±1.2)h,PCR检测速度明显快于血培养;PCR产物的核酸电泳成像如图1所示。
图1 PCR产物核酸电泳成像图
3 讨论
16S rRNA基因是细菌上编码rRNA相对应的DNA序列,存在于所有细菌的基因组中,16S rRNA具有高度的保守性和特异性,且其基因序列足够长(包含约50个功能域)。随着PCR技术的出现及核酸研究技术的不断完善与发展,16S rRNA基因检测技术已成为病原菌检测和鉴定的一种强有力工具。相对于常规的血培养技术,PCR技术除了具有敏感性高、特异性强及检测时间短的优点,其最大的优势是检测结果不受血标本中存在的各种抗菌药物的干扰[9-12]。因此,该技术不仅能将常规血培养无法检测的细菌识别出来,实现对病原菌快速、准确地进行分类鉴定和检测,还可以用于疑似某种感染性疾病并已采用某些抗菌药物治疗的患者[12]。
临床上新生儿败血症早期往往缺乏特异的临床症状及体征,主要表现为非特异性症状,包括精神差、反应不佳、哭声减弱无调以及奶欲减退等。因此,对该病的早期诊断必须依靠一定的检测技术快速准确地找到病原菌。目前,临床上诊断新生儿败血症除血培养外,还有白细胞计数、血小板计数、C反应蛋白以及降钙素原等非特异指标检测,但这些非特异指标的检测因本身条件的限制而存在缺陷,不能做到快速准确地早期诊断。通常作为诊断“金标准”的血培养因阳性率较低,且检测时间长也不能达到早期诊断的目的,故本研究采用细菌16S rRNA基因PCR检测方法,对126例疑似新生儿败血症患儿的血标本进行检测,其阳性率明显高于血培养检测的阳性率,表明PCR检测技术诊断阳性率较高。
本研究检测结果显示,有13份血标本PCR阳性而血培养阴性,原因可能为血培养所用血标本细菌浓度太低,导致检测结果为假阴性;入院前患者服用的抗生素抑制了细菌生长,导致血培养结果为阴性。有2份血标本血培养阳性而PCR阴性,可能原因为:血标本本身无细菌,因血培养时被细菌污染而导致血培养为假阳性;血标本中含有PCR反应酶的抑制剂导致PCR阴性。本研究结果表明,以血培养为“金标准”,PCR检测技术灵敏度和特异度均较高。此外,从操作时间分析,PCR检测速度明显快于血培养。而本研究结果与国内相关学者对16S rRNA基因PCR法的研究报道结果基本一致[13-16]。
综上所述,细菌16S rRNA基因PCR法不仅具有速度快、敏感性高、特异性强以及检测时间短的优点,且不受抗生素的干扰,临床上可为新生儿败血症早期诊断提供快速和准确的病原学依据。
[1]LeDoare K,Heath PT.An overview of global GBS epidemiology[J].Vaccine,2013,31:D7-12.
[2]中华医学会儿科学分会新生儿学组,中华医学会中华儿科杂志编辑委员会.新生儿败血症诊疗方案[J].中华儿科杂志,2003,41(12):897-899.
[3]吕其军,史太阳,周芳,等.16S rRNA基因检测在脓毒症早期诊断中的研究进展[J].中华医院感染学杂志,2016,26(10):2395-2397.
[4]Wilson KH,Blitchington RB,Greene RC.Amplification of bacterial 16S ribosomal DNA with polymerase chain reaction[J].J Clin Microbiol,1990,28(9):1942-1946.
[5]崔颖鹏,黄朱亮.细菌16S核糖体RNA基因检测杰氏棒状杆菌一株[J].中华诊断学电子杂志,2015,3(4):296-298.
[6]王远明,杜惠容,陈恒,等.16S rRNA基因检测对新生儿败血症诊断价值的Meta分析[J].中国医药导报,2012,9(24):11-13.
[7]祝撷英,王立军,张红爱.16S rRNA基因检测在新生儿化脓性脑膜炎早期诊断中的应用[J].陕西医学杂志,2012,41(10):1389-1390.
[8]中华医学会儿科学分会新生儿学组,中华医学会中华儿科杂志编辑委员会.新生儿败血症诊疗方案[J].中华儿科杂志,2003,41(12):897-899.
[9]郭盼,马萍,王海龙,等.BD BACTEC 9120血培养仪联合血清降钙素原在血流感染诊断中的应用[J].中国医学装备,2015,12(10):91-94.
[10]吕治,彭国丽,苏建荣.细菌16S rRNA基因PCR诊断细菌性阴道病的研究[J].首都医科大学学报,2012,33(2):153-157.
[11]陈淑丽,茅双根.新生儿败血症相关实验室诊断指标的研究进展[J].辽宁医学院学报,2016,37(2):104-106.
[12]陈秉宇,吕火祥,谢一唯.血液细菌16SrRNA基因检测的诊断价值[J].全科医学临床与教育,2007,5(5):370-371,377.
[13]杨祖卿.16S rRNA基因在临床上的应用进展[J].国外医学儿科学分册,2005,32(4):252-255.
[14]张勇,凌建英.16S rRNA基因在快速诊断新生儿败血症的病原菌研究[J].中国优生与遗传杂志,2014,22(1):71-72.
[15]张树芹.16S rRNA基因扩增在新生儿败血症诊断中的研究[J].中国卫生检验杂志,2012,22(4):744-746.
[16]叶丽君,喻长法,段达荣,等.16S rRNA基因检测在自发性腹膜炎快速诊断中的应用价值[J].中国卫生检验杂志,2015,25(12):1978-1979,1993.
Research significance about the detection of 16SrRNA gene in the early diagnosis of neonatal septicemia
JIA Yong–feng, ZHU Jin-mei// China Medical Equipment,2016,13(11):90-93.
Objective: To study the significance about the detection of 16SrRNA gene in the early diagnosis of neonatal septicemia. Methods: 126 cases with suspecting neonatal septicemia meningitis were collected. Every sample was detected with blood culture and 16SrRNA gene polymerase chain reaction (PCR) test, comparing testing rapidity, sensitivity and specificity of bacterial pathogens of two kinds of methods. Results: The tests positive rate of 126 cases suspecting neonatal septicemia with blood culture was 13.8% (17/126). PCR detection positive rate was 22.2% (28/126). PCR detection positive rate was significantly higher than blood culture positive rate, and the difference was statistically significant (McNemar=10.234, P=0.004). Taking blood culture as the “gold standard”, the sensitivity of PCR detection was 88.2% (15/17) and specificity was 88.1% (96/109). Analyzing the operating time, the average test time of blood culture and PCR detection was (28.9±4.3)h and (7.5±1.2)h respectively. The test speed of PCR detection was faster than blood culture. Conclusion: PCR detection method of the bacterial 16SrRNA gene is fast, and has high sensitivity and strong specificity. It is not affected by the antibiotics, and can provide reliable basis for the early diagnosis of neonatal septicemia.
16SrRNA gene; Neonatal septicemia; Early diagnosis; Polymerase chain reaction
贾永锋,男,(1973- ),本科学历,副主任医师。商洛市中心医院新生儿科,从事新生儿诊疗工作。
1672-8270(2016)11-0090-04
R722.131
A
10.3969/J.ISSN.1672-8270.2016.11.027
①商洛市中心医院新生儿科 陕西 商洛 721000
②重庆市中医院检验科 重庆 400021
2016-08-29

