甘草次酸对哮喘大鼠的抗氧化应激作用及NF-κB信号通路的调控*
陈 伟,马 磊,杨立山
宁夏医科大学总医院急诊科 银川 750004
甘草次酸对哮喘大鼠的抗氧化应激作用及NF-κB信号通路的调控*
陈 伟,马 磊,杨立山#
宁夏医科大学总医院急诊科 银川 750004
#通信作者,男,1965年4月生,硕士,教授,主任医师,研究方向:临床药理学,E-mail:nyfyyls@126.com
甘草次酸;支气管哮喘;NF-κB;氧化应激;大鼠
目的:探讨甘草次酸对哮喘大鼠肺组织NF-κB、IL-6、IL-5蛋白表达及抗氧化应激能力的影响。方法:采用卵清白蛋白致敏法制备大鼠支气管哮喘模型,并给予甘草次酸高、中、低(200、100、50 mg/kg)剂量进行干预;同时设正常对照和地塞米松对照;每组10只大鼠。干预7 d后处死大鼠,用生化法测大鼠血清超氧化物歧化酶(SOD)、丙二醛(MDA)、总抗氧化能力(T-AOC)及谷胱甘肽过氧化物酶(GSH-Px),用RT-PCR和Western-blot法测大鼠肺组织NF-κB、IL-6及IL-5 mRNA及蛋白表达水平。结果:与正常对照比较,模型组和GA各剂量组大鼠血清SOD、GSH-Px及T-AOC水平降低,MDA水平升高,肺组织中NF-κB、IL-6及IL-5 mRNA和蛋白表达水平升高(P<0.05)。与模型组比较,甘草次酸高、中剂量组大鼠血清SOD、GSH-Px水平升高, MDA水平降低(P<0.05),肺组织中NF-κB、IL-6及IL-5 mRNA和蛋白表达水平降低(P<0.05),其中甘草次酸高剂量组变化更显著。结论:甘草次酸对哮喘大鼠氧化应激有拮抗作用,其机制与调控NF-κB信号通路有关。
支气管哮喘是由多种炎性细胞、细胞因子及氧化应激参与的气道慢性炎症性疾病[1]。核因子κB(nuclear factor-kappa B,NF-κB)是一种重要的转录调节因子,具有广泛的细胞调节功能,参与炎症和免疫反应的调控,与哮喘的发生发展密切相关[2]。氧化应激(oxidative stress,OS)是指体内氧化与抗氧化作用失衡,倾向于氧化,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物,介导气道炎症发生和高反应性,加重哮喘[3]。甘草次酸(glycyrrhetinic acid, GA)是从豆科植物甘草(GlycyrrhizauralensisFisch)根茎中提取的一种重要的有效活性成分,属五环三萜皂苷类化合物,在结构上与甾体类激素相似,具有抗炎、抗菌、抗肿瘤、抗心律失常及肾上腺皮质激素样作用[4]。作者采用卵清白蛋白(ovalbumin,OVA)致敏法复制支气管哮喘大鼠模型,观察GA对模型大鼠肺组织中NF-κB信号通路及氧化应激水平的影响,探讨其抗哮喘机制。
1 材料与方法
1.1 动物、试剂与仪器 SPF级SD大鼠,雄性,8周龄,体重160~200 g,由西安交通大学医学院实验动物中心提供(合格证:医动字08-005),普通饮食水饲养。GA(纯度 ≥98%)购自南京景竹生物科技有限公司;地塞米松磷酸钠注射液(dexamethasone,DEX)购自天津金耀药业有限公司,批准文号2020514;OVA(GradeⅡ)为Sigma公司进口分装产品,批号A-5253;氢氧化铝为天津市化学试剂三厂产品,批号20101125;超氧化物歧化酶(SOD)、丙二醛(MDA)、总抗氧化能力(T-AOC)及谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自南京建成生物工程研究所;Trizol试剂(BBI,Kitchener, Ont., Canada公司);RevertAidTMFirst strand cDNA 合成试剂盒(Ferments, GlennBurnie, Md., 美国);引物由上海生工生物工程有限公司合成;兔抗大鼠NF-κB、IL-6、IL-15及β-actin抗体购自Santa Cruz公司;细胞裂解液、辣根过氧化物酶标记的羊抗兔二抗、蛋白定量试剂盒、PVDF膜等购自武汉博士德生物工程有限公司。YLS-8A多功能诱咳引喘仪(山东省医学科学院设备站);752N紫外可见分光光度计(上海精密科学仪器有限公司);WH-861旋涡混匀器(太仓市科教器材厂);TGL-16/TGL16型台式高速冷冻离心机(湖南湘仪离心机仪器有限公司);电子天平(BS200s-WEI,德国塞多利斯)检测范围1 mg~210 g;HH-W420恒温水浴箱(常州中捷实验仪器有限公司)。
1.2 实验分组 取大鼠60只,随机分为6组,分别为正常对照组,哮喘模型组,DEX组和GA低、中、高剂量组,每组10只。除正常对照组,其他5组采用OVA致敏法复制支气管哮喘大鼠模型[5]:于第1天和第7天腹腔注射新鲜配制的1 mg OVA+200 mg 氢氧化铝+1 mL 生理盐水混悬液0.2 mL;第8天将致敏大鼠置于诱咳引喘仪雾化箱中,用含10 g/L OVA的生理盐水进行雾化激发,每次30 min。正常对照组第1天和第7天腹腔注射生理盐水0.2 mL,用生理盐水进行雾化激发。第9日起在每次激发前2 h给药:正常对照组与模型组给予生理盐水1 mL/kg灌胃, DEX组腹腔注射DEX 0.5 mg/kg,GA低、中、高剂量组分别按50、100、200 mg/kg灌胃GA,连用7 d。末次激发后24 h,水合氯醛腹腔麻醉大鼠,经腹主动脉取血备查,然后处死大鼠,取肺组织置于液氮中储存备用。
1.3 血清指标测定 取血后,2 500 r/min离心10 min分离血清,采用生化法测定SOD、MDA、T-AOC及GSH-Px。
1.4 肺组织NF-κB、IL-6及IL-5 mRNA的检测 提取大鼠肺组织总RNA,采用RT-PCR法检测NF-κB、IL-6及IL-5 mRNA表达水平。NF-κB引物序列上游:5’-GCGCATCCAGACCAACAATAA-3’,下游:5’-GCCGAAGCTGCATGGACACT-3’;IL-6引物序列上游:5’-TGGAGTCACAGAAGGAGTGGCTAAG-3’,下游:5’-TCTGACCACAGTGAGGAATGTCCAC-3’;IL-5引物序列上游:5’-ACCTTCCAGGATGAGGACATGA-3’,下游:5’-GATTCTTTCCTTTGAGGCCCA-3’;β-actin引物序列上游:5’-CCCATCTATGAGGGTTACGC-3’,下游:5’-TTTAATGTCACGCACGATTTC-3’。PCR反应条件:94 ℃预变性3 min;94 ℃ 35 s,58 ℃ 30 s,72 ℃ 40 s,共35个循环;72 ℃延伸 10 min。取扩增产物8 μL于25 g/L琼脂糖凝胶中电泳,凝胶成像,读取条带光密度值,以目的条带与β-actin条带光密度值的比值表示目的mRNA的表达水平。
1.5 肺组织NF-κB、IL-6及IL-5 蛋白的检测 取肺组织置于1~2 mL匀浆器中,加400 μL 单去污剂裂解液(含PMSF)进行匀浆,使组织尽量碎裂;充分裂解30 min,提取蛋白并调整蛋白浓度,加入2×SDS Loading buffer,95 ℃水浴煮沸5 min进行蛋白变性。120 g/L SDS-PAGE凝胶电泳并转膜,50 g/L脱脂奶粉4 ℃封闭过夜,然后加一抗室温孵育2 h,加二抗孵育1 h,凝胶成像仪下显色观察,记录条带光密度值,以目的条带与β-actin条带光密度值之比表示目的蛋白的表达水平。
1.6 统计学处理 数据处理使用SPSS 16.0。6组肺组织中各mRNA和蛋白表达水平的比较及血清指标的比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 6组大鼠血清SOD、MDA、T-AOC及GSH-Px的比较 见表1。与正常对照组比较,哮喘模型组大鼠血清SOD、GSH-Px及T-AOC水平下降,MDA水平升高(P<0.05)。与哮喘模型组比较,GA高剂量组大鼠血清SOD、GSH-Px水平均升高,MDA水平降低(P<0.05),GA中、低剂量组变化不显著。

表1 6组大鼠血清SOD、 MDA、T-AOC及GSH-Px的比较
*:与正常对照组比较,P<0.05;△:与哮喘模型组比较,P<0.05。
2.2 6组大鼠肺组织中NF-κB、IL-6及IL-5 mRNA表达水平的比较 见图1、表2。与正常对照组比较,哮喘模型组和GA各剂量组大鼠肺组织中NF-κB、IL-6及IL-5 mRNA表达水平增高(P<0.05)。与哮喘模型组比较,GA高、中剂量组大鼠肺组织中NF-κB、IL-6及IL-5 mRNA表达水平降低(P<0.05),其中高剂量组变化更显著。
2.3 6组大鼠肺组织中NF-κB、IL-6及IL-5蛋白表达的比较 见图2、表3。与正常对照组比较,哮喘模型组和GA各剂量组大鼠肺组织中NF-κB、IL-6及IL-5蛋白表达水平明显升高(P<0.05)。与哮喘模型组比较,GA高、中剂量组大鼠肺组织中NF-κB、IL-6及IL-5蛋白表达水平降低(P<0.05),其中高剂量组变化更显著。

1:正常对照组;2:哮喘模型组;3:DEX组;4:GA高剂量组;5:GA中剂量组;6:GA低剂量组。图1 6组大鼠肺组织中NF-κB、IL-6及IL-5 mRNA的检测表2 6组大鼠肺组织中 NF-κB、IL-6及IL-5 mRNA表达水平的比较
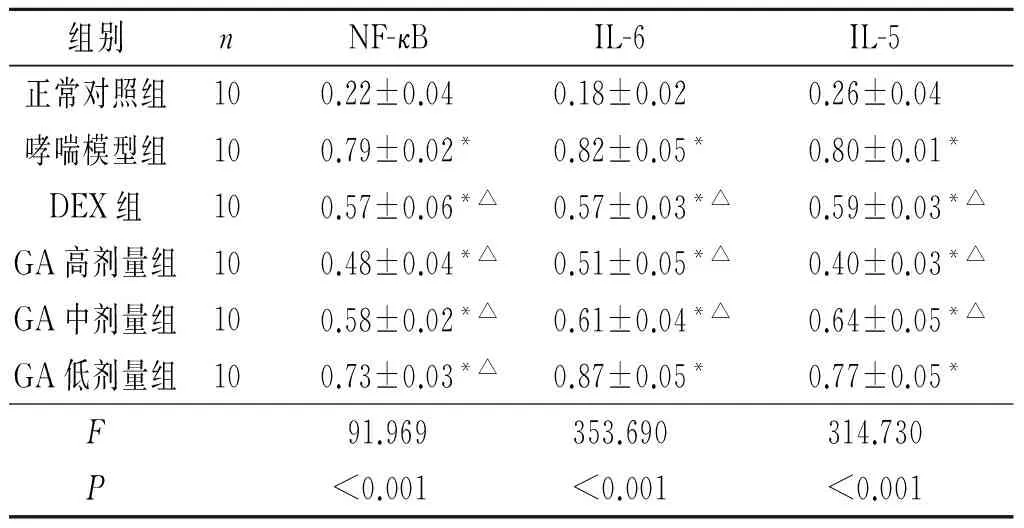
组别nNF-κBIL-6IL-5正常对照组100.22±0.040.18±0.020.26±0.04哮喘模型组100.79±0.02*0.82±0.05*0.80±0.01*DEX组100.57±0.06*△0.57±0.03*△0.59±0.03*△GA高剂量组100.48±0.04*△0.51±0.05*△0.40±0.03*△GA中剂量组100.58±0.02*△0.61±0.04*△0.64±0.05*△GA低剂量组100.73±0.03*△0.87±0.05*0.77±0.05*F91.969353.690314.730P<0.001<0.001<0.001
*:与正常对照组比较,P<0.05;△:与哮喘模型组比较,P<0.05。

1:正常对照组;2:哮喘模型组;3:DEX组;4:GA高剂量组;5:GA中剂量组;6:GA低剂量组。图2 6组大鼠肺组织中 NF-κB、IL-6及IL-5蛋白表达水平的比较表3 6组大鼠肺组织中 NF-κB、IL-6及IL-5蛋白表达水平的比较
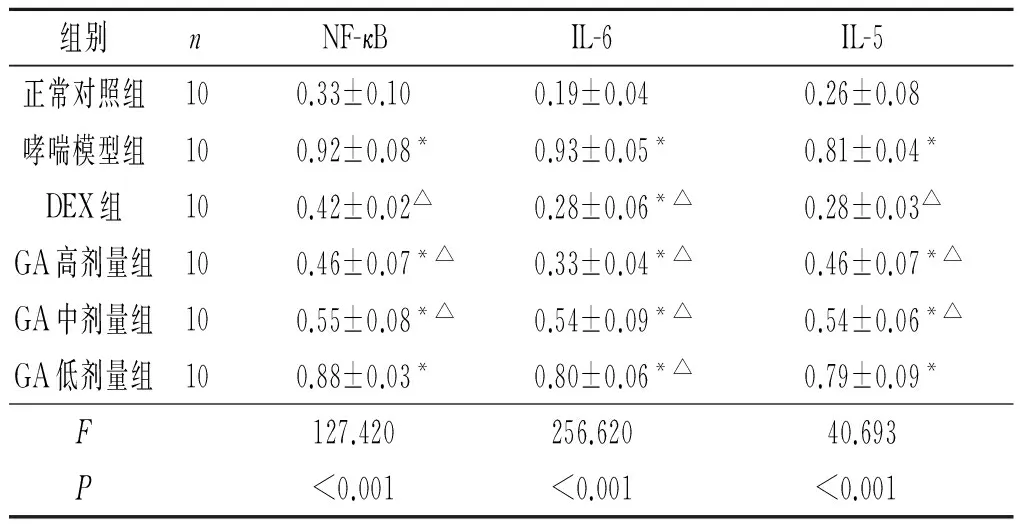
组别nNF-κBIL-6IL-5正常对照组100.33±0.100.19±0.040.26±0.08哮喘模型组100.92±0.08*0.93±0.05*0.81±0.04*DEX组100.42±0.02△0.28±0.06*△0.28±0.03△GA高剂量组100.46±0.07*△0.33±0.04*△0.46±0.07*△GA中剂量组100.55±0.08*△0.54±0.09*△0.54±0.06*△GA低剂量组100.88±0.03*0.80±0.06*△0.79±0.09*F127.420256.62040.693P<0.001<0.001<0.001
*:与正常对照组比较,P<0.05;△:与哮喘模型组比较,P<0.05。
3 讨论
哮喘是气道常见的慢性炎症之一,其发生与细胞因子、炎症介质、趋化因子及多种酶等的表达异常有关。氧化应激是哮喘的主要表现之一,是机体氧化与抗氧化失衡的结果。哮喘发作时,各种炎症细胞和免疫细胞被激活并产生大量活性氧(ROS),ROS可诱发脂质过氧化、DNA损伤和蛋白质变性等,同时还可活化NF-κB等转录因子,促进一些炎症因子的表达,进一步加重哮喘反应[6]。为防止氧化应激对机体的损伤,机体通常会产生抗氧化剂来抵御氧自由基的损害,SOD、GSH-Px是体内重要的自由基清除剂,可抵御机体的过氧化反应。MDA是一种重要的脂质过氧化产物,T-AOC与机体抗氧化能力密切相关。上述指标的血清水平可间接反映机体氧化应激程度和防御氧自由基损害的能力[7-8]。
NF-κB是一种调节基因转录的关键核蛋白,具有广泛的生物学活性,可调控炎症介质及细胞因子的转录,在炎症和免疫反应中至关重要[9]。当细胞受到刺激时,NF-κB的诱导剂通过激活胞浆中的I-κB激酶使I-κB发生磷酸化和泛素化,最后使NF-κB/I-κB二聚体复合物解离,游离的NF-κB迅速通过核膜上的受体被转运至细胞核内,与DNA分子中的特异性位点结合,从而快速启动靶基因(IL-6、IL-5等)转录,生成相应的mRNA和蛋白质[10]。同时,NF-κB作为上游转录调控因子,可诱导IL-6、IL-5等细胞因子过度或持续表达,进而促使大量的炎症细胞(中性粒细胞、嗜酸性粒细胞、单核巨噬细胞、淋巴细胞等)浸润和聚集于损伤部位,诱导生成NO、PG等介质,导致炎症反应。IL-6、IL-5等细胞因子又是NF-κB的活化剂,可进一步激活NF-κB,引发持续或放大的炎症反应[11]。研究[12]报道,NF-κB参与了哮喘的发生和发展,哮喘患者气道黏膜下细胞、痰中细胞、上皮细胞及支气管活检标本中NF-κB的活性和表达量较正常人明显增高。IL-5、IL-6的表达主要受NF-κB调控,当NF-κB被激活,IL-5和IL-6的生成相应增多,致使IgE合成增多,形成嗜酸性粒细胞性炎症,对气道产生持续浸润,加速加重哮喘的发作[13-14]。
该研究结果显示,200、100 mg/kg的GA可明显降低哮喘大鼠血清MDA含量,增加大鼠血清SOD、GSH-Px水平,明显降低哮喘大鼠肺组织NF-κB、IL-5及IL-6 mRNA和蛋白表达水平,提示GA可能通过抑制NF-κB向核内转移,减少炎症介质IL-5、IL-6等的转录和合成,从而拮抗大鼠哮喘时的氧化应激状态,对哮喘大鼠有一定的保护作用,其作用机制可能与调控NF-κB信号通路有关。
[1]DUNN RM,WECHSLER ME.Anti-interleukin therapy in asthma[J].Clin Pharmacol Ther,2015,97(1):55
[2]CHEN M,LV Z,ZHANG W,et al.Triptolide suppresses airway goblet cell hyperplasia and Muc5ac expression via NF-κB in a murine model of asthma[J].Mol Immunol,2015,64(1):99
[3]杨明,李国平.氧化应激激活的信号传导与支气管哮喘的研究进展[J].重庆医学,2014,43(7):875
[4]LUO J,LIU M,WU X,et al.DGAEE, a newly synthesized derivative of glycyrrhetinic acid, potently attenuates mouse septic shock via its main metabolite DGA in an IL-10-dependent manner[J].Int Immunopharmacol,2015,29(2):583
[5]杜芳宇,刘剑波.吡格列酮对哮喘小鼠肺组织 GABAARα、MUC5AC表达的影响[J].郑州大学学报(医学版),2014,49(1):33
[6]王尧,杨青,郭锋,等.哮喘气道重塑与氧化应激的实验研究[J].华中科技大学学报(医学版),2011,40(4):457
[7]罗世杰,唐志书,张玲,等.热喘平口服液对支气管哮喘豚鼠一氧化氮、肿瘤坏死因子-α、超氧化物歧化酶及丙二醛的影响[J].河北中医,2011,33(4):589
[8]张铁栓,张国俊,刘颖.还原型谷胱甘肽对哮喘豚鼠气道上皮细胞的保护作用[J].郑州大学学报(医学版),2013,48(1):70
[9]林益平,李昌崇,胡野,等.哮喘大鼠IKK/NF-κB信号通道与抗氧化性的关系及银杏叶提取物的调控[J].中国病理生理杂志,2006,22(7):1388
[10]YOUN DH,WANG H,JEONG SJ.Exogenous tumor necrosis factor-alpha rapidly alters synaptic and sensory transmission in the adult rat spinal cord dorsal Horn[J].J Neurosci Res,2008,86(13):2867
[11]LAWRENCE T.The Nuclear Factor NF-kappa B Pathway in Inflammation[J].Cold Spring Harb Perspect Biol,2009,1(6):a001651
[12]马秀琴,黄茂,卞涛,等.地塞米松对哮喘大鼠肺组织NF-κB和MMP-9及TIMP-1表达的影响[J].南京医科大学学报(自然科学版),2005,25(4):255
[13]尹静波.炎性细胞因子在支气管哮喘发病机制中的作用[J].国际检验医学杂志,2011,32(10):1087
[14]GARCIA G,TAILLÉ C,LAVENEZIANA P,et al.Anti-interleukin-5 therapy in severe asthma[J].Eur Respir Rev,2013,22(129):251
(2016-03-08收稿 责任编辑王 曼)
Effects of glycyrrhetinic acid on oxidative stress and NF-κB signal pathway in bronchial asthma rats
CHENWei,MALei,YANGLishan
DepartmentofEmergency,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004
glycyrrhetinic acid;bronchial asthma;NF-κB;oxidative stress;rat
Aim: To investigate the effects of glycyrrhetinic acid(GA) on the NF-κB signal pathway and anti-oxidative stress capability in experimental asthma rats. Methods: Ovalbumin allergization was used to establish bronchial asthma rat model, and the model rats were given GA(200, 100, 50 mg/kg) through intragastric administration once a day for 7 days, respectively,blank control, asthma model control and dexamethasone control were employed in the experiment,and 10 rats were in each group. The levels of SOD, MDA, GSH-Px and T-AOC in serum were determined by biochemical methods. The mRNA and protein expressions of NF-κB, IL-6 and IL-5 in lung tissue were determined by RT-PCR and Western blot,respectively. Results: Compared with the blank control group, the activity of SOD, GSH-Px and T-AOC in serum of asthma model control group and 3 GA groups decreased, the serum level of MDA was higher, and the mRNA and protein expressions of NF-κB, IL-6 and IL-5 in lung tissue were higher(P<0.05). Compared with the asthma model control group, the activity of SOD and GSH-Px in serum of 200 and 100 mg/kg GA group were higher, the serum level of MDA was lower, the mRNA and protein expressions of NF-κB, IL-6 and IL-5 in lung tissue were lower(P<0.05),and the changes of 200 mg/kg GA group were more obvious. Conclusion: GA has the capability to against oxidative stress in asthma rats, which may be related to the NF-κ B signal pathway.
10.13705/j.issn.1671-6825.2016.06.018
*宁夏科技支撑计划项目(2015)
R285.5

