慢性不可预见性心理应激致大鼠颞下颌关节损伤髁突组织中TNF-α和Caspase-3蛋白的表达*
董 晶,黎 婷,宋文婷,蔡文燕,王 超,孙晋虎
1)徐州医科大学口腔医学院 徐州 221004 2)徐州医科大学附属医院口腔科 徐州 221004
慢性不可预见性心理应激致大鼠颞下颌关节损伤髁突组织中TNF-α和Caspase-3蛋白的表达*
董 晶1,2),黎 婷1),宋文婷1),蔡文燕1),王 超1),孙晋虎1,2)#
1)徐州医科大学口腔医学院 徐州 221004 2)徐州医科大学附属医院口腔科 徐州 221004
#通信作者,男,1969年9月生,博士,主任医师,教授,研究方向:口腔颌面疾病,E-mail:jinhu-sun@sohu.com
慢性不可预见性心理应激;颞下颌关节;凋亡;TNF-α;Caspase-3;大鼠
目的:通过慢性不可预见性心理应激建立大鼠颞下颌关节损伤模型,探讨髁突的病理性改变和可能的作用机制。方法:选取7周龄雄性SD大鼠64只,分为空白对照(CON)组及心理应激(PS)组。PS组予以慢性不可预见性心理应激,建立大鼠颞下颌关节损伤模型。各组于实验1、3、5、7周各处死8只大鼠,测定大鼠体重,并通过HE染色了解髁突的组织形态学改变,采用免疫组化PV染色法了解髁突组织中TNF-α和Caspase-3蛋白的表达情况。结果:与CON组相比,PS组大鼠体重增长较慢,5、7周时体重下降明显(P<0.05)。此外,PS组大鼠髁突出现了胶原松解、水肿等病理性改变,其中3周时损伤最为严重,表现为细胞胶原纤维松解、断裂,形成大小不一的裂隙;5周时髁突表层纤维松解的情况较3周有所减轻,但细胞层次略紊乱;7周时髁突内部细胞数目减少,出现了无细胞空白区域。PS组大鼠髁突组织中TNF-α、Caspase-3蛋白的表达均较CON组升高(P<0.05)。结论:慢性心理应激可致大鼠体重及颞下颌关节髁突组织结构改变,可能是通过上调炎症因子及凋亡相关蛋白的表达,促进髁突软骨细胞凋亡来实现的。
颞下颌关节紊乱病(temporomandibular disorders,TMD)是口腔颌面系统常见的疾病,累及颞下颌关节和(或)咀嚼肌系统,具有疼痛、关节弹响、张口受限、下颌运动异常等相关症状,是多种致病因素共同作用的结果[1]。随着研究的深入,越来越多的研究者[2-3]认为TMD是一种心身疾病,心理应激因素在其发生、发展和预后的过程中起着重要的作用。然而心理应激致TMD的机制尚未完全明确,作者拟通过建立慢性不可预见性心理应激(chronic unpredicted mild stress,CUMS)大鼠颞下颌关节损伤模型,观察髁突组织形态学变化,并了解其可能的作用机制,为治疗心理应激所致的颞下颌关节损伤提供思路。
1 材料与方法
1.1 主要试剂 HE染色试剂盒购自碧云天公司,TNF-α相关抗体购自Abcam公司,Caspase-3相关抗体购自苏州睿瀛生物技术有限公司,免疫组织化学PV染色法试剂盒购自北京中杉金桥生物有限公司。
1.2 实验动物和分组 选取7周龄体重(200±20) g的雄性SD大鼠(由徐州医科大学实验动物中心提供)。实验前采用旷场实验对大鼠情绪状态进行评估,选取在正常情绪状态的64只大鼠作为研究对象,将动物随机分为心理应激组(psychological stress,PS组)和空白对照组(CON组),各组再分为1、3、5、7周处理时间点(n=8)。
1.3 CUMS模型的建立 根据Luo等[4]的应激模型建立方法并加以适当改进,由禁水24 h、禁食24 h、应用潮湿垫料24 h、4 ℃强迫游泳 5 min、45 ℃强迫游泳5 min、昼夜颠倒12 h/12 h、倾斜鼠笼24 h等因素构成。PS组大鼠在每日上午8:00~9:00随机予以上述刺激,每种刺激每周有且只出现1次。PS组和CON组的饲养条件相同。实验前,各组大鼠体重和行为学均衡,具有可比性。
1.4 体重测定 若模型动物的体重较对照组降低可视为建模有效[5]。分别在1、3、5、7周最后1次应激结束后,测量CON组和PS组大鼠的体重。
1.5 大鼠髁突的改变
1.5.1 HE染色 处死大鼠后,取双侧髁突,左侧髁突用40 g/L多聚甲醛固定24 h,100 g/L EDTA脱钙4周,梯度乙醇脱水,二甲苯透明,常规石蜡包埋,制成5 μm石蜡切片。一部分用于HE染色,经常规脱蜡复水后,HE染色,脱水、透明、封片。
1.5.2 髁突组织中TNF-α和Caspase-3蛋白的表达 另一部分经复水后,高火3 min、低火15 min柠檬酸盐抗原修复,体积分数3% H2O2灭活10 min,体积分数10%山羊血清封闭30 min,一抗4 ℃孵育过夜,复温后免疫组化PV法试剂1、2分别在37 ℃孵育30 min,DAB染色2 min,复染,分化、脱水、透明、封片。免疫组化评分方法参照文献[6],进行半定量评分。蛋白的表达以细胞质或核内出现(棕)黄色颗粒为阳性。将所采集标本 100 倍染色图像导入 Photoshop CS4 软件,在髁突软骨中随机选择 5个正方形区域,可覆盖全部软骨增殖层、肥大层及部分钙化软骨层,计数区域内的阳性细胞百分率。由两个对实验设计不了解的病理专业人员进行图片采集和计数。
1.6 统计学处理 应用SPSS 16.0进行分析,各组大鼠不同时间点体重、髁突组织中TNF-α和Caspase-3蛋白表达的比较采用重复测量数据的方差分析,检验水准α=0.05。
2 结果
2.1 各组大鼠体重变化情况 见表1。CON组大鼠体重增长比较快,而PS组的大鼠增长速度缓慢,甚至部分大鼠体重出现了负增长,5周后,PS组的体重较CON组下降。

表1 各组大鼠体重变化情况(n=8) g
F组间=5.795,P<0.001;F时间=4.237,P<0.001;F交互=4.750,P<0.001。
2.2 HE染色结果 见图1。CON组中的髁突表面光滑,髁突由外到内可分为纤维层、增殖层、肥大层和钙化软骨层,每一层间细胞层次清楚、排列规则而有序,纤维层明显,胶原纤维致密而厚实。PS组,1周时髁突表面出现了胶原纤维松解情况,纤维层中出现了小的裂隙;3周时,这种裂隙进一步增大,纤维层也开始变薄;5周时髁突表面损伤、破裂的情况较3周时略显减轻;7周时,髁突内软骨细胞减少,甚至出现了无细胞的空白区域。
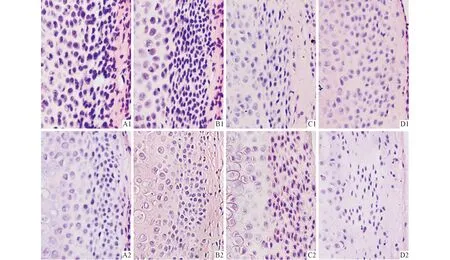
1:CON组;2:PS组;A、B、C、D:分别为1、3、5、7周。图1 各组大鼠髁突组织的HE染色结果(HE,×100)
2.3 各组大鼠髁突组织中TNF-α和Caspase-3蛋白的表达 结果见表2、3和图2、3。CON组髁突组织中,TNF-α和Caspase-3蛋白的表达量都很低,散在表达于软骨浅层的胞质中。而PS组中,TNF-α阳性细胞弥散性地分布在髁突浅层至深部,TNF-α的阳性细胞百分率明显升高,尤以1周组的阳性表达最为明显,提示:心理应激使髁突产生了炎性改变,并且这种改变在应激初期最为明显。而PS组髁突组织中Caspase-3也较CON组明显增多,部分区域呈局灶性聚集,与TNF-α的变化基本趋势一致。
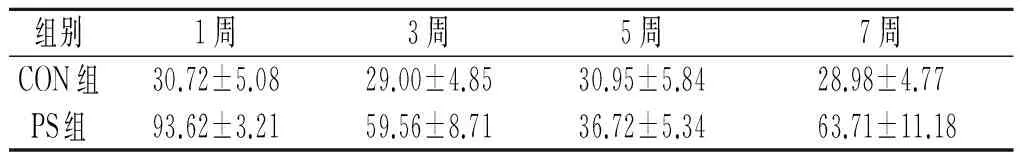
表2 各组大鼠髁突组织 中TNF-α蛋白的表达(n=8) %
F组间=26.831,P<0.001;F时间=8.671,P<0.001;F交互=8.081,P<0.001。
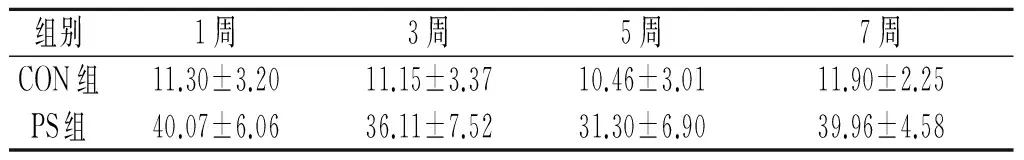
表3 各组大鼠髁突中 caspase-3蛋白的表达(n=8) %
F组间=11.873,P<0.001;F时间=8.565,P<0.001;F交互=7.931,P<0.001。
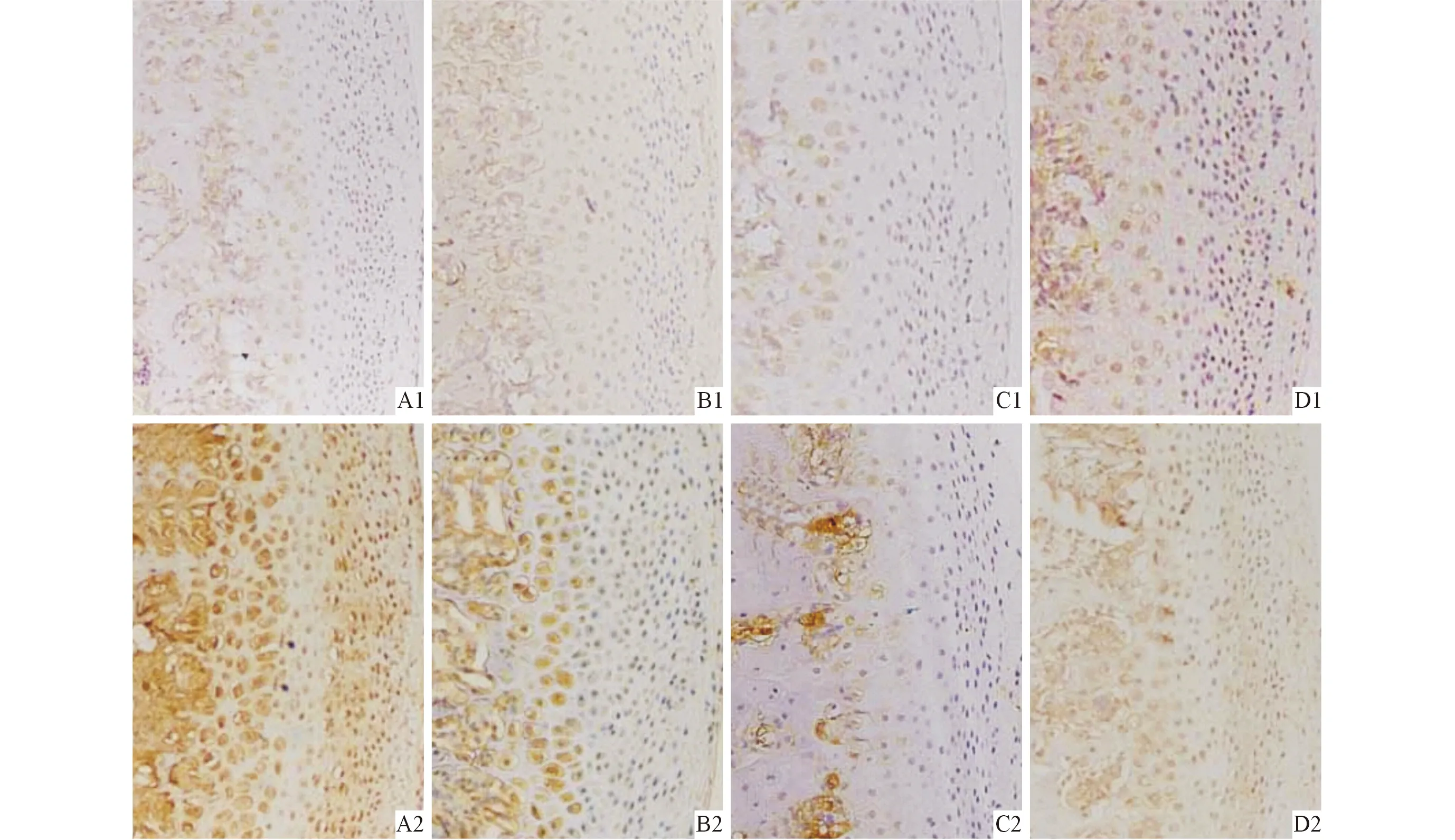
1:CON组;2:PS组;A、B、C、D:分别为1、3、5、7周。图2 各组大鼠髁突组织中TNF-α蛋白的表达(PV,×100)
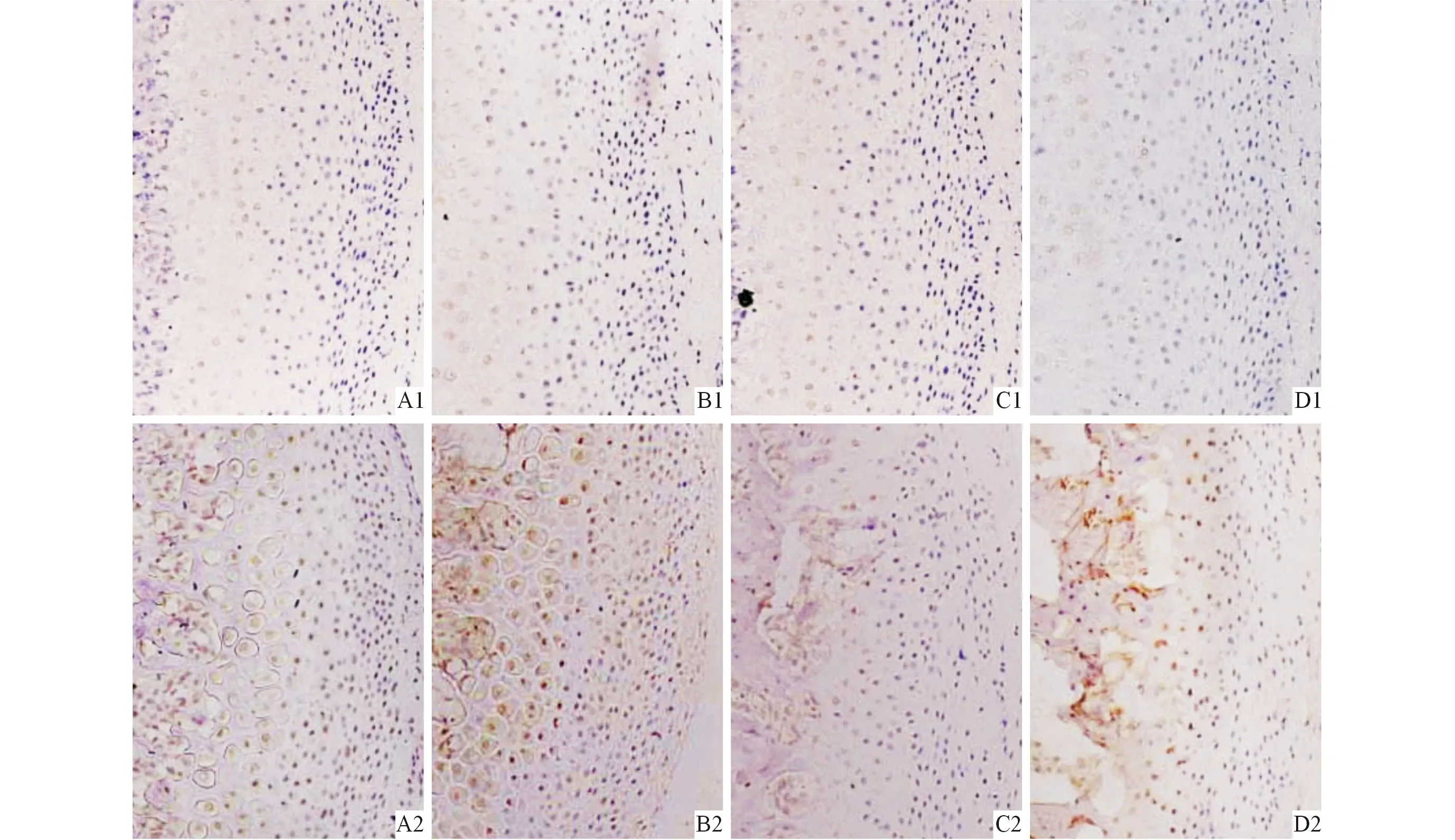
1:CON组;2:PS组;A、B、C、D:分别为1、3、5、7周。图3 各组大鼠髁突组织中Caspase-3蛋白的表达(PV,×100)
3 讨论
心理应激在机体受到各种内外环境刺激时所产生,过度的应激可能对身体造成不良影响[7-9]。有报道[10]称,人类疾病的75%~90%与应激机制的激活有关。TMD被认为与心理应激密切相关,并且有研究[11]表明可通过单独的心理治疗而有效改善颞下颌关节疾病的预后。该实验成功建立了大鼠CUMS模型,发现应激后大鼠体重增长逐渐减慢,呈现出一种饮食减少的抑郁状态。可能是由于应激强度过大或应激时间过长后致海马受损,导致大鼠出现兴趣缺失,从而引起一系列抑郁症状的产生[12]。
软骨细胞是正常关节软骨内部惟一的细胞成分,对正常软骨形态和功能的维持与修复具有重要的作用[13]。当外界刺激因素造成软骨细胞数目减少时,软骨细胞外基质的分泌量便会减少,髁突会出现病理性改变。该研究结果表明应激1周时,PS组大鼠关节表面出现胶原纤维的断裂,髁突表面变得不平整;随着应激时间的延长,这种病理性改变进一步增强,3周时出现了较大范围的髁突表层损伤;5周时又出现了损伤程度减小的情况,提示髁突具有抵抗外界刺激、自我修复的能力;而在应激7周时,髁突表层的纤维层厚度降低,细胞数目减少,在增殖层和肥大层出现了无细胞的空白区域。这与以往研究[14]所证实的该区域更易受到异常生物力影响吻合,也提示髁突的自我修复能力有限。
Caspase即半胱天冬氨酸蛋白酶,是目前已证实在细胞凋亡过程中起主要作用的生物大分子[15]。目前已知的细胞凋亡通路主要为内源性细胞凋亡通路和外源性细胞凋亡通路[16]。内源性细胞凋亡通路是以线粒体为中心的细胞凋亡通路,与Caspase-9及其下游效应Caspases的激活相关[17]。外源性细胞凋亡信号通路,又称为死亡受体通路,与Caspase-8和Caspase-3的活化密切相关[18]。Caspase-3是参与细胞凋亡的重要执行者[19-20]。Wang等[21]发现外源性雌激素可通过激活Fas,FasL,Caspase-3和Caspase-8,加重大鼠颞下颌关节骨关节炎的发生发展。Caspase-3可由炎症因子等激活,TNF-α作为一种重要的炎症因子,也是细胞凋亡过程中的重要媒介,跟颞下颌关节损伤的关节密切。Lee等[22]通过对临床上表现为疼痛、张口受限和关节弹响的颞下颌关节病患者的关节滑液检查,发现其IL-6、TNF-α的表达明显高于正常人。Spears等[23]通过关节腔注射富含TNF-α的佐剂,发现TMJ中出现了Caspase-8和Caspase-3的高表达,并且关节内细胞凋亡明显增加,提示外源性TNF-α可能通过激活细胞凋亡通路对关节造成损伤。作者的研究发现应激后大鼠髁突中TNF-α的表达水平升高,尤以应激1周时表达水平最高,可能因应激初始时关节的炎症反应最为明显迅速,随着应激时间延长,TNF-α的表达降低。Caspse-3的表达趋势与TNF-α相似,表现为初期水平较高,后出现了一定程度的降低。以上结果提示应激可通过上调炎症因子表达、激活凋亡相关蛋白,促进软骨细胞凋亡而造成关节的损伤。而细胞数目的减少使关节的自我修复、支持和营养作用降低。
总之,慢性不可预见性心理应激对大鼠髁突软骨改建活动产生了影响,这种影响可能与激活TNF-α信号通路,上调凋亡相关蛋白Caspase-3的表达,造成软骨细胞数目减少相关,今后可对这种影响的特点、规律进行深入研究,进一步揭示其在颞下颌关节损伤中的作用,以期为治疗应激所致的关节损伤提供帮助。
[1]SCHIFFMAN E,OHRBACH R.Executive summary of the diagnostic criteria for temporomandibular disorders for clinical and research applications[J].J Am Dent Assoc,2016,147(6):438
[2]HUANG F,ZHANG M,CHEN YJ,et al.Psychological stress induces temporary masticatory muscle mechanical sensitivity in rats[J].J Biomed Biotechnol,2011:720603
[3]LI Q,ZHANG M,CHEN YJ,et al.Oxidative damage and HSP70 expression in masseter muscle induced by psychological stress in rats[J].Physiol Behav,2011,104(3):365
[4]LUO DD,AN SC,ZHANG X.Involvement of hippocampal serotonin and neuropeptide Y in depression induced by chronic unpredicted mild stress[J].Brain Res Bull,2008,77(1):8
[5]MUSCAT R,KYPRIANOU T,OSMAN M,et al.Sweetness-dependent facilitation of sucrose drinking by raclopride is unrelated to calorie content[J].Pharmacol Biochem Behav,1991,40(2):209
[6]YU HB,YANG X,CHENG J,et al.Distraction osteogenesis combined with tissue-engineered cartilage in the reconstruction of condylar osteochondral defect[J].J Oral and Maxillofac Surg,2011,69(12):E558
[7]赵洁,张文,童笑梅.胃酸与幼年大鼠应激性溃疡形成的关系[J].实用儿科临床杂志,2007,22(19):1490
[8]吴丹遐,陈强,刘建梅,等.恐惧应激与大鼠支气管哮喘的相关性[J].实用儿科临床杂志,2010,25(21):1643
[9]黄月君,史雪川,许宏武,等.母鼠妊娠前慢性不可预见性应激对胎鼠大脑5-羟色胺1A受体表达的影响[J].实用儿科临床杂志,2011,26(6):404
[10]LANDI N,MANFREDINI D,LOMBARDI I,et al.17-beta-estradiol and progesterone serum levels in temporomandibular disorder patients[J].Minerva Stomatol,2004,53(11/12):651
[11]TUNCER AB,ERGUN N,TUNCER AH,et al.Effectiveness of manual therapy and home physical therapy in patients with temporomandibular disorders:a randomized controlled trial[J].J Bodyw Mov Ther,2013,17(3):302
[12]HAN Y,KHODR CE,SAPRU MK,et al.A microRNA embedded AAV alpha-synuclein gene silencing vector for dopaminergic neurons[J].Brain Res,2011,1386:15
[13]UMLAUF D,FRANK S,PAP T,et al.Cartilage biology, pathology, and repair[J].Cell Mol Life Sci,2010,67(24):4197
[14]CHEN CT,BURTON-WURSTER N,BORDEN C,et al.Chondrocyte necrosis and apoptosis in impact damaged articular cartilage[J].J Orthop Res,2001,19(4):703
[15]JURAVER-GESLIN HA,Durand BC.Early development of the neural plate:new roles for apoptosis and for one of its main effectors caspase-3[J].Genesis,2015,53(2):203
[16]CHEN M,WANG J.Initiator caspases in apoptosis signaling pathways[J].Apoptosis,2002,7(4):313
[17]WUERSTLE ML,LAUSSMANN MA,REHM M.The central role of initiator caspase-9 in apoptosis signal transduction and the regulation of its activation and activity on the apoptosome[J].Exp Cell Res,2012,318(11):1213
[18]SAKAMAKI K,IMAI K,TOMII K,et al.Evolutionary analyses of caspase-8 and its paralogs:deep origins of the apoptotic signaling pathways[J].Bioessays,2015,37(7):767
[19]王爱珍,张振宇,张元明,等.地塞米松对脑缺氧缺血新生大鼠细胞凋亡抑制蛋白1 mRNA及Caspase-3活性的影响[J].实用儿科临床杂志,2007,22(12):923
[20]汤有才,贾国存,李丰益,等.铁剥夺诱导K562细胞凋亡与Caspase-3激活的实验研究[J].实用儿科临床杂志,2006,21(15):970
[21]WANG XD,KOU XX,MENG Z,et al.Estrogen aggravates lodoacetate-induced temporomandibular joint osteoarthritis[J].J Dent Res,2013,92(10):918
[22]LEE B,SUR B,PARK J,et al.Ginsenoside rg3 alleviates lipopolysaccharide-induced learning and memory impairments by anti-inflammatory activity in rats[J].Biomol Ther (Seoul),2013,21(5):381
[23]SPEARS R,OAKES R,BELLINGER LL,et al.Tumour necrosis factor-alpha and apoptosis in the rat temporomandibular joint[J].Arch Oral Biol,2003,48(12):825
(2016-01-20收稿 责任编辑李沛寰)
Expressions of TNF-α and Caspase-3 in damaged temporomandibular joint tissue induced by chronic unpredicted mild stress in rats
DONGJing1,2),LITing1),SONGWenting1),CAIWenyan1),WANGChao1),SUNJinhu1,2)
1)SchoolofStomatology,XuzhouMedicalUniversity,Xuzhou221004 2)DepartmentofStomatology,theAffiliatedHospital,XuzhouMedicalUniversity,Xuzhou221004
chronic unpredicted mild stress;temporomandibular joint;apoptosis;TNF-α;Caspase-3;rat
Aim: To observe the structure changes and possible mechanism of the temporomandibular joint(TMJ)condylar cartilage damage induced by chronic unpredicted mild stress(CUMS) in rats. Methods: Totally 64 male SD rats aged 7-weeks were randomly allocated into 8 groups, which were blank control group(1,3,5,7 weeks) and psychological stress(PS) group(1,3,5,7 weeks),and the rats were treated by CUMS except those in blank control group. After corresponding weeks CUMS treatment, the body weight was measured and the HE staining was used to research the condylar morphology change, the immunohistochemical staining was applied to detect the expressions of TNF-α and Caspase-3 proteins in condylar.Results: The rats inPS group grew slowly in weight, which showed significant differences from the fifth week(P<0.01). Besides, edema and releases of collagen fiber in the condylar surface were observed. The most serious damage of condylar surface was formed in the 3rd week in the PS group, characterized by loosen collagen fiber, and fracture of cracks. In the 5th week, the damage of condylar surface in PS group was alleviated, but the layers of cells was slightly disordered. In the 7th week, the cells in condylar decreased significantly, appearing the blank area without cells. At the same time, the immunohistochemical staining showed the higher expression of TNF-α and Caspase-3 in the PS group than those in the blank control group(P<0.05).Conclusion: CUMS can lead to changes in body weight and structure of TMJ, by up-regulating the expression of TNF-α and Caspase-3 in condylar cartilage of TMJ and induce cell apoptosis.
10.13705/j.issn.1671-6825.2016.06.015
*江苏省高校“青蓝工程”中青年学术带头人项目 2014年;徐州市推动科技创新后补助备案项目 KC14SH114;徐州医学院优秀人才科研基金项目资助 2014年
R782.6

