循环miRNA用于乳腺癌早期诊断的meta分析*
杜红梅,张玉超,李 静,邢金芳,荣守华,田 远,李君芳,马啸天,贾莉婷
郑州大学第三附属医院检验科 郑州 450052
循环miRNA用于乳腺癌早期诊断的meta分析*
杜红梅,张玉超,李 静,邢金芳,荣守华,田 远,李君芳,马啸天,贾莉婷#
郑州大学第三附属医院检验科 郑州 450052
#通信作者,女,1958年11月生,本科,教授,主任技师,研究方向:临床免疫学,E-mail:jialt@163.com
循环miRNA;乳腺癌;meta分析
目的:评价循环miRNA在乳腺癌早期诊断的作用,为推广循环miRNA在临床的广泛应用提供依据。方法:计算机检索Pubmed、Embase、Medline、中国知网、万方数据库等数据库中2008年1月至2015年5月关于循环miRNA用于乳腺癌早期诊断的临床研究。根据纳入和排除标准,将最终纳入文献归类整理,提取原始有效数据后进行汇总,利用Med-Disc 1.4进行meta分析。结果:共纳入20篇相关临床研究,24个独立的病例对照研究,其中包含乳腺癌患者2 030例,健康对照组1 318例。各研究之间存在显著异质性,采用随机效应模型合并灵敏度、特异度分析。循环miRNA用于早期诊断乳腺癌的合并灵敏度、特异度、阳性似然比、阴性似然比、诊断优势比、曲线下面积(AUC)及其95%CI分别为0.79(0.78~0.81)、0.81(0.88~0.83)、5.06(3.55~7.22)、0.21(0.16~0.27)、29.80(16.74~53.02)、0.907 5。亚组分析表明,以血清为标本检测循环miRNA,诊断优势比较以血浆为标本高54.9%;联合检测循环miRNA较检测单个miRNA的诊断优势比高42.5%。结论:循环miRNA可以作为肿瘤标志物用于乳腺癌的早期诊断,以血清为标本,联合检测循环miRNA具有更强的检验功效。
乳腺癌是最常见导致女性病死的恶性肿瘤之一[1]。对乳腺癌患者进行早期筛选至关重要。现有检查手段各有利弊[2]。利用血清学检测筛选乳腺癌具有简单、方便、价格低廉的优势,是临床常用的乳腺癌筛选手段,但是此类指标灵敏度低、特异性弱。因此发现新的高灵敏度、高特异性的血清学筛查指标具有重要临床意义。miRNAs是一组长度为20~24个核苷酸的序列,主要通过结合目的基因的3’非编码区(3’UTR),抑制下游基因的转录[3]。Mitchell等[4]首次证实了血清miRNA可以用于肿瘤检测,并证明miR-141是前列腺癌特异性miRNA。近来已有大量文献报道血清或血浆中miRNA(循环miRNA)表达谱与乳腺癌的相关性,表明循环miRNA可作为肿瘤标志物用于乳腺癌的早期筛查,且灵敏度高、特异性强。尽管如此,各研究之间存在miRNA谱不同、检测方法不用、样本数量不同、实验设计不同等差异,这些差异阻碍了循环miRNA在临床的应用。该研究利用meta分析汇合相关实验数据,对循环miRNA在早期诊断乳腺癌的作用进行系统评价,为乳腺癌的早期诊断提供依据。
1 资料与方法
1.1 文献检索 在中国知网、万方数据库检索策略:“乳腺癌”或“乳腺肿瘤”和“血清miRNA”或“血浆miRNA”或“循环miRNA”和“诊断”;在PubMed、Embase、Medline等数据库检索:“breast cancer”或“breast tumor”或“breast neoplasm”和“serummiRNA”或“plasma miRNA”或“circulating miRNA”和“diagnosis”。检索时间为2008年1月至2015年5月。
1.2 纳入排除标准 纳入标准: ①检测对象为血清miRNA、血浆miRNA、循环miRNA。②研究对象为临床确诊的乳腺癌患者和健康对照。③文献中提到miRNA用于诊断乳腺癌。可提取到样本数量、灵敏度、特异度、真阳性(TP)、假阳性(FP)、真阴性(TN)和假阴性(FN)等数据。④文献能获取全文,文献语言为中文或英语。排除标准: ①文献类型为综述、meta分析。②检索到的重复的文献。③检测对象为组织中或其他体液中miNRA。④低质量文献。
1.3 文献筛选、资料提取及质量评价 由两名工作人员分别根据既定检索策略以及纳入、排除标准,筛选相关文献。另两名工作人员分别提取相关数据,包括灵敏度、特异性、TP、FP、TN、FN、曲线下面积(AUC)、样本数量、病例以及健康对照年龄等,如遇分歧讨论解决。对最终纳入meta分析的文献进行质量评价,评价工具为QUADAS-2[5]。评价指标包括偏倚风险,适用性评估等。文献报道两个独立病例对照研究的,按两个单独实验处理。
1.4 统计学处理 利用Revman 5.3对文献质量进行评价和数据提取,利用Meta-Disc 1.4 对数据进行meta分析和异质性分析。如纳入分析的文献存在显著异质性,采用随机效应模型合并灵敏度、特异度。计算合并灵敏度、特异度、阳性似然比、阴性似然比、诊断优势比,绘制ROC曲线并计算AUC,根据AUC、诊断优势比判断miRNA用于诊断乳腺癌的价值。利用Stata 12.0软件和Deeks’漏斗图评估发表偏倚。
2 结果
2.1 文献检索结果 检索流程见图1。最终共纳入文献20篇[6-25],病例对照研究24个,研究对象包括乳腺癌患者2 030例,健康对照1 318例。
2.2 纳入文献基本特征及质量评价 20篇文献基
本特征见表1。文献质量评价工具为QUADAS-2,该评价工具把纳入文献的病例选择、检测指标、参考标准、检测流程等按偏倚风险等级分为高、低、不清楚,按实用性关注程度分为高、低、不清楚。
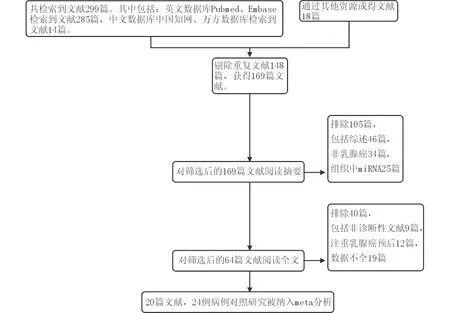
图1 meta分析文献检索流程图表1 纳入meta分析的文献特征汇总
2.3 meta分析结果
2.3.1 合并灵敏度及特异度分析 各研究之间灵敏度I2=91.5%,特异度I2=89.9%,诊断优势比I2=91.4%,存在显著异质性,因此采用随机效应模型合并灵敏度、特异度。合并灵敏度(95%CI)0.79(0.78~0.81),合并特异度(95%CI)为0.81(0.88~0.83),诊断优势比(95%CI)为29.80(16.74~53.02),阳性似然比(95%CI)为5.06(3.55~7.22),阴性似然比(95%CI)为0.21(0.16~0.27),AUC为0.907 5。与Liu等[26]和Cui等[27]完成的meta分析结果相近,表明循环miRNA对于早期诊断乳腺癌有较强的功效(图2)。
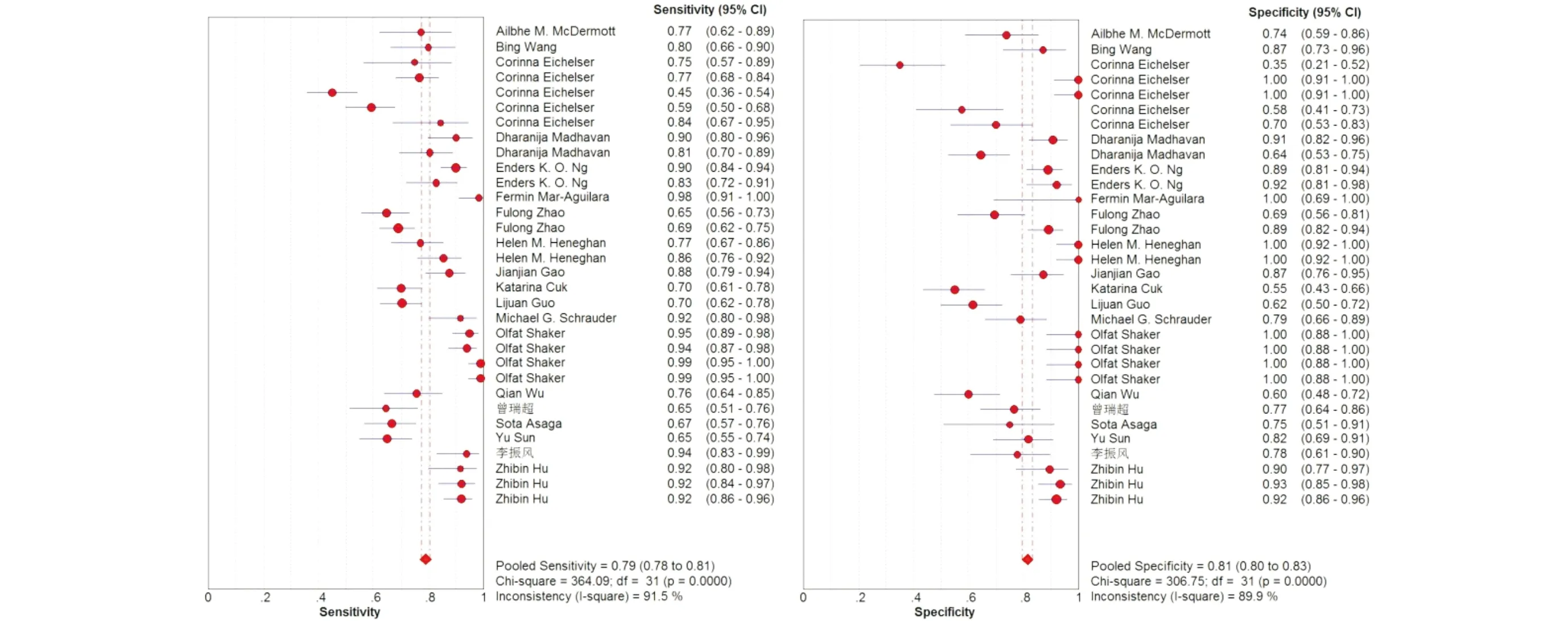
图2 循环miRNA用于诊断乳腺癌的合并灵敏度和特异度的meta分析
2.3.2 亚组分析 考虑到种族、检测miRNA个数、标本类型等为异质性存在的可能原因。亚组分析表明,以血清为标本检测循环miRNA,DOR较以血浆为标高54.9%;联合检测循环miRNA较检测单个miRNA的DOR高42.5%(表2)。
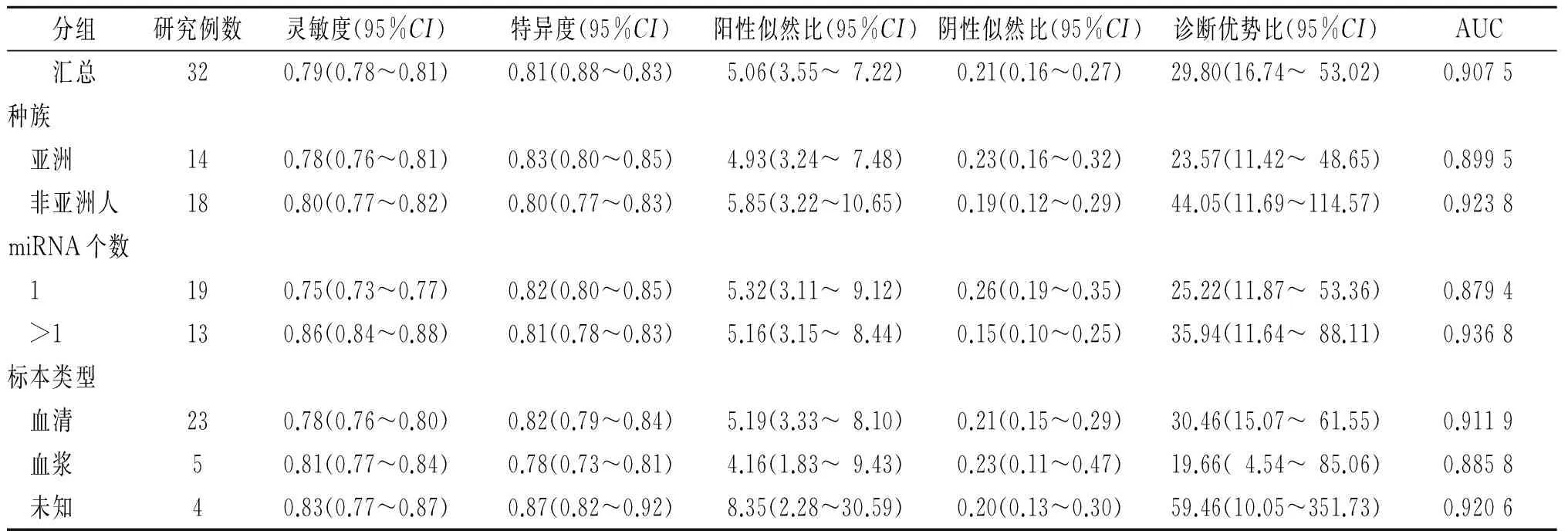
表2 循环miRNA诊断乳腺癌meta分析结果
2.4 发表偏倚分析 漏斗图斜率系数P值为0.20,表明不存在发表偏倚,结果见图3。
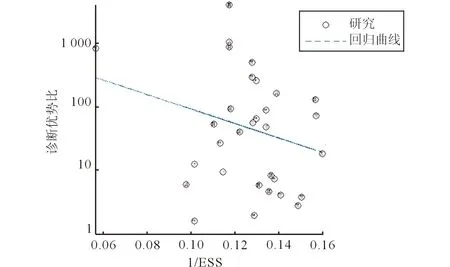
图3 所纳入20篇文献Deeks’漏斗图分析
3 讨论
在中国,女性乳腺癌发病率和病死率在全球处于比较低的水平,但是病死率呈持续上升趋势。据IARC预计,在2030年我国女性乳腺癌发病数可达到23.4万例,因乳腺癌死亡7.0万例。对乳腺癌进行早期诊断可使患者得到即使处理,提高患者5 a生存率,降低乳腺癌病死率,明显改善患者生存质量。张建新等[28]总结乳腺癌早期诊断的技术主要有乳腺X线钼靶摄影、超声检查、核磁共振成像技术、核素显像检查、乳头溢液检查、分子生物学检查和组织病理学诊断。上述诊断技术适用于对疑似病例的确诊,但是考虑到放射性、高成本,并不是十分理想的早期诊断方法。血清学标志物如糖类抗原CA153,癌胚抗原(CEA)等,虽然具有无创、无放射性且价格低廉的特点,但是此方法灵敏度和特异度均较低,不适用于乳腺癌的早期诊断[21]。腰利云等[29]完成的联合检测肿瘤标志物对乳腺癌诊断价值的meta分析表明,在早期诊断乳腺癌时,应将血清肿瘤标志物CA153、CA125、CEA与传统的影像学检测和组织细胞病理检查结果综合分析判断。
已有文献[4]报道,miRNA可以稳定存在于组织和血液中,可以耐受极限条件而不被降解,是miRNA作为循环标志物的重要条件之一。该meta分析共纳入20篇文献,经分析发现,循环miRNA在早期诊断乳腺癌时,合并后灵敏度和特异度分别达到0.79(95%CI为0.78~0.81)和0.81(95%CI为0.88~0.83),合并后诊断优势比和AUC分别为29.80(95%CI为16.74~53.02)和0.907 5,与单独检测CA153相比显示出较强的诊断能力。有研究[29]发现合并后DOR和AUC均低于CA153、CA153和CEA联合检测的结果,这可能与纳入文献的不同、检测指标不同、检测方法不同等有关。
检索时间为2008年1月至2015年5月,主要原因是Mitchell等[4]最早提出利用血液miRNA辅助诊断前列腺癌,这是循环miRNA用于辅助癌症诊断最早的研究,该研究发表时间为2008年7月,因此关于循环miRNA用于乳腺癌的诊断的研究应该是发表在2008年以后的。
作者在meta分析同时进行了亚组分析,结果表明,以血清(AUC 0.911 9)为检测标本,联合检测循环miRNA(AUC 0.879 4),在非亚洲人群(AUC 0.899 5)乳腺癌的早期诊断中发挥更为强效的作用。同时从NLR结果可以看出,上述三组前者在从阴性结果中排除乳腺癌患者中更有优势。
该meta分析的不足之处如下:①纳入分析的20篇文献中,有24份病例对照研究,40多种循环miRNA,尚未有公认的循环miRNA用于乳腺癌早期诊断。②可能会未检索到未发表论文、学术会议和书籍等,导致数据的丢失。③阈值效应的存在。
总之,作者发现循环miRNA在乳腺癌的早期诊断中显示了巨大的优势,此方法不仅灵敏度高、特异性强,而且具有无创、无放射风险,具有临床推广的必要。但是考虑到本meta分析的不足之处以及现阶段循环miRNA检测的缺陷,今后研究者有必要发现新的定量检测循环miRNA简便方法,同时临床仍需进行高质量的病例对照研究,以推广循环miRNA在早期诊断乳腺癌中的作用。
[1]SIEGEL R,MA JM,ZOU ZH,et al.Cancer Statistics, 2014[J].CA Cancer J Clin,2014,64(1):9
[2]SMITH RA,MANASSARAM-BAPTISTE D,BROOKS D,et al.Cancer screening in the United States, 2014: a review of current American Cancer Society guidelines and current issues in cancer screening[J].CA Cancer J Clin,2014,64(1):30
[3]ZHU J,ZHENG Z,WANG J,et al.Different miRNA expression profiles between human breast cancer tumors and serum[J].Front Genet,2014,5:149
[4]MITCHELL PS,PARKIN RK,KROH EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci U S A,2008,105(30):10513
[5]WHITING PF,RUTJES AW,WESTWOOD ME,et al.QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J].Ann Intern Med,2011,155(8):529
[6]WU Q,WANG C,LU Z,et al.Analysis of serum genome-wide microRNAs for breast cancer detection[J].Clin Chim Acta,2012,413(13/14):1058
[7]SHAKER O,MAHER M,NASSAR Y,et al.Role of microRNAs -29b-2, -155, -197 and -205 as diagnostic biomarkers in serum of breast cancer females[J].Gene,2015,560(1):77
[8]ASAGA S,KUO C,NGUYEN T,et al.Direct serum assay for microRNA-21 concentrations in early and advanced breast cancer[J].Clin Chem,2011,57(1):84
[9]HENEGHAN HM,MILLER N,LOWERY AJ,et al.Circulating microRNAs as novel minimally invasive biomarkers for breast cancer[J].Ann Surg,2010,251(3):499
[10]EICHELSER C,FLESCH-JANYS D,CHANG-CLAUDE J,et al.Deregulated serum concentrations of circulating cell-free microRNAs miR-17, miR-34a, miR-155, and miR-373 in human breast cancer development and progression[J].Clin Chem,2013,59(10):1489
[11]CUK K,ZUCKNICK M,HEIL J,et al.Circulating microRNAs in plasma as early detection markers for breast cancer[J].Int J Cancer,2013,132(7):1602
[12]WANG B,ZHANG QY.The expression and clinical significance of circulating microRNA-21 in serum of five solid tumors[J].J Cancer Res Clin Oncol,2012,138(10):1659
[13]ZHAO FL,DOU YC,WANG XF,et al.Serum microRNA-195 is down-regulated in breast cancer: a potential marker for the diagnosis of breast cancer[J].Mol Biol Rep,2014,41(9):5913
[14]HU Z,DONG J,WANG LE,et al.Serum microRNA profiling and breast cancer risk: the use of miR-484/191 as endogenous controls[J].Carcinogenesis,2012,33(4):828
[15]MADHAVAN D,ZUCKNICK M,WALLWIENER M,et al.Circulating miRNAs as surrogate markers for circulating tumor cells and prognostic markers in metastatic breast cancer[J].Clin Cancer Res,2012,18(21):5972
[16]ZHAO FL,HU GD,WANG XF,et al.Serum overexpression of microRNA-10b in patients with bone metastatic primary breast cancer[J].J Int Med Res,2012,40(3):859
[17]SCHRAUDER MG,STRICK R,SCHULZ-WENDTLAND R,et al.Circulating micro-RNAs as potential blood-based markers for early stage breast cancer detection[J].PLoS One,2012,7(1):e29770
[18]NG EK,LI R,SHIN VY,et al.Circulating microRNAs as specific biomarkers for breast cancer detection[J].PLoS One,2013,8(1):e53141
[19]MCDERMOTT AM,MILLER N,WALL D,et al.Identification and validation of oncologic miRNA biomarkers for luminal A-like breast cancer[J].PLoS One,2014,9(1):e87032
[20]李振凤.血浆miRNA在乳腺癌诊断中的价值[D].青岛:青岛大学,2013.
[21]GAO J,ZHANG Q,XU J,et al.Clinical significance of serum miR-21 in breast cancer compared with CA153 and CEA[J].Chin J Cancer Res,2013,25(6):743
[22]MAR-AGUILAR F,MENDOZA-RAMIREZ JA,MALAGON-SANTIAGO I,et al.Serum circulating microRNA profiling for identification of potential breast cancer biomarkers[J].Dis Markers,2013,34(3):163
[23]SUN Y,WANG M,LIN G,et al.Serum microRNA-155 as a potential biomarker to track disease in breast cancer[J].PLoS One,2012,7(10):e47003
[24]GUO LJ,ZHANG QY.Decreased serum miR-181a is a potential new tool for breast cancer screening[J].Int J Mol Med,2012,30(3):680
[25]曾瑞超.血浆MicroRNA-30a在乳腺癌诊断中的价值[D].温州:温州医学院,2013.
[26]LIU L,WANG S,CAO X,et al.Analysis of circulating microRNA biomarkers for breast cancer detection: a meta-analysis[J].Tumour Biol,2014,35(12):12245
[27]CUI Z,LIN D,SONG W,et al.Diagnostic value of circulating microRNAs as biomarkers for breast cancer: a meta-analysis study[J].Tumour Biol,2015,36(2):829
[28]张建新,梁庆模.乳腺癌早期诊断的研究进展[J].中国临床研究,2011,24(10):951
[29]腰利云,施根林.联合检测CA153,CA125和CEA对乳腺癌诊断价值的Meta分析[J].中国循证医学杂志,2015(1):54
(2016-01-30收稿 责任编辑李沛寰)
Meta analysis of role of circulating miRNA in early diagnosis of breast cancer
DUHongmei,ZHANGYuchao,LIJing,XINGJinfang,RONGShouhua,TIANYuan,LIJunfang,MAXiaotian,JIALiting
ClinicalLaboratory,theThirdAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
circulating miRNA;breast cancer;meta analysis
Aim: To evaluate the role of circulating miRNA in the early diagnosis of breast cancer, and provide basis for its extensively clinical application. Methods: We got retrieval paper through the Pubmed, Medline, Embase, CNKI et al,and the interval time of retrieval paper was from May 2008 to Jun 2015. According to the inclusive and exclusive rules, papers were selected. Then we extracted original data from the included papers and performed meta-analysis by Med-Disc1.4. Results: Twenty papers with 24 clinical studies, which included 2 030 breast cancer patients and 1 318 health controls. The pooled sensitivity, specificity, positive likelihood ratio, negative likelihood ratio, diagnostic odds ratio and area under the curve were 0.79(95%CI0.78-0.81),0.81(95%CI0.880-0.83),5.06(95%CI3.55-7.22),0.21(95%CI0.16-0.27),29.80(95%CI16.74-53.02),0.907 5, respectively. By subgroup analysis, we found that DOR was 54.9% higher than plasma sample when detecting circulating miRNA via serum sample; Single circulating miRNA yielded a 42.5% lower DOR than multiple circulating miRNA did.Conclusion: Circulating miRNA would be a better tumor biomarker for early diagnosis of breast cancer.Serum sample and multiple miRNA detection yield a better diagnostic performance.
10.13705/j.issn.1671-6825.2016.06.016
*河南省卫生厅科技攻关项目 201203050;河南省教育厅科学技术研究重点项目 14A320036;河南省计划生育科学技术研究计划 2012;2013
R737
发表年份国家种族样本量病例对照中位年龄病例对照miRNA谱样本类型检测方法McdermottAM2014爱尔兰高加索人444659.8644.21miR-29a,-181a,-656不明确RT-PCRWangB2012中国亚洲人50395353miR-21血清RT-PCREichelserC2013德国高加索人120406565miR-34a,-93,-373血清RT-PCR32406565miR-17,-155血清RT-PCRMadhavanD2012德国高加索人6176未知未知miR-14,-200a,-200b,-200c,-203,-210,-375,-801血清RT-PCR7276未知未知miR-200c,-210,-801血清RT-PCRNgEK2013中国亚洲人1701006061miR-145,-451血浆RT-PCR70506061miR-145,-451血浆RT-PCRMar-AguilarF2013墨西哥高加索人6110未知未知miR-10b,-21,-125b,-145,-155,-191,-382血清RT-PCRZhaoFL2012中国亚洲人122595250miR-10b血清RT-PCRZhaoFL2014中国亚洲人20110250.6046.32miR-195血清RT-PCRHeneghanHM2010爱尔兰高加索人8344未知未知miR-195,let-7a不明确RT-PCRGaoJ2013中国亚洲人895550.3850.38miR-181a血清RT-PCRCukK2013德国高加索人127805555miR-148b,-409-3p,-801血清RT-PCRGuoLJ2012中国亚洲人152755650miR-181a血清RT-PCRSchrauderMG2012德国高加索人485761.961.9240miRNAs不明确RT-PCRShakerO2015埃及阿拉伯人10030未知未知miR-29b-2,-155,-197,-205血清RT-PCRWuQ2012中国亚洲人50505553miR-103,-23a,-29a,-222,-23b,-24,-25,-BS1血清RT-PCR曾瑞超2014中国亚洲人6264未知未知miR-30a血浆RT-PCRAsagaS2010美国高加索人4010未知未知miR-21血清RT-PCR-DSSunY2012中国亚洲人103555351miR-155血清RT-PCR李振风2013中国亚洲人49365252miR-21,-195,-222,-205血浆RT-PCRHuZ2012中国亚洲人4848未知未知miR-16,-25,-222,-324-3p血清RT-PCR7676未知未知miR-16,-25,-222,-324-3p血清RT-PCR