不同碳源促进污染水体氮素转化的微生态过程
赵佩文,王 新,吴逸飞,姚晓红,柳 永,孙 宏,葛向阳,汤江武,*
(1.华中农业大学 生命科学与技术学院,湖北 武汉 430070; 2.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
不同碳源促进污染水体氮素转化的微生态过程
赵佩文1,2,王 新2,吴逸飞2,姚晓红2,柳 永2,孙 宏2,葛向阳1,汤江武2,*
(1.华中农业大学 生命科学与技术学院,湖北 武汉 430070; 2.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
在试验条件下,向氮污染河道水体中C/N按15∶1补加甲醇、乙醇、乙酸钠、柠檬酸钠、葡萄糖、蔗糖、麦芽糖、羧甲基纤维素钠,检测水体氨氮、亚硝酸盐、硝酸盐、总氮的变化,以及在此过程中水体细菌胞外酶活性、细菌群落结构的变化。结果显示,除甲醇、羧甲基纤维素钠外,补加有机碳源显著降低了水体氨氮的含量,水体β-葡萄糖苷酶活性在碳源补加后快速增加,补加葡萄糖、蔗糖、麦芽糖的水体中细菌群落结构明显异于其他处理,表明添加有机碳源可显著加快污染水体中氮素的转化,水体微生物在此过程中起到关键作用。水体细菌群落结构和代谢活性对不同类型有机碳源有着不同的响应,因而添加不同有机碳源对水体氮素转化具有不同的促进作用。
有机碳源;污染水体;细菌群落;PCR-DGGE;细菌代谢活性
随着我国工业化进程的加快和现代农业的发展,水环境污染加剧,对污染水体的修复和治理也成为相关研究的重要领域。生物修复技术具有环境友好、生态节能的优点,是最具发展前景的水体原位修复技术,水体污染物的转化、降解主要依赖微生物的作用,然而对于氮素污染水体而言,有机碳源的缺乏是水体氮素转化、去除的主要限制性因素[1-4]。不同有机碳源用于污染水体的氮素去除在成本、环境效应上具有显著的差异,不少研究人员开展了筛选适合不同水体环境修复有机碳源的研究,取得了较好的效果[5-9]。微生物对不同有机碳源有着不同的生态效应,补加碳源后微生物类群、群落结构、代谢活性等的变化必将对微生物强化修复产生重要的影响,然而迄今为止对于这个微生态过程尚缺乏了解。为此,以氮污染河道水体为研究对象,初步探索不同种类有机碳源补加对水体氮素转化、去除的微生态过程的影响,旨在为污染水体微生物强化修复技术的优化、应用提供有益参考。
1 材料与方法
1.1 供试水样及试验方法
试验用水样采集自杭州市城郊河道,采样时水体温度26.3℃,pH值7.38,溶解氧含量2.37mg·L-1,水体氨氮含量8.20mg·L-1,总氮含量8.49mg·L-1,CODMn23.0mg·L-1,总磷0.33mg·L-1,TOC 7.24mg·L-1。水样分装在编号1—9的试验水槽中,每个水槽装入水量约200L。以试验水样中氨氮含量为基准,以15∶1的C/N将甲醇、乙醇、乙酸钠、柠檬酸钠、葡萄糖、蔗糖、麦芽糖、羧甲基纤维素钠(CMC-Na)等分别加入1—8号水槽中,各种试剂的总添加量依次为:甲醇 55.3mL,乙醇40.0mL,乙酸钠 56.2g,柠檬酸钠67.0g,葡萄糖45.1g,蔗糖 39.0g,麦芽糖41.0g,CMC-Na 41.4g,以9号作为空白对照,试验环境温度设置为24℃。河道中采集水样的水质和微生物指标为各试验槽的起始值,水样的采集时间分别为12、24、48h。
1.2 β-葡萄糖苷酶活性的测定
水体中β-葡萄糖苷酶活性的测定采用荧光模拟底物法(fluorogenic model substrates,FMS),参照文献[10-11]改进后的测定方法进行。每个样品均测定3个平行样,以平均值表示该水样中β-葡萄糖苷酶的活性。
1.3 细菌群落结构分析
1.3.1 水样细菌总DNA的提取
采集50mL水样,用0.22μm微孔滤膜过滤收集菌体,滤膜用铝箔包裹,液氮速冻后存于-20℃冰箱备测。提取DNA时,将收集了大量菌体的滤膜剪成碎片,然后采用MOBIO PowerWater®DNA Isolation Kit,参照试剂盒附带的操作步骤,提取样品中的DNA,获得的DNA用Nanodrop 2000检测后,存于-20℃冰箱备用。
1.3.2 基因片段的PCR扩增和DGGE分析
用于DGGE分析的片段为细菌16S rDNA V3区片段,所用引物为连有GC夹子的细菌341F和517R[12],参考文献[10-11]采用的方法,进行16S rDNA V3区片段的扩增和DGGE分析。所用的聚丙烯酰胺凝胶浓度为8%,变性梯度40%~60%。电泳完成后,PAGE胶用EB染色并用天能凝胶成像系统获取DGGE图谱,经Quantity One-1-D软件进行数字化分析后,用Matlab软件进行矩阵和主成分分析。
1.3.3 主要细菌种类的测序分析
对DGGE凝胶中的主要条带进行切胶、PCR回收、克隆转化,获得载有16S rDNA V3区基因片段的阳性克隆,每个条带获得的阳性克隆随机挑选3个进行测序分析。获得的序列结果在GenBank中进行BLAST分析,选取相似序列,用MEGA 4.1软件进行比对后,以Neighbor-Joining法构建主要细菌种类的系统发育树。
1.4 分析方法
水样中氨氮、亚硝酸盐、硝酸盐、总氮含量的测定,均采用对应国家标准进行,分别为HJ 536—2009、HJ/T 197—2005、HJ/T 346—2007、HJ 636—2012。水样中TOC的测定采用耶拿N/C 3100型总有机碳测定仪,参照仪器提供的方法进行测定,均测定3个平行。
1.5 数据统计分析
采用SPSS 13.0软件进行单因素方差分析(one way ANOVA),对有显著差异的各处理采用Tukey法进行多重比较。
2 结果与分析
2.1 水体总有机碳和氮素含量的变化
有机碳源的加入,使得试验水体的总有机碳含量与对照组相比增加了15倍左右。在水体土著微生物的作用下,随时间延长,总有机碳含量逐渐降低,其中,添加CMC-Na的试验水体中,微生物对总有机碳利用能力较差(图1)。
添加有机碳源后,各处理的水体氨氮、亚硝酸盐、硝酸盐、总氮均发生了变化。不同有机碳源对氨氮的变化有着不同的影响,相较于对照组,除了添加甲醇、CMC-Na的试验水体外,氨氮含量在有机碳源添加之后均呈显著下降趋势,但降至一定值之后呈平稳趋势。添加葡萄糖、蔗糖和麦芽糖的试验水体中,氨氮含量在12h后迅速从8.2mg·L-1降低至3.2mg·L-1以下,去除率超过60%,显著优于添加其他碳源的试验水体(图1)。和氨氮含量的变化趋势相反,各试验水体中亚硝酸盐的含量在添加有机碳源12h后迅速升到高点,然后呈下降趋势(图1)。添加不同种类碳源对水体硝酸盐含量变化的影响不同,添加乙酸钠、葡萄糖、麦芽糖处理的水体中硝酸盐的含量在12h内显著升高,在12—24h呈下降趋势,但在24h后与添加其他各类碳源的处理一样呈升高趋势(图1)。相较于对照组,添加有机碳源的各试验水体中总氮含量均呈显著的下降趋势,其中,加入乙酸钠、柠檬酸钠、葡萄糖、蔗糖的水体中48h后总氮去除率为19.0%~21.3%,显著高于其他处理(图1)。

图1 添加有机碳源后试验水体中总有机碳、氨氮、亚硝酸盐、硝酸盐、总氮含量的变化Fig.1 Variation of total organic carbon,ammonia,nitrite,nitrate,total nitrogen in experimental waters after addition of different organic carbon
2.2 水体β-葡萄糖苷酶活性的变化
β-葡萄糖苷酶是水体细菌转化、利用碳源的关键胞外酶,是细菌生态活性和功能的重要指标。试验水体中添加柠檬酸钠、葡萄糖、蔗糖之后,β-葡萄糖苷酶活性相较于对照组显著上升,添加其他碳源的水体中的β-葡萄糖苷酶活性在12h之后开始显著上升,在24h达到高点后开始下降,其中添加柠檬酸钠的水体中β-葡萄糖苷酶活性在24h最高,达2.73μmol·L-1·h-1。上述结果表明,补加的有机碳源对水体中细菌活性有明显的促进作用,其中,尤以添加柠檬酸钠、葡萄糖、蔗糖对水体β-葡萄糖苷酶活性的促进效果为好(图2)。
2.3 水体细菌群落结构的变化
应用PCR-DGGE技术分析添加有机碳源后水体细菌群落结构的变化,图3泳道中的不同条带表示不同种细菌OTU,条带亮度的变化可一定程度反映出不同细菌OTU的量的变化。可以看出,从添加碳源后12h开始,细菌群落即发生变化。主成分分析结果在二维图中客观显示了细菌群落结构的变化,添加葡萄糖、蔗糖、麦芽糖显著影响水体细菌群落结构,与其他处理差异明显。外源有机碳源加入一段时间之后,水体中细菌群落处于相对稳定的状态(图4)。对DGGE图谱中的主要条带进行切胶回收、克隆、测序,通过系统发育分析显示试验水体中细菌的主要种类和多样性(图5),代表不同细菌OTU的条带在不同采样时间的变化,是不同种类细菌对水体环境条件,尤其是碳源加入响应的结果。
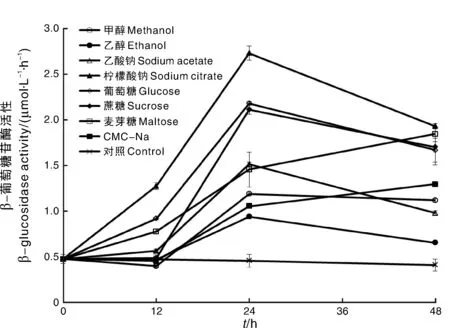
图2 添加有机碳源后试验水体中葡萄糖苷酶活性的变化Fig.2 Variation of β-D-glucosidase activity in experimental waters after addition of different organic carbon
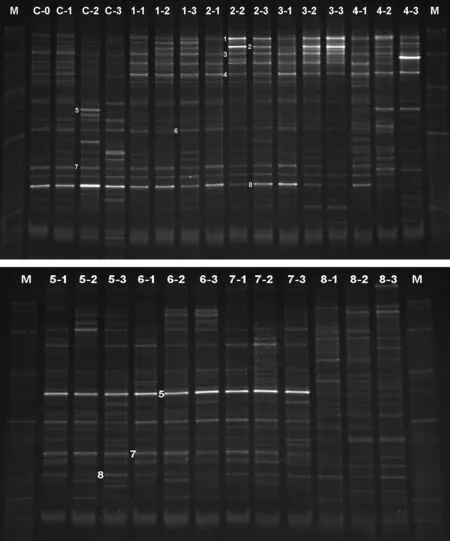
C为对照,泳道上方数字1—8代表添加碳源分别为甲醇、乙醇、乙酸钠、柠檬酸钠、葡萄糖、蔗糖、麦芽糖和CMC-Na;泳道标记的连字符后数字1、2、3分别代表12、24、48h取样。C-0为初始对照。图4同。C,Control; 1-8in front of each line represented methanol,ethanol,sodium acetate,sodium citrate,glucose,sucrose,maltose,and CMC-Na,respectively.The number 1,2,3followed by “-” represented sample time of 12,24,48h.C-0were initial samples of control.The same as in Fig.4
通过分析发现,尚未能培养的一株γ-proteobacterium细菌(图3中Band 5)对葡萄糖、果糖、麦芽糖较为敏感,该菌在添加葡萄糖、果糖、麦芽糖48h后在细菌群落中的丰富度分别为28.5%、39.1%和42.0%。分别属于Flavobacterium (图3中Band 1)、Acinetobacter(图3中Band 2、Band 4)的细菌则可能对醇类和有机酸盐类比较敏感,属于Flavobacterium(图3中Band 1)的细菌在添加乙醇和乙酸钠48h后在细菌群落中的丰富度分别为30.4%和29.9%。

图4 添加有机碳源后水体中细菌群落结构变化的PCA分析结果Fig.4 PCA of bacterial community structure based on DGGE profiles
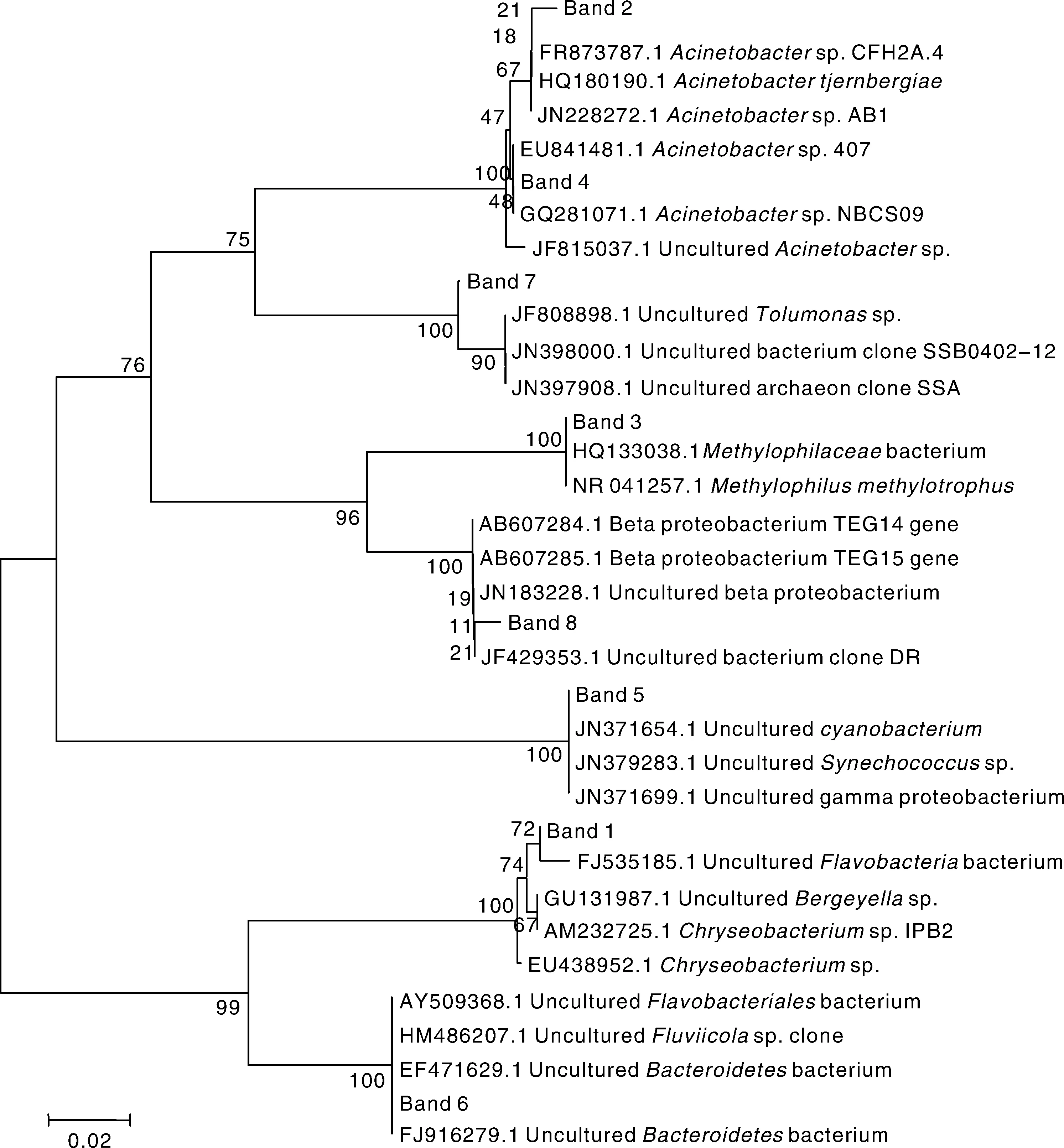
图5 试验水体中主要菌群的系统发育树Fig.5 Phylogenetic tree of main bacteria in experimental waters
3 讨论
长期以来,人类生产和生活产生的活性氮大量向水体释放,已经远远超出水体氮的生物地球化学循环的载荷,使地表水氮素累积,引起富营养化。氨氮是最易流失于水体的氮素,且由于氨氧化过程的限制,易于在水体积累,是影响水体水质的主要污染物。自然水体中氮的循环受限于氨氧化和反硝化两个过程,主要依赖微生物的作用[1,13]。由于氨氮在多数污染水体中的积累,使得水体C/N较低,严重影响微生物对水体氮素的利用和转化。因此,在水体生物修复体系中,添加有机碳源是一种重要的促进氮循环的方式。当前研究和应用中,常用于补充碳源的有碳含量较高的污水[3,14-15]、低分子碳水化合物[2,16-17]和天然有机质[6,9,18-19]等。本研究中选用的有机碳源是常见的低分子碳水化合物,添加有机碳源后可显著加快污染水体中氮素的转化,但不同种类的有机碳源影响氮素转化的效率不同,其中,添加葡萄糖、蔗糖和麦芽糖后,氨氮去除率超过60%,总氮去除率在19.0%~21.3%之间。以氮素转化的关键步骤——氨氮的变化为例,添加葡萄糖、蔗糖和麦芽糖对氨氮去除效果明显,尽管在氨氮含量降低的同时,亚硝酸盐含量升高,总氮含量降低,但从数量的变化来看,添加有机碳源后氨氮的转化中同化作用占主导地位。这表明水体中微生物对有机碳源利用的选择性是导致不同水体氮素含量变化差异的主要原因。
水环境中微生物对溶解有机物的转化、利用需要经过细菌胞外酶的作用,因而细菌胞外酶活性是水体细菌的活性和功能的重要指标,是一个重要的水环境生态参数[10-11]。由于环境中微生物的群体属性,细菌胞外酶活性的变化也是细菌群落结构和功能变化的外在表现。添加有机碳源之后,试验水体中的β-葡萄糖苷酶活性快速升高,意味着微生物活性快速升高,24h后随着可利用碳源的消耗,β-葡萄糖苷酶活性逐渐降低。水体中氮素变化的过程与β-葡萄糖苷酶活性的变化也有着一定的对应关系,这也可以进一步证实,添加的有机碳源促进了水体中微生物的变化,进而影响水体氮素的变化。
水体微生物在氮素转化过程中起到关键作用,其功能变化与群落结构的变化是相适应的。有机碳源的添加是一个改变水体微生物群落结构和功能的关键因素,进而引发不同的生态效应。本研究结果表明,葡萄糖、蔗糖、麦芽糖对水体中细菌群落结构的影响与其他有机碳源有明显差异,这种差异可能是水体中微生物对不同类型有机碳源利用的选择性所致。DGGE图谱中不同的优势条带代表不同种对环境变化响应的优势细菌,如试验水体中尚未能培养的一株γ-proteobacterium细菌,对葡萄糖、果糖、麦芽糖较为敏感,而分别属于Flavobacterium、Acinetobacter的细菌则可能对醇类和有机酸盐类比较敏感,这些细菌在整个群落的结构和功能变化中起到重要作用。这表明,水体中可能存在许多尚未发现的选择性利用碳源的微生物,而这些微生物在一定的有利因素下具有较好的氮素转化、去除的作用。本研究中添加有机碳源影响水体氮素转化和细菌群落变化的过程,事实上就是碳源促进某类微生物生长,导致水体微生物群落结构和功能发生变化,从而快速转化氮素的过程。
[1] WU J,YAN G,ZHOU G,et al.Model predictive control of biological nitrogen removal via partial nitrification at low carbon/nitrogen (C/N) ratio[J].JournalofEnvironmentalChemicalEngineering,2014,2(4):1899-1906.
[2] SANTOS C E D,MOURA R B,DAMIANOVIC M H R Z,et al.Influence of COD/N ratio and carbon source on nitrogen removal in a structured-bed reactor subjected to recirculation and intermittent aeration (SBRRIA)[J].JournalofEnvironmentalManagement,2015,166:519-524.
[3] 刘刚,闻岳,周琪.人工湿地反硝化碳源补充研究进展[J].水处理技术,2010,36(4):1-5.
LIU G,WEN Y,ZHOU Q.Advance in enhancement of denitrification in the constructed wetlands using external carbon sources[J].TechnologyofWaterTreatment,2010,36(4): 1-5.(in Chinese with English abstract)
[4] KOCATURK I,ERGUDER T H.Influent COD/TAN ratio affects the carbon and nitrogen removal efficiency and stability of aerobic granules[J].EcologicalEngineering,2016,90:12-24.
[5] INGERSOLL T L,BAKER L A.Nitrate removal in wetland microcosms[J].WaterResearch,1998,32(3):677-684.
[6] 罗佳,韩士群,罗海荣,等.外加碳源对富营养化水体生物脱氮效果及细菌群落结构的影响[J].江苏农业学报,2012,28(6):1312-1317.
LUO J,HAN S Q,LUO H R,et al.Effect of exogenus carbon resource on biological denitrification and bacterial community structure of eutrophic waters[J].JiangsuJournalofAgriculturalSciences,2012,28(6): 1312-1317.(in Chinese with English abstract)
[7] 裴廷权,王波,刘欢.固体缓释碳源处理低碳氮比污水的脱氮及机理[J].环境工程学报,2014,8(6):2423-2428.
PEI T Q,WANG B,LIU H.Nitrogen removal and mechanism of low C/N wastewater processed by solid sustain-released carbon[J].ChineseJournalofEnvironmentalEngineering,2014,8(6): 2423-2428.(in Chinese with English abstract)
[8] 肖蕾,贺锋,黄丹萍,等.人工湿地反硝化外加碳源研究进展[J].水生态学杂志,2012,33(1):139-143.
XIAO L,HE F,HUANG D P,et al.Research advances of adding extra carbon sources to denitrification for constructed wetlands[J].JournalofHydroecology,2012,33(1): 139-143.(in Chinese with English abstract)
[9] 丁怡,王玮,王宇晖,等.不同进水碳氮比对水平潜流人工湿地脱氮效果的影响[J].工业水处理,2014,34(10):29-32.
DING Y,WANG W,WANG Y H,et al.Effects of C/N ratio of different kinds of influent on the nitrogen removing effectiveness in horizontal subsurface flow constructed wetland[J].IndustrialWaterTreatment,2014,34(10): 29-32.(in Chinese with English abstract)
[10] XIN W,LI Z,SU J,et al.Lysis of a red-tide causing alga,Alexandriumtamarense,caused by bacteria from its phycosphere[J].BiologicalControl,2010,52(2):123-130.
[11] 王新,李志江,郑天凌.海洋浮游细菌在东海赤潮高发区的分布与活性[J].环境科学,2010,31(2):287-295.
WANG X,LI Z J,ZHENG T L,et al.Distribution and activity of marine bacterioplankton at frequent HAB area of East China Sea[J].ChineseJournalofEnvironmentalScience,2010,31(2): 287-295.(in Chinese with English abstract)
[12] MUYZER G,WAAL E C D,UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied&EnvironmentalMicrobiology,1993,59(3):695-700.
[13] PROSSER J I.The ecology of nitrifying bacteria[M]// BOTHE H,FERGUSON S J,NEWTON W E.Biology of the nitrogen cycle.Amsterdam: Elsevier Publishers,2007: 407-427.
[14] MANDER Ü,MADDISON M,SOOSAAR K,et al.The impact of pulsing hydrology and fluctuating water table on greenhouse gas emissions from constructed wetlands[J].Wetlands,2011,31(6):1023-1032.
[15] VYMAZAL J,MASA M.Horizontal sub-surface flow constructed wetland with pulsing water level[J].WaterScience&Technology,2003,48(5):143-148.
[16] 赵联芳,朱伟,赵建.人工湿地处理低碳氮比污染河水时的脱氮机理[J].环境科学学报,2006,26(11):1821-1827.
ZHAO L F,ZHU W,ZHAO J.Nitrogen removal mechanism in constructed wetland used for treating polluted river water with lower ratio of carbon to nitrogen[J].ActaScientiaeCircumstantiae,2006,26(11): 1821-1827.(in Chinese with English abstract)
[17] RUSTIGE H,NOLDE E.Nitrogen elimination from landfill leachates using an extra carbon source in subsurface flow constructed wetlands[J].WaterScience&Technology,2007,56(3):125-133.
[18] HUME N P,FLEMING M S,HORNE A J.Plant carbohydrate limitation on nitrate reduction in wetland microcosms[J].WaterResearch,2002,36(3):577-584.
[19] BASTVIKEN S K,ERIKSSON P G,PREMROV A,et al.Potential denitrification in wetland sediments with different plant species detritus[J].EcologicalEngineering,2006,25(2):183-190.
(责任编辑 高 峻)
Microbial ecological process of nitrogen transformation accelerated by different organic carbon in polluted water
ZHAO Pei-wen1,2,WANG Xin2,WU Yi-fei2,YAO Xiao-hong2,LIU Yong2,SUN Hong2,GE Xiang-yang1,TANG Jiang-wu2,*
(1.CollegeofLifeScienceandTechnology,HuazhongAgriculturalUniversity,Wuhan430070,China; 2.InstituteofPlantProtectionandMicrobiology,ZhejiangAcademyofAgriculturalScience,Hangzhou310021,China)
In the present study,methanol,ethanol,sodium acetate,sodium citrate,glucose,sucrose,maltose,and CMC-Na was added in nitrogen-polluted urban river water with C/N of 15∶1.Variation of ammonia,nitrite,nitrate,total nitrogen were detected by national standard method,β-glucosidase activity were determined using the fluorogenic model substrates,and the change of bacterial community structure were analyzed by PCR-DGGE.It was shown that contents of ammonia decreased significantly after organic carbon sources addition except methanol or CMC-Na.Addition of organic carbon sources increased β-glucosidase activity.Bacterial community structure differed obviously with addition of glucose,sucrose and maltose.The results indicated that addition of organic carbon could accelerate transformation of nitrogen in the nitrogen-polluted water,in which microbes played key role.Bacterial community and metabolic activity had different responses to varied organic carbons,which would lead to different strength on nitrogen transformation acceleration.
organic carbon; polluted water; bacterial community; PCR-DGGE; bacterial metabolic activity
10.3969/j.issn.1004-1524.2016.11.17
2016-03-14
浙江省公益技术应用研究项目(2015C33046);浙江省重大科技专项重点社发项目(2015C03004);浙江省农科院创新提升工程项目;温州市水体污染控制与治理科技创新项目(S20140021)
赵佩文(1991—),女,湖北武汉人,硕士研究生,主要研究方向为微生物生态学。E-mail: 332726781@qq.com
*通信作者,汤江武,E-mail: tangjiangwu@sina.com
Q938.1
A
1004-1524(2016)11-1915-07
浙江农业学报ActaAgriculturaeZhejiangensis,2016,28(11): 1915-1921
http://www.zjnyxb.cn赵佩文,王新,吴逸飞,等.不同碳源促进污染水体氮素转化的微生态过程[J].浙江农业学报,2016,28(11): 1915-1921.

