泥鳅和大鳞副泥鳅细胞色素P450c17-Ⅰ(CYP17-Ⅰ)基因的克隆及组织表达分析
刘士力,张爱菊,练青平,吴卫君,贾永义,蒋文枰,李 飞
(1.浙江省淡水水产研究所 农业部淡水渔业健康养殖重点实验室/浙江省淡水水产遗传育种重点实验室,浙江 湖州313001; 2.上海海洋大学 水产与生命学院,上海201306; 3.庆元县水利局 水产技术推广站,浙江 庆元323800; 4.庆元县水电学会 水产分会,浙江 庆元323800)
泥鳅和大鳞副泥鳅细胞色素P450c17-Ⅰ(CYP17-Ⅰ)基因的克隆及组织表达分析
刘士力1,2,张爱菊1,练青平1,吴卫君3,4,*,贾永义1,蒋文枰1,李 飞1
(1.浙江省淡水水产研究所 农业部淡水渔业健康养殖重点实验室/浙江省淡水水产遗传育种重点实验室,浙江 湖州313001; 2.上海海洋大学 水产与生命学院,上海201306; 3.庆元县水利局 水产技术推广站,浙江 庆元323800; 4.庆元县水电学会 水产分会,浙江 庆元323800)
采用3′-和5′-RACE法克隆了泥鳅和大鳞副泥鳅CYP17-Ⅰ基因的cDNA全长序列,通过实时荧光定量PCR技术分析其表达情况。结果表明,泥鳅CYP17-Ⅰ基因cDNA全长1706bp,开放阅读框(open reading frame,ORF) 1563bp,编码520个氨基酸;大鳞副泥鳅CYP17-Ⅰ基因cDNA全长1763bp,ORF长1545bp,编码514个氨基酸。2种鳅CYP17-Ⅰ氨基酸序列都有1个信号肽、1个跨膜区、1个保守的蛋白结构域和3个功能保守区。相似度分析显示,2种鳅之间CYP17-Ⅰ相似度为99%,与其他鱼类的相似度也超过70%。系统进化分析显示,2种鳅之间关系最为接近,其系统发育关系基本符合传统的分类地位。qRT-PCR结果显示,CYP17-Ⅰ在2种鳅的肠、肌肉、心脏、胃、肝脏、精巢、卵巢、脾脏等8个组织均有表达,在精巢和卵巢中表达量相对较高。
细胞色素;泥鳅;大鳞副泥鳅;CYP17-Ⅰ
细胞色素P450c17(cytochrome P450c17,CYP17)是一种单一微粒体酶,属于CYP450家族,在类固醇激素(甾体激素)合成中起关键作用,具有17α-羟化酶、17,20-裂解酶等酶活性[1-3]。17α-羟化酶是孕激素及肾上腺糖皮质激素(皮质醇)合成中所必需的,17,20-裂解酶则是性腺类固醇激素(如雌激素和雄激素)合成中所必需的[1-6]。因此,CYP17的活性在繁殖生物学中非常重要,是类固醇生物合成不可或缺的重要酶类[1]。目前,CYP17基因在人和高等动物中研究较多,哺乳动物中只发现1种CYP17,鱼类中发现2种不同基因编码的CYP17,即CYP17-Ⅰ和CYP17-Ⅱ,前者具有17α-羟化酶和17,20-裂解酶活性,而后者只具有17α-羟化酶活性[3-4,7-9]。迄今为止,已成功克隆半滑舌鳎(Cynoglossussemilaevis)[1]、绿鳍马面鲀(Navodonseptentrionalis)[4]、青鳉(Oryziaslatipes)[7]、呆鲦鱼(Pimephalespromelas)[10]、斑马鱼(Daniorerio)[11]等多种鱼类的CYP17-Ⅰ基因。
泥鳅(Misgurnusanguillicaudatus)和大鳞副泥鳅(Paramisgurnusdabryanus),分别隶属鲤形目(Cypriniformes)、鳅科(Cobitidae)的泥鳅属(Misgurnus)和副泥鳅属(Paramisgurnus),这2种鳅适应性强、分布广,具有高蛋白、低脂肪的特点,是重要的小型经济鱼类。目前,已对泥鳅和大鳞副泥鳅繁育相关的基因进行了相关研究[12-14],但关于2种鳅CYP17-Ⅰ基因的研究尚未见报道。本研究采用3′-和5′-RACE法,以泥鳅和大鳞副泥鳅为研究材料,克隆这2种鳅CYP17-Ⅰ基因的cDNA全长序列,并对CYP17-Ⅰ基因cDNA和氨基酸序列进行分析,同时运用实时定量PCR (quantitative real-time PCR,qRT-PCR)技术研究其在不同组织中的表达,旨在了解CYP17-Ⅰ基因序列特征及其表达模式,为泥鳅和大鳞副泥鳅的繁殖生物学提供参考。
1 材料与方法
1.1 材料
本研究所用泥鳅和大鳞副泥鳅均取自浙江省淡水水产研究所综合实验基地,分别剪取健康泥鳅和大鳞副泥鳅的肠、肌肉、心脏、胃、肝脏、精巢、卵巢、脾脏等组织,迅速放入液氮冷冻,于-80℃保存备用。
主要试剂:TRIzol®Reagent购自Invitrogen公司;M-MLV RTase cDNA反转录试剂盒、dNTP Mixture(2.5mM)、10×ExTaqBuffer (Mg2+Plus)、ExTaq(5U·μL-1)、DNA回收试剂盒、pMD18-T试剂盒、SYBR®PremixExTaqTMⅡ试剂盒均购自TaKaRa公司;RACE试剂盒购自Clontech公司;DEPC购自上海生工生物技术有限公司;大肠埃希菌(Escherichiacoli)DH5α为本实验室保存。
1.2 总RNA的提取
按照TRIzol®reagent一步法操作提取泥鳅和大鳞副泥鳅各组织总RNA,用核酸蛋白测定仪等检测总RNA的浓度及纯度,并用琼脂糖凝胶电泳检测其完整性。
1.3 第1链cDNA的合成
分别取泥鳅和大鳞副泥鳅各组织总RNA 500ng,按照M-MLV RTase cDNA反转录试剂盒说明,进行反转录合成第1链cDNA,保存于-20℃备用。
1.4 部分cDNA序列扩增
根据斑点叉尾鮰(GenBank: NM_001200313)、斑马鱼(GenBank: NM_212806)、虹鳟(GenBank: NM_001124747)、青鳉(GenBank: NM_001105094)的CYP17-Ⅰ基因序列设计泥鳅和大鳞副泥鳅兼并引物cDNA-F和cDNA-R(表1),由Invitrogen公司合成。以2种鳅总RNA浓度和质量检测结果最好的卵巢RNA合成的第1链cDNA为模板,分别扩增2种鳅CYP17-Ⅰ部分cDNA序列,反应体系50μL。PCR程序:95℃ 3min;95℃ 30s,53℃ 30s,72℃ 1min 30s,共30个循环;72℃ 8min,4℃终止程序。PCR产物按照DNA回收试剂盒说明进行切胶纯化回收,按照pMD18-T克隆试剂盒说明,连接入pMD18-T载体,转化E.coliDH5α感受态细胞,培养后,通过蓝白斑筛选和菌落鉴定,挑选阳性克隆,送生工生物工程(上海)股份有限公司测序。测序所得序列经NCBI的BLAST比对检验。
1.5 CYP17-Ⅰ基因3′-RACE法克隆
根据已得到的泥鳅和大鳞副泥鳅CYP17-Ⅰ基因部分cDNA序列,分别设计泥鳅和大鳞副泥鳅3′-RACE引物:MA-GSP-CYP17-3′和PD-GSP-CYP17-3′ (表1)。按照RACE试剂盒说明,分别以2种鳅卵巢第1链cDNA为模板,PCR扩增CYP17-Ⅰ基因3′序列。反应体系25μL,模板1μL。PCR程序:94℃ 30s,72℃ 3min,共5个循环;94℃ 30s,70℃ 30s,72℃ 3min,共5个循环;94℃ 30s,68℃ 30s,72℃ 3min,共30个循环。PCR产物经电泳分离检测,按照1.4节方法,进行切胶回收纯化,连接pMD18-T载体,转化E.coliDH5α感受态细胞,通过蓝白斑筛选和菌落鉴定,挑选阳性克隆,送生工生物工程(上海)股份有限公司测序。
1.6 CYP17-Ⅰ基因5′-RACE法克隆
根据已得到的泥鳅和大鳞副泥鳅CYP17-Ⅰ基因部分cDNA序列,分别设计泥鳅和大鳞副泥鳅5′-RACE引物:MA-GSP-CYP17-5′和PD-GSP-CYP17-5′ (表1),根据RACE试剂盒说明,按照1.5节方法,PCR扩增CYP17-Ⅰ基因5′序列。PCR产物经电泳分离检测,按照1.4节方法,进行切胶回收纯化,连接pMD18-T载体,转化E.coliDH5α感受态细胞,通过蓝白斑筛选和菌落鉴定,挑选阳性克隆,送生工生物工程(上海)股份有限公司测序。
1.7 序列分析
应用NCBI上的ORF finder程序查找开放阅读框(open reading frame,ORF);用ExPASy在线protparam程序分析氨基酸的物理参数;利用TMHMM程序预测跨膜结构;用SignalP程序预测信号肽;用bioinf程序结合predictprotein程序分析蛋白质二级结构;用SMART程序结合NCBI的Conserved Domains(CD-Search)程序分析蛋白质结构域;用NCBI的BLAST进行相似度分析;BLAST分析泥鳅、大鳞副泥鳅与其他物种的CYP450家族推导的氨基酸序列,用ClustalX进行多重序列比对分析;用MEGA进行系统进化分析,采取邻位相接法(neighbor-joining,NJ),Bootstrap重复1000次计算各分枝的置信度,构建2种鳅CYP17-Ⅰ氨基酸序列与其他物种的NJ系统进化树。
1.8 CYP17-Ⅰ基因组织表达检测
根据CYP17-Ⅰ基因序列分别设计泥鳅和大鳞副泥鳅定量引物:MA-CYP17-F、MA-CYP17-R及PD-CYP17-F、PD-CYP17-R (表1)。分别以泥鳅β-actin和大鳞副泥鳅16S rRNA基因为内参,设计内参引物β-actin-F、β-actin-R及16S rRNA-F、16S rRNA-R (表1)。采用qRT-PCR检测CYP17-Ⅰ基因在各个组织中的表达情况,按照SYBR®PremixExTaqTMⅡ试剂盒说明,分别以1.3节方法所得泥鳅和大鳞副泥鳅各组织的第1链cDNA为模板,qRT-PCR程序:95℃ 4min;95℃ 30s,55℃ 30s,72℃ 30s,共40个循环;72℃ 8min。采用2-ΔΔCt方法计算每个样品目的基因的相对表达量。
表1 基因克隆和荧光定量所用到的引物
Table 1 Primers for gene cloning and qRT-PCR experiments

引物名称Primername序列Sequence(5'→3')cDNA-FCAGCCAGGGMATYGTGGATACcDNA-RGGGTTYTTCCAYTCYTTYTCATCMA-GSP-CYP17-3'CACTGTGCAGAAAGGGACACGAGTCPD-GSP-CYP17-3'AAGACAGACACCCTCAGCTCGGTGMA-GSP-CYP17-5'ATTCTCAGAACTGCGCTTGGCCCTCPD-GSP-CYP17-5'GGAAACGGGTCGGATTCTTAGCACTMA-CYP17-FGTGGTTTGTGCCCTGTGTMA-CYP17-RCAACTTGTGCTCCTCGTATTPD-CYP17-FCCTCCCCTCACTGCCTATCAPD-CYP17-RCCCATGCACCATCTTCCGATβ-actin-FCAATCCCAAAGCCAACAGβ-actin-RCCATCACCAGAGTCCATCA16SrRNA-FGGAACTCGGCAAACTCAA16SrRNA-RCTCCAAAGGGTCTTCTCG
1.9 统计分析
采用单因素方差分析法(one-way ANOVA),多重比较分析各组织基因相对表达量的差异显著性,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 CYP17-Ⅰ基因cDNA全长序列
克隆得到泥鳅CYP17-Ⅰ基因cDNA全长序列1706bp,包含5′-非翻译区(5′-untranslated region,5′-UTR) 14bp和3′-非翻译区(3′-untranslated region,3′-UTR) 129bp,ORF长度1563bp。大鳞副泥鳅CYP17-Ⅰ基因cDNA全长序列1763bp,包含5′-UTR 86bp和3′-UTR 132bp,ORF长度1545bp。2种鳅的3′-UTR都有1个多聚腺苷酸加尾信号(AATAAA)和1个多聚A尾(图1)。所得泥鳅和大鳞副泥鳅CYP17-Ⅰ基因cDNA全长序列提交GenBank,登录号分别为JQ269653.1和JQ269651.1。
2.2 CYP17-Ⅰ氨基酸序列
泥鳅CYP17-Ⅰ的ORF编码520个氨基酸,预测蛋白质相对分子质量为59.0776ku,分子式C2656H4235N733O744S23,理论等电点(isoelectric point,pI)为9.19。其中,亮氨酸(Lue,L)含量最高为12.3%,半胱氨酸(Cys,C)、色氨酸(Trp,W)含量较低,分别为1.9%、1.3%;带负电荷氨基酸残基(Asp+Glu) 33个,带正电荷氨基酸残基(Arg+Lys) 67个;脂肪族氨基酸指数为97.08。大鳞副泥鳅CYP17-Ⅰ的ORF编码514个氨基酸,预测蛋白质相对分子质量为58.1876ku,分子式C2611H4156N716O736S26,pI为9.01。其中,亮氨酸(Lue,L)含量最高为11.9%,半胱氨酸(Cys,C)、色氨酸(Trp,W)含量较低,分别为2.1%、1.6%;带负电荷氨基酸残基(Asp+Glu) 52个,带正电荷氨基酸残基(Arg+Lys) 63个;脂肪族氨基酸指数为96.13。

A,泥鳅;B,大鳞副泥鳅。方框黑体核苷酸表示多聚腺苷酸加尾信号(AATAAA);*为终止密码子;方框内氨基酸序列表示信号肽;虚线氨基酸序列表示跨膜结构;阴影部分氨基酸序列表示保守的蛋白结构域;下划线表示3个功能保守区序列A,Mud loach; B,large-scale loach.The polyadenylation addition signal (AATAAA) is marked with a bold block.The stop codon is represented as an asterisk(*).The signal peptide of the amino acid sequence is boxed.The transmembrane region of the amino acid sequence is marked by dotted lines.The conserved protein domains of the amino acid sequence indicated by shaded areas.The three functionally conserved sequences are underlined
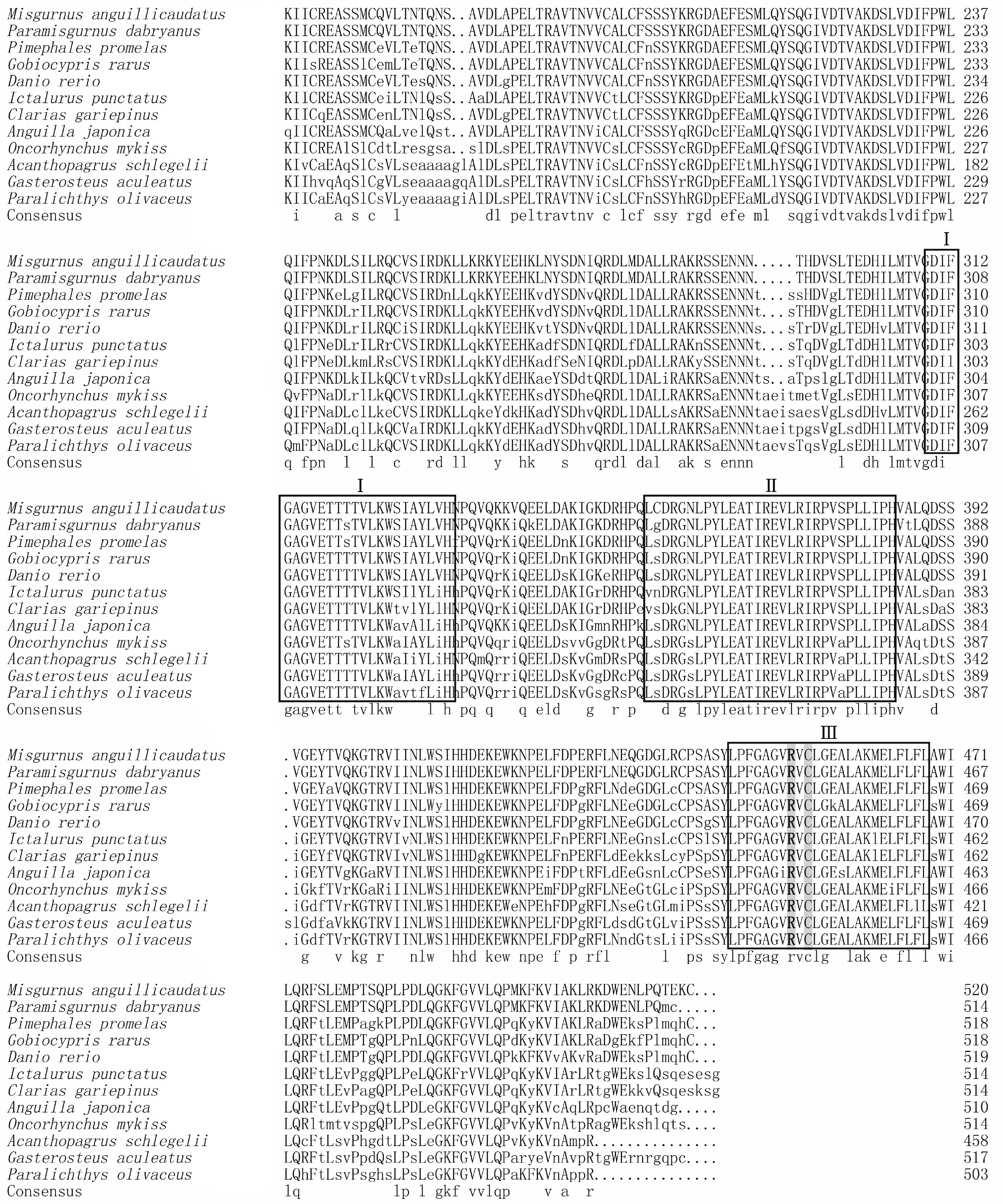
GenBank登录号:泥鳅,AFD54865.1;大鳞副泥鳅,AFD54863.1;稀有鮈鲫,AEV91665.1;斑马鱼,NP_997971.2;斑点叉尾鮰,NP_001187242.1;鳗鲡,AAR88432.1;虹鳟,NP_001118219.1;黑鲷,AAW62972.1;三刺鱼,NP_001254585.1;牙鲆,ACN72759.2。方框表示3个功能保守区,Ⅰ:Ono序列;Ⅱ:Ozols′十三肽区;Ⅲ:亚铁血红素结合区。阴影黑体为保守的精氨酸;阴影为发挥活性所必须的半胱氨酸GenBank accession number: Misgurnus anguillicaudatus,AFD54865.1; Paramisgurnus dabryanus,AFD54863.1; Gobiocypris rarus,AEV91665.1; Danio rerio,NP_997971.2; Ictalurus punctatus,NP_001187242.1; Anguilla japonica,AAR88432.1; Oncorhynchus mykiss,NP_001118219.1; Acanthopagrus schlegelii,AAW62972.1; Gasterosteus aculeatus,NP_001254585.1; Paralichthys olivaceus,ACN72759.2.The three functionally conserved regions are boxed,Ⅰ: Ono sequence; Ⅱ: Ozols′ tridecapeptide region; Ⅲ: haem-binding region.The conserved arginine is marked in shadow and bold.The active cysteine is shadowed
采用SignalP server程序预测,泥鳅和大鳞副泥鳅都有1个信号肽,分别包含25和22个氨基酸(图1)。利用TMHMM程序预测,2种鳅都有1个明显的跨膜区,分别包含23和20个氨基酸(图1)。结构域分析表明,2种泥鳅CYP17-Ⅰ都含1个保守的蛋白结构域,分别位于第45-505和第41-501位氨基酸处,都存在3个功能保守区:(1)Ono序列;(2)Ozols′十三肽区;(3)亚铁血红素结合区(图2)。同时,亚铁血红素结合区存在保守的精氨酸(Arg,R)和发挥活性所必需的半胱氨酸(Cys,C)(图2)。蛋白质二级结构预测表明,泥鳅CYP17-Ⅰ二级结构含17个α螺旋、9个β折叠片及27个其他无规则卷曲,分别占二级结构的32.1%、17.0%、50.9%;大鳞副泥鳅CYP17-Ⅰ二级结构含18个α螺旋、9个β折叠片及27个其他无规则卷曲,分别占二级结构的33.3%、16.7%、50.0%。
2.3 CYP17-Ⅰ氨基酸序列同源性和进化树分析
经NCBI的BLAST蛋白质相似度分析,泥鳅与大鳞副泥鳅的CYP17-Ⅰ氨基酸序列相似度最高,达99%,同其他鱼类的相似度也在70%以上。使用ClustalX对氨基酸序列进行多重比对后,利用MEGA将比对结果构建NJ系统进化树(图3)。结果表明,不同类型的CYP450占据进化树的不同分枝。其中,CYP17-Ⅰ和CYP17-Ⅱ距离最近。在CYP17-Ⅰ分支中,其系统发育关系基本符合传统的分类地位,例如CYP17-Ⅰ按鱼类和哺乳动物分为2个分枝,在鱼类分支中,鲤形目的3种鱼聚在一起,且泥鳅与大鳞副泥鳅聚为1枝。CYP17-Ⅰ氨基酸序列可以作为鱼类系统发育分析的参考。

各枝节点数字表示进化分枝的置信度The confidence of the phylogenetic tree branches is represented a number in each branch node图3 泥鳅、大鳞副泥鳅与其他物种CYP450家族NJ系统进化树Fig.3 Neighbour-joining phylogenetic tree of the CYP450family in mud loach (Misgurnus anguillicaudatus),large-scale loach (Paramisgurnus dabryanus) and other species
2.4 CYP17-Ⅰ基因在各组织中的表达
分别以β-actin和16S rRNA为内参,检测CYP17-Ⅰ基因在泥鳅和大鳞副泥鳅肠、肌肉、心脏、胃、肝脏、精巢、卵巢、脾脏等8种组织的表达情况。结果表明,CYP17-Ⅰ在泥鳅和大鳞副泥鳅所有检测组织中均表达,表达水平存在明显的组织差异,均在精巢和卵巢中表达较高,其他组织表达较低。其中,精巢表达量最高,肝脏表达量最低,泥鳅和大鳞副泥鳅精巢的CYP17-Ⅰ相对表达量分别是肝脏的122.1和141.8倍(图4)。统计学分析表明,CYP17-Ⅰ基因在2种鳅不同组织间表达量差异极显著(P<0.01),相同组织间表达量无显著差异。

柱状图上无相同大写字母表示各处理间差异极显著(P<0.01)Data marked without the same uppercase letter in each histogram indicated significant differences at P<0.01.
3 讨论
3.1 CYP17-Ⅰ基因的序列特征
鱼类CYP17存在2种类型:CYP17-Ⅰ和CYP17-Ⅱ,分别由2种基因编码[1,5,7,9]。CYP17-Ⅰ具有17α-羟化酶、17,20-裂解酶等酶活性,而CYP17-Ⅱ只具有17α-羟化酶活性[8]。本研究克隆的泥鳅和大鳞副泥鳅CYP17基因cDNA序列属于前者。2种鳅CYP17-Ⅰ基因的3′-UTR都含多聚腺苷酸加尾信号(AATAAA),这与其他物种相似[1],但与仿刺参[2]不同的是,2种鳅CYP17-Ⅰ基因3′端未发现和mRNA降解作用有关的信号序列ATTTA(AUUUA),这可能是CYP17-Ⅰ基因在不同物种的进化中发生了突变,由其他相关序列代替,尚待研究。
泥鳅和大鳞副泥鳅CYP17-Ⅰ氨基酸序列都含1个信号肽,其有助于CYP17-Ⅰ透过内质网进入内质网腔[2];信号肽中多数氨基酸为强疏水性,可支撑酶的跨膜位置,这与田燚等[2]、Wang等[11]的研究一致。此外,跨膜结构区域二级结构为α螺旋,其与膜内外电子传递催化功能有关,这些特征有助于结合在膜上的CYP17-Ⅰ蛋白前体穿过内质网的选择性膜,发挥17α-羟化酶、17,20-裂解酶等酶活性,这也符合CYP17-Ⅰ是一种微粒体酶,主要存在内质网的特点[2]。与仿刺参[2]不同的是,2种鳅CYP17-Ⅰ信号肽区域二级结构为无规则卷曲和α螺旋,并非延伸链,α螺旋和无规则卷曲占一半以上,是构成蛋白质二级结构中的主要结构单元[2],与黄鳝(Monopterusalbus)等的CYP17-Ⅰ信号肽区域二级结构主要为α螺旋和β折叠[2,15]存在一定差异,这些结构差异与功能的关系和机理有待进一步探索。
3.2 CYP17-Ⅰ的系统进化
CYP17-Ⅰ的催化活性、结构和功能均较保守[2,4,11],本研究也证明了这一点。同其他物种CYP17-Ⅰ一样,泥鳅和大鳞副泥鳅CYP17-Ⅰ氨基酸序列具有明显的CYP450家族特征[2],即包含3个典型功能保守区,即Ono序列、Ozols′十三肽区和亚铁血红素结合区,这3个功能保守区的保守性较高[1,4]。亚铁血红素结合区协调结合CYP17的底物进行反应,其中,亚铁血红素结合区是亚铁血红素的结合位点,其中存在保守的精氨酸(Arg,R)和发挥活性所必需的半胱氨酸(Cys,C)。这些功能保守区和活性位点构成了质子传递链、K螺旋、血红素结合环和绝对保守的EXXR基序,在类固醇激素合成中起重要作用。人类CYP17的Arg358是酶依赖于细胞色素b5的裂解酶活性(或酰基碳切割活性)所必需的[2,16],在硬骨鱼类及其他脊椎动物CYP17中,Arg358都位于Ozols′十三肽区,泥鳅和大鳞副泥鳅CYP17的Arg358也位于这一区域。
3.3 CYP17-Ⅰ基因的组织表达
在泥鳅和大鳞副泥鳅的8个组织中均检测到有CYP17-Ⅰ表达,卵巢和精巢中表达量较高,这与Chen等[1]、温海深等[4]和Liu等[6]的结果一致,表明性腺是CYP17-Ⅰ的主要表达部位。CYP17-Ⅰ调控类固醇激素前体——睾酮(testoserone,T)和17α-羟孕酮的产生,分别为17β-雌二醇(17β-estradiolum,E2)和17α,20β-双羟孕酮(17α,20β-DHP)的生物合成提供重要的前体。同时,CYP17-Ⅰ也是E2向17α,20β-DHP转变的关键因子[17]。睾酮是雄性性别分化中一种重要的激素,绿鳍马面鲀[4]和半滑舌鳎[8]的研究结果表明,CYP17基因的表达水平与血清中的睾酮含量密切相关,最高值均出现在卵细胞或精子成熟期。
在硬骨鱼类卵巢中,E2和17α,20β-DHP分别用于诱导卵母细胞生长和最终卵母细胞的成熟[3]。在鱼类的卵母细胞成熟阶段,此过程主要通过17α-羟孕酮合成17α,20β-DHP完成,最终促进卵泡成熟。在硬骨鱼类精巢中,CYP17-Ⅰ对孕激素的合成至关重要,孕激素可诱导排精和精子成熟[4,8],硬骨鱼类中孕激素17α,20β-DHP存在于精子生成早期的精巢内,可诱导精原细胞DNA的复制,是精子产生及减数分裂的开启者[8]。CYP17在精子发育早期阶段转录水平低,在精子形成过程中不断增加[18];在睾丸的形成中,表达量升高[19],表明CYP17在鱼类繁殖周期中,对睾酮的生成起着关键的调控作用[4]。
CYP17在鱼类的肾脏(头肾)中表达量也较高,肾脏是另一个典型的类固醇合成组织[1]。鱼类脑中CYP17的表达量也较高[1,4,10],但低于性腺和肾。温海深等[4]的研究表明,脑中CYP17的表达仅次于卵巢,略高于精巢。脑中CYP17参与调控神经内分泌系统,诱导脑中的类固醇激素生成,为在脑中起芳香化作用的脑型芳香化酶提供前体。推测类固醇激素可能在鱼的大脑局部产生,说明类固醇调控依赖于脑—垂体—性腺轴[8]。
[1] CHEN C F,WEN H S,WANG Z P,et al.Cloning and expression ofP450c17-Ⅰ (17α-hydroxylase/17,20-lyase) in brain and ovary during gonad development inCynoglossussemilaevis[J].FishPhysiologyandBiochemistry,2010,36(4): 1001-1012.
[2] 田燚,张丙龙,常亚青.仿刺参性别相关基因P450c17的克隆与序列分析[J].中国水产科学,2012,19(1): 22-32.
TIAN Y,ZHANG B L,CHANG Y Q.Cloning and bioinformatics analysis of aromatization geneP450c17in sea cucumberApostichopusjaponicus(Selenka)[J].JournalofFisherySciencesofChina,2012,19(1): 22-32.(in Chinese with English abstract)
[3] CHEN C F,WEN H S,HE F,et al.Molecular mechanism of P450c17-Ⅱ (17,20-lyase) regulating gonad development in femaleCynoglossussemilaevis[J].AquacultureResearch,2013,44(9): 1459-1469.
[4] 温海深,任源远,张冬茜,等.绿鳍马面鲀CYP17-Ⅰ基因克隆及其在繁殖周期中的表达[J].水产学报,2014,38(12): 1945-1955.
WEN H S,REN Y Y,ZHANG D Q,et al.Molecular cloning and expression patterns of the cytochromeCYP17-Ⅰ gene during the reproductive cycle inNavodonseptentrionalis[J].JournalofFisheriesofChina,2014,38(12): 1945-1955.(in Chinese with English abstract)
[5] ZHOU L Y,WANG D S,KOBAYASHI T,et al.A novel type of P450c17lacking the lyase activity is responsible for C21-steroid biosynthesis in the fish ovary and head kidney[J].Endocrinology,2007,148(9): 4282-4291.
[6] LIU S,QIN F,WANG H,et al.Effects of 17α-ethinylestradiol and bisphenol A on steroidogenic messenger ribonucleic acid levels in the rare minnow gonads[J].AquaticToxicology,2012(122/123): 19-27.
[7] ZHOU L Y,WANG D S,SHIBATA Y,et al.Characterization,expression and transcriptional regulation ofp450c17-Ⅰ and -Ⅱ in the medaka,Oryziaslatipes[J].BiochemicalandBiophysicalResearchCommunications,2007,362(3): 619-625.
[8] 陈彩芳,温海深.P450c17s基因mRNA在雄性半滑舌鳎繁殖周期中的表达[J].水产学报,2012,36(7): 1019-1025.
CHEN C F,WEN H S.The characteristic analysis ofP450c17smRNA expression during the reproductive cycle in maleCynoglossussemilaevisGünther[J].JournalofFisheriesofChina,2012,36(7): 1019-1025.(in Chinese with English abstract)
[9] DING Y X,HE F,WEN H S,et al.DNA methylation status ofcyp17-Ⅱ gene correlated with its expression pattern and reproductive endocrinology during ovarian development stages of Japanese flounder (Paralichthysolivaceus)[J].Gene,2013,527(1): 82-88.
[10] HALM S,KWON J Y,RAND-WEAVER M,et al.Cloning and gene expression of P45017α-hydroxylase,17,20-lyase cDNA in the gonads and brain of the fathead minnowPimephalespromelas[J].GeneralandComparativeEndocrinology,2003,130(3): 256-266.
[11] WANG Y,GE W.Cloning of zebrafish ovarianP450c17(CYP17,17α-hydroxylase/17,20-lyase) and characterization of its expression in gonadal and extra-gonadal tissues[J].GeneralandComparativeEndocrinology,2004,135(2): 241-249.
[12] 刘士力,胡廷尖,王雨辰,等.泥鳅雌雄性比对繁殖影响的试验[J].河北渔业,2010,204(12):30-32.
LIU S L,HU T J,WANG Y C,et al.Effects of sex ratio on propagation of oriental weatherfish,Missgurnusarguillicaudatus[J].HebeiFishery,2010,204(12):30-32.(in Chinese with English abstract)
[13] 胡廷尖,刘士力,练青平,等.泥鳅早期形态发育的研究[J].中国农学通报,2012,28(17): 132-138.
HU T J,LIU S L,LIAN Q P,et al.Study on the developmental and morphological characters inMissgurnusarguillicaudatusLarvae[J].ChineseAgriculturalScienceBulletin,2012,28(17): 132-138.(in Chinese with English abstract)
[14] 刘士力,王雨辰,张德华,等.大鳞副泥鳅β-肌动蛋白的cDNA全长克隆及表达分析[J].中国农学通报,2013,29(35): 96-101.
LIU S L,WANG Y C,ZHANG D H,et al.Cloning and expression analysis ofβ-actingene fromParamisgurnusdabryanus[J].ChineseAgriculturalScienceBulletin,2013,29(35): 96-101.(in Chinese with English abstract)
[15] YU H,CHENG H,GUO Y,et al.Altemative splicing and differential expression ofP450c17(CYP17) in gonads during sex transformation in the rice field eel[J].BiochemicalandBiophysicalResearchCommunications,2003,307(l): 165-171.
[16] LEE-ROBICHAUD P,AKHTAR M E,WRIGHT J N,et al.The cationic charges on Arg347,Arg358and Arg449of human cytochome P450c17(CYP17) are essential for the enzyme’s cytochrome b5-dependent acyl-carbon cleavage activities[J].TheJournalofSteroidBiochemistryandMolecularBiology,2004,92(3): 119-130.
[17] SREENIVASULU G,SENTHILKUMARAN B.A role for cytochrome P45017α-hydroxylase /c17-20lyase during shift in steroidogenesis occurring in ovarian follicles prior to oocyte maturation[J].GeneralandComparativeEndocrinology,2009,115(3/5): 77-85.
[18] MAUGARS G,SCHMITZ M.Gene expression profiling during spermatogenesis in early maturing male Atlantic salmon parr testes[J].GeneralandComparativeEndocrinology,2008,159(2): 178-187.
[19] IWADE R,MARUO K,OKADA G,et al.Elevated expression ofP450c17(CYP17) during testicular formation in the frog[J].GeneralandComparativeEndocrinology,2008,155(1): 79-87.
(责任编辑 侯春晓)
Cloning and tissue expression analysis of the cytochrome P450c17-Ⅰ(CYP17-Ⅰ)gene from mud loach (Misgurnus anguillicaudatus) and large-scale loach (Paramisgurnus dabryanus)
LIU Shi-li1,2,ZHANG Ai-ju1,LIAN Qing-ping1,WU Wei-jun3,4,*,JIA Yong-yi1,JIANG Wen-ping1,LI Fei1
(1.ZhejiangInstituteofFreshwaterFisheries,AgricultureMinistryKeyLaboratoryofHealthyFreshwaterAquaculture/KeyLaboratoryofFreshwaterAquaticAnimalGeneticandBreedingofZhejiangProvince,Huzhou313001,China; 2.CollegeofFisheriesandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China; 3.FisheriesTechnologyExtensionStation,WaterResourcesBureauofQingyuanCounty,Qingyuan323800,China; 4.FisheriesBranch,HydropowerInstituteofQingyuanCounty,Qingyuan323800,China)
In this study,full-length cDNA sequences of the cytochromeP450c17-Ⅰ (CYP17-Ⅰ) gene were cloned using homologous cloning and 3′- and 5′-rapid amplification of cDNA ends techniques from mud loach (Misgurnusanguillicaudatus) and large-scale loach (Paramisgurnusdabryanus).Their expression in various tissues were then explored using quantitative real-time PCR (qRT-PCR).In mud loach,the cloned sequence was 1706bp in length and contained a 1563bp open reading frame (ORF) encoding a protein of 520amino acids.In the large-scale loach,the cloned sequence was 1763bp in length and contained a 1545bp ORF encoding a protein of 514amino acids.Both CYP17-Ⅰ proteins had a predicted signal peptide,a transmembrane domain,a conserved protein domain and three conserved functional areas.Identity analysis showed that CYP17-Ⅰ amino acid sequences were 99% identical between the two loaches,and were more than 70% identical to the same proteins from other fish species.Phylogenetic analysis showed that the closest relationship of CYP17-Ⅰ amino acid sequences was between this two loaches,and the phylogenetic relationships among the CYP17-Ⅰ amino acid sequences were in accord with the traditional classification.CYP17-Ⅰ was expressed widely in the intestine,muscle,heart,stomach,liver,testis,ovary and spleen in the two species of loach,with the highest expression levels being observed in the the testis and ovary.
cytochrome;Misgurnusanguillicaudatus;Paramisgurnusdabryanus;CYP17-Ⅰ
10.3969/j.issn.1004-1524.2016.11.08
2016-03-14
浙江省淡水水产遗传育种重点实验室建设(2014F10037);浙江省重大科技专项(2013C02009);浙江省设施水产养殖科技创新团队项目(2011R50029);浙江省公益技术研究项目(2010C32033,2012C22059);庆元县科技项目(QKF2015-22-8)
刘士力(1985—),男,湖北洪湖人,博士研究生,主要从事水生动物遗传育种研究。E-mail: liushili1212@126.com
*通信作者,吴卫君,E-mail: zjwuweijun@163.com
S917.4;Q753
A
1004-1524(2016)11-1853-09
浙江农业学报ActaAgriculturaeZhejiangensis,2016,28(11): 1853-1861
http://www.zjnyxb.cn
刘士力,张爱菊,练青平,等.泥鳅和大鳞副泥鳅细胞色素P450c17-Ⅰ (CYP17-Ⅰ)基因的克隆及组织表达分析[J].浙江农业学报,2016,28(11): 1853-1861.

