大气压低温等离子体处理BALB/c小鼠的安全性研究
董颖颖,钟世玉,夏 君,刘定新,许德晖,郭 莉,肖生祥,孔刚玉
(1. 西安交通大学第二附属医院皮肤科,陕西西安 710004;2. 西安交通大学电气工程学院,陕西西安 710049)
◇基础研究◇
大气压低温等离子体处理BALB/c小鼠的安全性研究
董颖颖1,钟世玉1,夏 君1,刘定新2,许德晖2,郭 莉2,肖生祥1,孔刚玉2
(1. 西安交通大学第二附属医院皮肤科,陕西西安 710004;2. 西安交通大学电气工程学院,陕西西安 710049)
目的 使用大气压低温等离子(CAP)体处理BALB/c小鼠背部皮肤,验证CAP物理治疗对活体的安全性。方法 CAP每日照射小鼠背部皮肤3 min,连续2周;检测处理组及对照组血常规及生化指标;测定小鼠脏器系数;对小鼠皮肤及脏器进行HE染色;测定小鼠精子活率及畸形率。结果 处理后小鼠背部皮肤及HE染色均未见异常;CAP处理组小鼠相比于对照组小鼠,在体质量、各脏器质量及各脏器系数均无统计学差异;CAP处理组小鼠的血常规指标及生化指标较对照组均未见明显改变,差异无统计学意义;两组小鼠的内脏大体外观形态正常,组间比较无明显差异;CAP处理组小鼠各内脏组织学观察较正常对照组未见明显异常改变;两组数据在统计学上无显著性差异。小鼠精子活率及畸形率两组数据在统计学上无显著性差异,CAP处理对雄性小鼠精子畸形无明显影响。结论 CAP处理对小鼠皮肤及各脏器无毒性作用,不产生生殖毒性,临床使用安全。
大气压低温等离子体;安全性;生化指标;脏器系数;精子畸形率
大气压低温等离子体(cold atmospheric plasma, CAP)是包含自由基等活性粒子的物质第四态,近年被证实对机体与细胞有诸多生物学效应。CAP应用于消毒灭菌方面已非常成熟,既能高效灭活病原微生物,并同时保持较低的细胞毒性[1-2]。目前,CAP又被应用于促进慢性感染性伤口的愈合、抗肿瘤及银屑病治疗等相关研究[3-5]。作为医学应用的前提,等离子体处理对活体组织的安全性必须得到保证。本研究内容以BALB/c小鼠为实验对象,观察CAP装置对小鼠处理过程中及处理结束后的安全性,对血常规、生化指标及脏器系数、精子活率及畸形率等指标进行测定,为该CAP装置的临床应用提供安全性数据支持。
1 材料与方法
1.1 动物与仪器 SPF级BALB/c小鼠购自西安交通大学医学部实验动物中心。空气中沿面放电低温等离子体装置由西安交通大学电气学院等离子体生物医学中心制作并提供。
1.2 BALB/c小鼠的饲养 选用6周龄,体质量18~20 g的雌鼠20只、雄鼠40只,饲养于清洁级动物饲养室内。饲养过程中注意观察小鼠运动、摄食、排泄等生活习性的改变以及体质量增加的情况等。
1.3 实验分组与处理 将40只雄鼠、20只雌鼠随机分为两组,一组为对照组,雌10只雄20只,一组为CAP处理组,雌10只雄20只,两组小鼠的体质量无统计学差异;将小鼠背部毛剃除,脱毛膏脱去表面毳毛,表面涂抹保湿剂,备用。可重复脱毛1~2次。将小鼠固定,将CAP装置调整放电电极距离小鼠背部约1 cm。装置工作条件Vpp=10 kV,f=10 kHz,处理时间3 min,每日1次。整个处理过程连续进行2周。每日观察照射处皮肤变化,并拍照,同时称体质量;对照组小鼠不予任何处理。
1.4 小鼠血常规及生化指标的检测 用眼球取血的方法进行采血,将采集血液送检,测定血常规及生化指标。
1.5 小鼠脏器系数检测 对颈椎脱臼法处死后的小鼠进行解剖,分离小鼠心脏、双肺、肝脏、脾脏、双肾、睾丸及附睾,观察外观形态,称其质量,计算脏器系数。脏器系数=脏器质量/体质量。
1.6 小鼠皮肤及脏器HE染色 处死小鼠后取照射部皮肤,和内脏进行标本固定后制作石蜡切片,行HE染色,观察皮肤及各脏器镜下结构的情况。
1.7 小鼠精子活率及畸形率的测定 CAP处理过程结束后,实验组及对照组中剩余10只雄鼠继续饲养4周,进行精子活率及畸形率的测定。按照精子的运动方式情况可分为4级:Ⅰ级精子活动很好,快速向前运动;Ⅱ级精子活动好,缓慢向前运动;Ⅲ级精子活动力一般,曲线运动;Ⅳ级精子活动能力差,原地运动或不动。计算样本中精子活率=(Ⅰ+Ⅱ+Ⅲ)/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)×100%。
1.8 统计学分析 应用统计学软件SPSS 15.0进行数据处理,数据以均数±标准差表示,采用独立样本t检验方法进行统计分析。P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠皮肤形态及组织病理改变 对照组小鼠背部皮肤光滑,正常皮肤光泽(图1A)。处理组小鼠背部皮肤未见明显异常,无红斑、鳞屑、渗出、溃疡等改变(图1B),HE染色示小鼠皮肤结构完整,未见异常改变,与对照组小鼠比较无差异(图1C、1D)。因此,本实验中CAP装置在设定工作参数状态下对小鼠皮肤进行处理,不会引起皮肤灼伤或其他刺激性改变。

图1 小鼠皮肤形态及组织病理改变Fig.1 The changes of skin morphology and histopathology in the mice (HE, ×200)
2.2 小鼠体质量及脏器系数的比较 CAP处理组小鼠相比于对照组小鼠,在体质量、各脏器质量及各脏器系数均无统计学差异。2周的CAP处理未对小鼠体质量、各脏器质量产生影响(表1)。
2.3 小鼠血常规及生化指标的比较 CAP处理组小鼠间的血常规指标及生化指标较对照组均未见明显改变,差异无统计学意义。因此,2周的CAP处理未对小鼠的血常规指标及生化指标产生影响(表2、表3)。
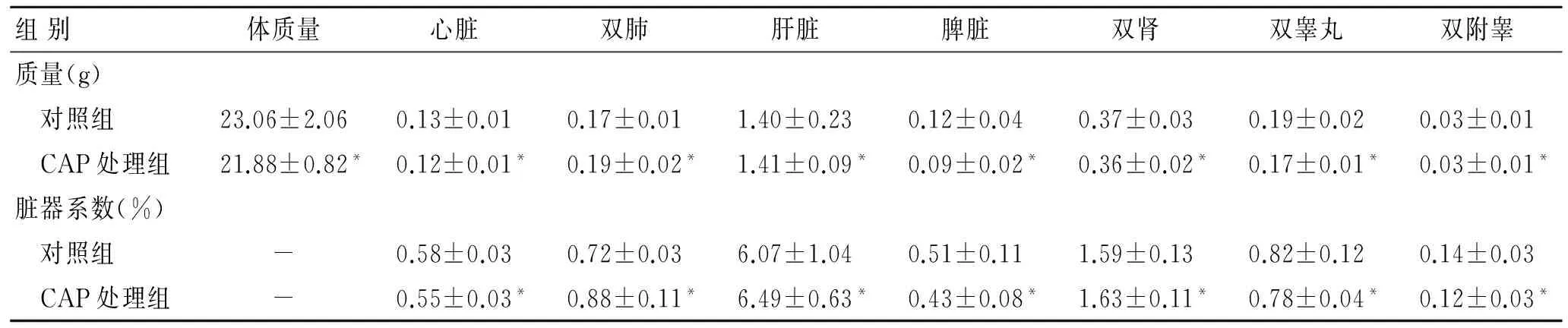
表1 两组小鼠体质量、脏器质量和脏器系数的比较Tab.1 Comparison of body and organs weights and organ indexes of the mice

表2 两组小鼠血常规指标的比较Tab.2 Comparison of blood routine indexes of the mice
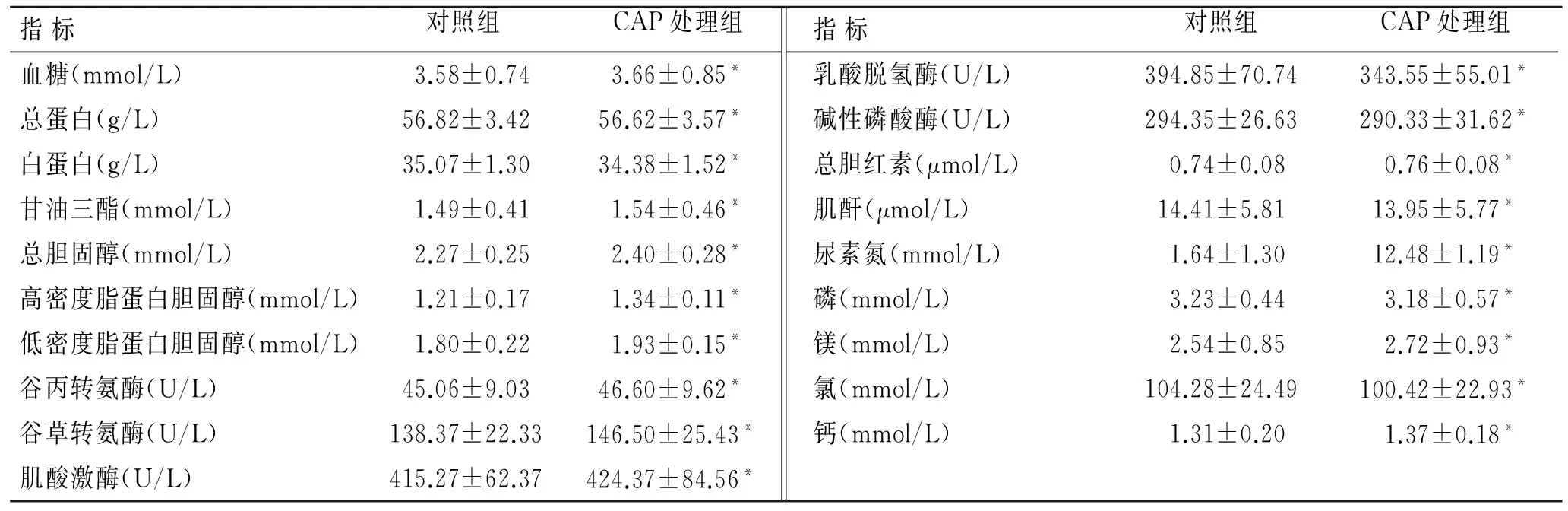
表3 两组小鼠生化指标的比较Tab.3 Comparison of biochemical parameters of the mice
2.4 小鼠脏器形态及组织病理改变 两组小鼠脏器在剥离时均无异常粘连,分离后均形态完整、规则,表面光滑有正常光泽,未见水肿或萎缩等肉眼可见的外观改变,组间比较无明显差异(图2)。HE染色两组鼠的心脏切片中可见完整的心内膜、心肌层及心外膜结构,心肌层由形态规则、排列整齐的心肌纤维构成(图3A、3B);肝脏形态规则、紧密相邻的肝细胞,小叶间结缔组织中可见小叶间静脉及单层立方上皮围成的小叶间胆管(图3C、3D);脾脏可见白髓与红髓构成的脾髓结构,脾小结中央可见中央动脉;肺脏可见大量扁平有核上皮形成的肺泡及肺泡囊、肺泡管结构,可见无纤毛方形上皮形成的终末细支气管,外层由平滑肌包绕,附近可见血管结构;肾脏切片中皮质区可见丰富的肾小球结构(图3E、3F);小肠切片中黏膜层可见大量肠绒毛(图3G、3H);睾丸切片中可见大量圆形、规则的曲细精管,其内可观察到形态规则的各级生精细胞,可见支持细胞、间质细胞形成的间质结构。CAP处理组小鼠各内脏组织学观察较正常对照组未见明显异常改变。
图2 小鼠脏器形态的比较Fig.2 Comparison of organ morphology of the mice
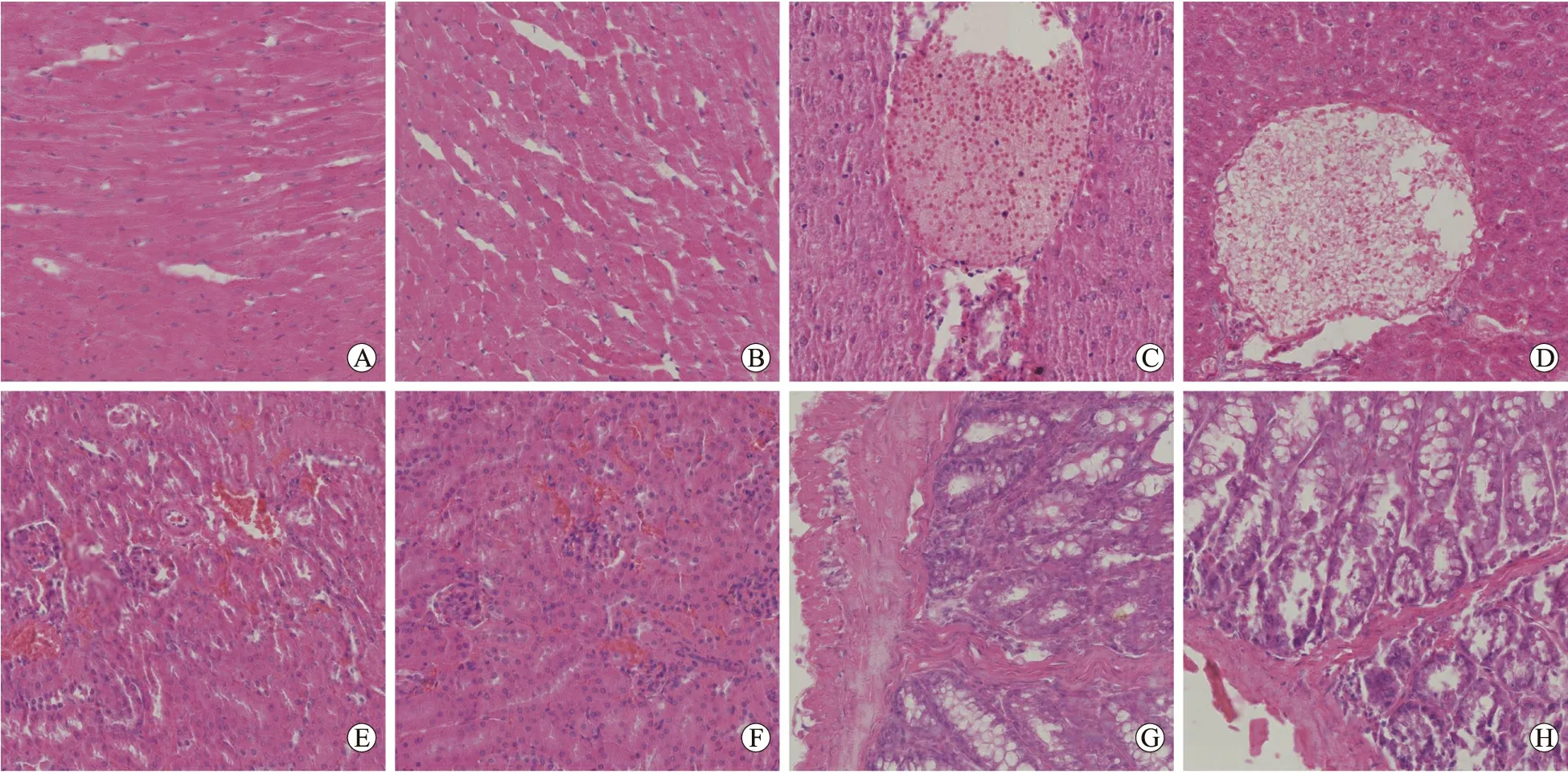
图3 小鼠各脏器组织病理的比较Fig.3 Comparison of the organs’ histopathologic findings of the mice (HE, ×200)
2.5 小鼠精子活率及畸形率的比较 正常组小鼠的精子活率为(63.70±4.43)%,CAP处理组小鼠的精子活率为(65.20±3.32)%,经统计学分析,两组数据无显著性差异(表4)。CAP处理对雄性小鼠精子活率无明显影响。小鼠精子形态和活动度在镜下两组无明显差别(图4)。经计算,正常对照组小鼠的精子畸形率为(2.90±0.19)%,CAP处理组小鼠的精子畸形率为(3.10±0.23)%,两组数据在统计学上无显著性差异。因此,CAP处理对雄性小鼠精子畸形率无明显影响。

表4 小鼠精子活率和畸形率的比较Tab.4 Comparison of the ratios of sperm activity and deformity of the mice
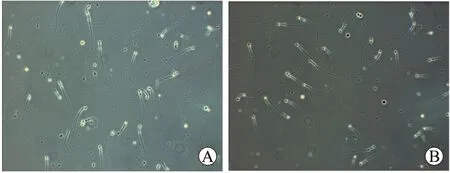
图4 雄鼠正常精子形态的比较Fig.4 The morphology of the eupyrene sperm of the male mice
3 讨 论
CAP是当前生物医学中的一个新的研究领域,由于各研究团队中应用的CAP装置的结构设计、等离子体产生方式等参数不尽相同,且当前对CAP装置本身工作参数设定及安全性标准尚未有统一的规范化管理标准,因此,根据生物医学研究的具体处理对象及实验目的,对CAP装置使用的安全性进行测定。当前使用的CAP装置的安全性评价还没有规范的检测标准或明确的检测方法[6-8]。除了对等离子体本身包含的可能的有害成分,如UV等进行测定外,还需对被处理物的生物学反应及对处理的耐受性进行评价[9]。本研究采用BALB/c小鼠作为处理对象,观察了空气中沿面放电等离子体装置每日连续处理对小鼠处理部位皮肤、各组织器官结构、血液生化指标及雄鼠精液的影响[10-12]。
本研究中使用SMD结构的CAP装置(工作参数等同前)每日对BALB/c小鼠进行3 min的处理,共连续处理2周时间。由于小鼠背部被处理部位的皮肤结构与装置放电电极距离最近,皮肤结构的改变直接反映了处理剂量的高低水平。通过皮肤组织病理切片可见,处理组小鼠与正常小鼠的皮肤组织结构相同,未见明显异常。ISBARY等[13]采用类似结构的CAP装置对志愿者皮肤进行处理,装置能量密度为0.02 W/cm2,单次处理时间为300 s,连续的2~4次处理后取皮肤进行组织病理学切片及电镜观察,未发现皮肤组织结构的明显变化。本研究中装置的能量密度为0.06 W/cm2,BALB/c小鼠接受的单次处理剂量及整体处理时间均超过ISBARY等[13]实验中参数,同样没有观察到皮肤组织结构的改变。对BALB/c小鼠的体质量及各脏器系数进行了记录分析,发现处理组小鼠与对照组小鼠的各项指标无统计学差异,说明在研究中设定的工作条件下,CAP处理未对小鼠的生长发育产生影响,对各脏器无明显毒性。小鼠的血常规及生化指标亦未见异常,CAP处理不会引起小鼠血常规及生化代谢的改变。
CAP对皮肤组织进行处理的操作方法与UV、红外线等物理辐射治疗手段类似,因此需要了解CAP处理对被处理对象生殖系统的影响[14-15]。本研究中对雄鼠的睾丸及附睾进行观察,对精子活率及畸形率进行测定,结果显示CAP处理组小鼠的睾丸及附睾未见异常,精子活率及畸形率与对照组正常小鼠无显著差异,CAP处理组小鼠附睾的生精能力未受影响,说明CAP处理不会对雄鼠产生生殖毒性。
本研究通过动物实验对CAP装置的安全性进行了初步的评估,未发现CAP处理对小鼠皮肤及各脏器的毒性作用。今后的实验中可通过相对微观且更为细致的指标或方法[16],在基因或蛋白水平对CAP装置的安全性进行更为深入的观察研究。
[1] KONG MG, GANGULY BN, HICKS RF. Plasma jets and plasma bullets[J]. Plasma Sources Sci Technol, 2012, 21(3):1-5.
[2] LADEMANN O, KRAMER A, RICHTER H, et al. Antisepsis of the follicular reservoir by treatment with tissue-tolerable plasma(TTP)[J]. Laser Phys Lett, 2011, 10(8):313-317.
[3] XU D, LIU D, WANG B, et al. In situ OH generation from O2- and H2O2 plays a critical role in plasma-induced cell death[J]. PLoS One, 2015, 10(6):125-129.
[4] BALZER J, HEUER K, DEMIR E, et al. Non-thermal dielectric barrier discharge (DBD) effects on proliferation and differentiation of human fibroblasts are primary mediated by hydrogen peroxide[J]. PLoS One, 2015, 10(12):144-152.
[5] ZHONG SY, DONG YY, LIU DX, et al. Surface air plasma-induced cell death and cytokine release of human keratinocytesin the context of psoriasis[J]. Br J Dermatol, 2016, 174(3):542-552.
[6] KRISHNA PA, VIRENDER KH, SYLWIA P, et al. Effects of atmospheric pressure plasmas on isolated and cellular DNA—A review[J]. Int J Mol Sci, 2015, 16(2):2971-3016.
[7] WENDE K, STRABENBURG S, HAERTEL B, et al. Atmospheric pressure plasma jet treatment evokes transient oxidative stress in HaCaT keratinocytes and influences cell physiology[J]. Cell Biol Int, 2014, 38(4):412-425.
[8] LACKMANN JW, BANDOW JE. Inactivation of microbes and acromolecules by atmospheric-pressure plasma jets[J]. Appl Microbiol Biotechnol, 2014, 98(14):6205-6213.[9] ZHANG X, ZHANG XF, LI HP, et al. Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J]. Appl Microbiol Biotechnol, 2014, (12):5387-5396.
[10] COSTA GA, GALVAO TC, BACCHI AD, et al. Investigation of possible teratogenic effects in the offspring of mice exposed to methylphenidate during pregnancy[J]. Reprod Biomed Online, 2016, 32(2):170-177.
[11] MORISHITA Y, YOSHIOKA Y, TAKIMURA Y, et al. Distribution of silver nanoparticles to breast milk and their biological effects on breast-fed offspring mice[J]. ACS Nano, 2016, 8(15):685-696.
[12] 李学银,张卫星,张天标,等. 两种方式注射白消安对SD大鼠生精功能的影响[J]. 郑州大学学报(医学版), 2015, 50(5):665-668.
[13] ISBARY G, KORITZER J, MITRA A, et al.Exvivohuman skin experiments for the evaluation of safety of new cold atmospheric plasma devices[J]. Clin Plas Med, 2013, 1(1):36-44.
[14] BUONANNO M, STANISLAUSKAS M, PONNAIYA B, et al. 207-nm UV light—A promising tool for safe low-cost reduction of surgical site infections. Ⅱ:In-vivosafety studies[J]. PLoS One, 2016, 11(6):138-148.
[15] MASELLA BD, WILLIMAS DR, FISCHER WS, et al. Long-term reduction in infrared autofluorescence caused by infrared light below the maximum permissible exposure[J]. Invest Ophthalmol Vis Sci, 2014, 55(6):3929-3938.
[16] 巫幸福,胡本君,赵宗信,等. 几种金属化合物对小鼠微核试验的影响[J]. 川北医学院学报, 1991, 6(2):20-21.
(编辑 韩维栋)
The safety of cold atmospheric plasma treatment on BALB/c mice
DONG Ying-ying1, ZHONG Shi-yu1, XIA Jun1, LIU Ding-xin2,XU De-hui2, GUO Li2, XIAO Sheng-xiang1, KONG Gang-yu2
(1. Department of Dermatology, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004; 2. School of Electrical Engineering,Xi’an Jiaotong University, Xi’an 710049, China)
Objective To evaluate the biological safety of cold atmospheric plasma (CAP) treatment on the dorsal skin of BALB/c mice. Methods The dorsal skin of BALB/c mice was irradiated daily by three-minute CAP for two weeks. Both routine blood test and biochemical analysis were performed during this period. The indexes of internal organs were scored, followed by hematoxylin-eosin (HE) staining of these tissues and dorsal skin. The ratios of sperm activity and deformity were also calculated. Results After CAP treatment, the dorsal skin and H&E staining showed normal appearance. Compared with the controls, the mice in treatment group had the same weights and indexes of body and organs (P>0.05). Moreover, CAP did not affect the blood routine indexes or biochemical parameters (P>0.05). The two groups displayed similar optical and histological appearance of these internal organs. Furthermore, the two groups did not differ significantly in the ratios of sperm activity or deformity (P>0.05). Conclusion CAP treatment has clinical safety by exhibiting neither routine toxicity on the skin and internal organs nor genotoxicity on male reproductive system of BALB/c mice.
cold atmospheric plasma; safety; biochemical parameter; index of organ; ratio of sperm deformity
2016-05-12
2016-08-06
西安交通大学千人计划项目(No.2014-09);国家自然科学基金资助项目(No.81601630);陕西省自然科学基金青年人才项目(No.2016JQ8044)
Supported by the Thousands of People Plan of Xi’an Jiaotong University (No.2014-09), the National Natural Science Foundation of China (No.81601630), and the Natural Science Foundation of Shaanxi Province (No.2016JQ8044)
董颖颖. E-mail:dyingying97@163.com
R332
A
10.7652/jdyxb201606008
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20161012.1607.016.html(2016-10-12)

