慢性阻塞性肺病诱导轻度认知功能障碍的回顾性队列研究
冯爱芳,王 亮,李 静,杨勤玲,张玉琳
(西安交通大学第一附属医院:1. 肝胆外科;2. 神经内科;3. 呼吸内科,陕西西安 710061)
◇临床研究◇
慢性阻塞性肺病诱导轻度认知功能障碍的回顾性队列研究
冯爱芳1,王 亮2,李 静3,杨勤玲1,张玉琳1
(西安交通大学第一附属医院:1. 肝胆外科;2. 神经内科;3. 呼吸内科,陕西西安 710061)
目的 近期研究发现慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者较多合并轻度认知功能障碍(mild cognitive impairment, MCI)。本文拟通过临床队列研究来探明COPD是否导致MCI的发生。方法 2002年1月至2003年12月,于西安交通大学第一附属医院门诊电子数据库中随机挑选850例认知功能正常的COPD研究人群,年龄在70~90岁之间。首次检查确定基线后,每15个月随访一次,接受症状问询、神经生理检测和心理检测。COPD由呼吸内科医师确诊。使用Cox比例风险模型分析MCI的危险因素。结果 本研究随访时间3.5~6年,中位随访期为5.5年。850例受检人群中,265例在随访期出现了MCI。COPD显著增加了轻度认知功能障碍(HR2.12;95%CI:1.36~3.18;P<0.01)以及其非记忆缺失亚型(non-amnestic mild cognitive impairment, na-MCI)的发生风险(HR2.65;95%CI:1.86~3.89;P<0.01)。Cox多因素分析发现COPD不是MCI总体和轻度认知功能障碍的记忆缺失亚型(amnestic mild cognitive impairment, a-MCI)发生的独立危险因素。本研究还发现对于长期患有COPD的患者,COPD严重程度与MCI(HR2.52;95%CI:1.97~3.62;P<0.01)和na-MCI(HR2.07;95%CI:1.67~2.83;P<0.01)发生率呈正相关关系。结论 COPD明显增加了中老年人群MCI(尤其是na-MCI)的发生率,而且COPD严重程度与MCI发生率呈正相关关系。COPD是MCI发生的危险因素,早期干预COPD可能预防或延缓MCI的发生或进展。
慢性阻塞性肺疾病(COPD);轻度认知功能障碍(MCI);回顾性队列研究;Cox比例风险模型
慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)是由于空气中的细小有毒颗粒或气体诱发肺部慢性炎症导致慢性气道梗阻[1]。病程时间较长,通过对其病因和加重因素进行干预,可有效预防COPD的发生或进展。近期美国流行病学调查显示,25岁以上的美国成年人中有1 350例COPD患者。慢性气道梗阻所导致低氧血症和高二氧化碳血症大大增加了认知功能障碍的风险[2]。目前,已有研究发现COPD可诱发低氧血症和认知功能障碍[3-4]。多学科研究发现COPD患者中有较高比例患者出现了轻度认知功能障碍(mild cognitive impairment, MCI)[5-6]。MCI最早期的临床症状是痴呆,因此发现痴呆症状并早期给予MCI治疗,是预防MCI发生和发展的重要措施。研究发现COPD患者具有更高的风险患有MCI和痴呆症状[7]。但是,该研究并没有进一步研究COPD对MCI两个亚型——记忆缺失性MCI和非记忆缺失性MCI的影响,也没有明确其相关发病机制。本研究通过随访队列研究认知功能正常人群中COPD以及其严重程度对MCI以及其两个亚型的影响。
1 资料与方法
1.1 一般资料 在2002年1月至2003年12月期间,于西安交通大学第一附属医院门诊电子数据库中随机挑选1 150例认知功能正常的COPD研究人群,年龄70~90岁。包括心理卫生科医师在内的多学科医师团队通过蒙特利尔认知评估量表检测,确认所入选患者具有正常认知功能,并没有终末期疾病如癌症、严重心脑血管疾病、终末期肝病等。在1 150例中有850例同意参加本项队列研究,签署知情同意书,接受了基线检查,并在此后每隔15个月(由于MCI病情发展缓慢,参考业内常规确定15个月为随访间隔时间)接受1次随访检查,内容包括护士访视、认知功能检测、COPD相关检查等。随访期间无随访脱落患者。本项研究获得西安交通大学第一附属医院临床伦理委员会批准。
1.2 认知功能的检测 所有受检个人由神经内科护士进行专门访视和病史采集,由神经内科医师和精神卫生科医师进行专门的认知功能检测。护士访视项目包括简单问题问答、记忆检查和病史采集。专科医师检查包括进一步专科病史采集、完整的神经系统查体、完成短期精神状态量表(short test of mental status, STMS)以及帕金森病统一评分量表(unified Parkinson’s disease rating scale, UPDRS)。成套神经心理测验包括9种针对认知4个方面(记忆、语言、执行能力和视觉空间技能)。对于每一方面,所得分数相加从而获得相应的z值。每一方面的原始数据再次相加,于表中比对从而获得认知检测的最终z值。每一方面所实施的不同检测所得分数被加总,所得总分小于正常人群平均值减去标准差值则视为有认知功能障碍。但是,最终诊断均由神经内科护士、神经内科医师和精神卫生科医师讨论所有资料后共同确定。随访期间,随访护士和医师不接触受检人群前期检测和随访资料(单盲法)。根据以下几点,将MCI分为记忆缺失性MCI(a-MCI)和非记忆缺失性MCI(na-MCI):记忆障碍是基本和主要的主诉;有记忆减退的客观检查证据(记忆下降程度低于年龄和文化匹配对照的1.5个标准差以上);一般认知功能正常;日常生活能力保留;没有足够的认知障碍诊断为痴呆。
1.3 COPD诊断 首先,通过使用COPD诊断标准直接诊断和分级或通过收集既往病史进行诊断和分级,然后由呼吸内科医师对上述COPD诊断和分级进行最终审核。
1.4 协变量分析 受检人群相关的一般信息如年龄、性别、教育程度等在入组时被详细记录。所有受检者要求将所有正在服用的药物记录在案;同时,记录吸烟史以及心血管并发症(如高血压、冠心病、心肌病等)、糖尿病、脑血管疾病等慢性疾病史。使用贝克抑郁量表Ⅱ(Beck depression inventory Ⅱ scale)评估抑郁症状。神经内科护士通过测量身高、体质量来计算体质量指数(body mass index, BMI)。使用PCR法检测(试剂盒购自武汉华美生物工程有限公司)受检人群中血清的人载脂蛋白E(ApoE)分型。
1.5 统计学方法 连续性变量使用中位数和四分位数描述。使用卡方检验分析受检人群中MCI患者和非MCI患者以及COPD患者和非COPD患者的一般资料差别,年龄以及受教育年限采用Mann-WhitneyU检验。MCI诊断时间被定义为第一次发现MCI的随访时间和上一次随访时间的中点。多因素Cox比例风险模型分析COPD与MCI以及其两个亚型之间的关系,使用风险比(hazard ratio,HR)和95%可信区间(95% confidence intervals, 95%CI)描述分析结果。本研究共进行3个层面分析:第1层面结果排除年龄、性别和教育水平等一般参数的影响;第2层面结果排除上述一般参数、BDI-Ⅱ抑郁指数和脑卒中病史的影响;第3层面结果排除上述一般参数、BDI-Ⅱ抑郁指数和脑卒中病史以及血清ApoE分型(e4型和非e4型)、是否有吸烟史、糖尿病史、高血压病史、冠心病史和体质量指数的影响。所有统计学检测通过Graphpad Prism 5.0软件(La Jolla, CA, USA)完成。P≤0.05为差异具有统计学意义。
2 结 果
2.1 COPD可以明显增加MCI发生的危险 本研究中1 150例认知功能正常患者中共有850例接受本项目研究并完成最终随访调查。850例中有265例在随访期中被诊断患有MCI(31.2%),其中患有a-MCI的有173例(20.4%),na-MCI的有65例(7.6%),未知类型MCI的有10例(1.2%),17例在随访过程中被诊断为痴呆(2.0%)。研究的随访时间为3.5~6年,中位随访期为5.5年(IQR:3.5~6.0年)。在850位受检人群中,在研究开始时被诊断患有COPD共有132人。与未患有COPD的对照组相比,患有COPD组人群的年龄明显偏大(P=0.03),更多合并冠心病(P=0.04)、高血压病(P<0.01)以及多有吸烟史(P<0.01,表1)。排除年龄、性别和教育水平等一般参数以及BDI-Ⅱ抑郁指数和脑卒中病史的影响后分析发现,患有COPD的患者更容易发生MCI(HR1.93;95%CI:1.05~2.58;P<0.01,图1)。在上述结果的基础上继续排除BDI-Ⅱ抑郁指数和脑卒中病史以及血清ApoE分型(e4型和非e4型)、吸烟史、糖尿病史、高血压病史、冠心病史和体质量指数的影响后,分析发现COPD仍然明显提高患有MCI的风险(HR2.12; 95%CI:1.36~3.18;P<0.01,表2)。尤其是针对na-MCI的分析发现,COPD提高了na-MCI发病率2倍多(HR2.65;95%CI:1.86~3.89;P<0.01)。但是,研究发现COPD并没有增加患有a-MCI的风险(HR1.05;95%CI:0.25~1.48;P=0.07)。
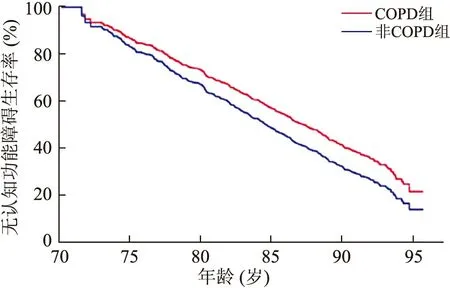
图1 Kaplan-Meier生存曲线分析COPD与MCI的关系Fig.1 Association between COPD and MCI by Kaplan-Meier survival curves
2.2 COPD病程越长越容易诱发MCI的发生 如图2所示,病程>5年的COPD患者发生MCI的风险比(HR2.31;95%CI:1.78~2.87;P<0.01)明显高于病程≤5年的COPD患者(HR1.62;95%CI:1.05~2.12;P<0.01)。同样,病程>5年的COPD患者发生na-MCI的风险比(HR2.52;95%CI:1.97~3.62;P<0.01)也明显高于病程≤5年的COPD患者(HR2.07;95%CI:1.67~2.83;P<0.01)(表3)。本研究并没有发现较长的COPD病程可以影响a-MCI的发病风险(HR0.97;95%CI:0.35~1.63;P=0.08)。

表1 基线检查的COPD组患者和非COPD组患者临床信息的比较Tab.1 Demographic information of patients in COPD and non-COPD groups

图2 Kaplan-Meier生存曲线分析不同病程COPD与MCI的关系Fig.2 Association between COPD with different course of disease and MCI by Kaplan-Meier survival curves
3 讨 论
前期研究显示COPD影响患者的注意力、记忆力以及执行能力,COPD病情越重影响越大[8-10]。但是,至今为止只有2篇多学科报道使用标准评估方法研究COPD与MCI之间的关系。其中1篇文献比较研究了呼吸内科门诊45例患有中重度COPD患者和

表2 COPD与MCI及其亚型间的关系Tab.2 The relationship of COPD with MCI and subtypes
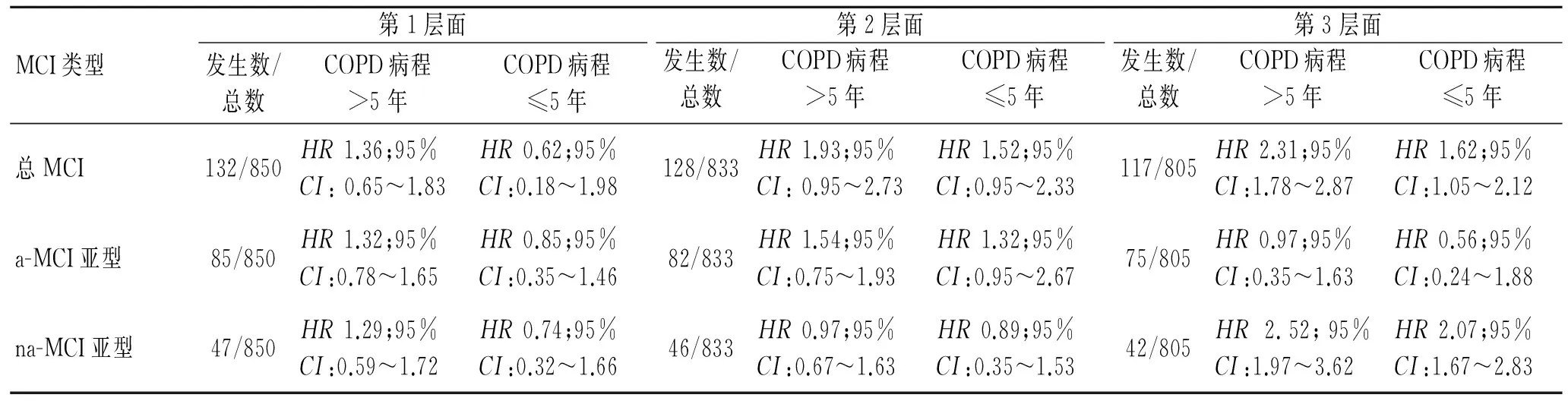
表3 COPD病程与MCI及其亚型间的关系Tab.3 The correlation between the course of COPD and MCI
RUSANEN研究小组[7]针对中年人群(39~64岁)研究发现,COPD明显提高MCI发生危险概率,但是老年人群(65~80岁)中COPD对MCI发生率无明显影响,其数据还显示COPD在一定程度上降低了老年人群的MCI患病率。本研究得出了相反的结果,我们发现COPD明显增加了MCI和na-MCI的发病率,而且COPD病程越长MCI和na-MCI发病率越高。通过比对这两个研究,我们发现可能存在3个原因导致本研究结果和RUSANEN课题组研究结论不一致:①RUSANEN的研究通过询问患者来确定是否患有COPD,而本研究通过调查门诊病历和相关检查结果确定是否患有COPD;②RUSANEN的研究中进行了初步筛选,只对可疑人群进行MCI相关检查并最终做出诊断,这样可能由于初步筛选错误导致部分MCI患者遗漏。而本研究对所有入选人群进行均质标准化随访和检查,确保没有遗漏MCI患者;③RUSANEN的研究是在接受基线检查后10年进行相关随访,而本研究是在基线检查后间隔15个月接受1次检查随访。COPD是一种致死性疾病,尤其中老年致死性更高,因此较长的随访间隔期可能导致生存期偏倚,并最终影响COPD和MCI相关性研究结果。
本研究发现COPD增加人群患MCI的风险,提示炎症以及心血管疾病可能参与到na-MCI发病机制中。研究发现COPD患者体内具有较多的炎症因子,如白细胞介素6、白细胞介素8、C反应蛋白、白三烯B4、肿瘤坏死因子α等[11-13]。而这些炎症因子均在MCI发病中起重要作用[14-16]。另一方面,COPD显著增加了心血管疾病的发生率[17],而心血管疾病被认为是MCI发生的重要危险因素[18-20]。更为重要的是,本研究发现排除心血管疾病影响,COPD仍然是诱发MCI的独立危险因素。COPD患者血氧饱和度较低且其颅内灌注压较低导致脑组织供氧不足,产生大量氧自由基、炎症因子,进而导致神经元损伤和胶质细胞激活[21]。研究表明,脑组织供氧不足可导致注意力不集中,进而影响执行力[22],这也可以部分解释本研究发现COPD诱发MCI的结果。ORTAPAMUK等[4]报道血氧饱和度较低的COPD患者更容易患有MCI,这证实了低氧血症在COPD诱发MCI中的作用。血浆凝集素(clusterin)可能是另一种COPD诱发MCI的关键因子。研究发现血浆凝集素在COPD患者血液中水平明显升高,且其血液中的水平与认知功能损害呈正相关关系[23]。
相比较本领域之前的研究,本研究具有以下2个重要特点:①神经内科护士进行相关访视,由神经内科医师和精神卫生科医师共同使用标准化量表进行MCI的诊断和分型;②诊断医师团队不知晓受检人群的相关病史,即采用盲法分组。总之,通过本次大样本纵向队列研究,我们发现COPD明显增加了中老年人群MCI(尤其是na-MCI)的发生率,而且COPD严重程度与MCI发生率呈正相关关系。这些数据说明COPD是MCI发生的危险因素,早期干预COPD可以预防或延缓MCI的发生或进展。
[1] RABE KF, HURD S, ANZUETO A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary[J]. Am J Respir Crit Care Med, 2007, 176(6):532-555.
[2] LI J, HUANG Y, FEI GH. The evaluation of cognitive impairment and relevant factors in patients with chronic obstructive pulmonary disease[J]. Respiration, 2013, 85(2):98-105.
[3] DODD JW, GETOV SV, JONES PW. Cognitive function in COPD[J]. Eur Respir J, 2010, 35(4):913-922.
[4] ORTAPAMUK H, NALDOKEN S. Brain perfusion abnormalities in chronic obstructive pulmonary disease: comparison with cognitive impairment[J]. Ann Nucl Med, 2006, 20(2):99-106.
[5] SINGH B, ARSAIK AK, MIELKE MM, et al. Chronic obstructive pulmonary disease is associated with mild cognitive impairment: the Mayo Clinic Study of Aging[J]. Mayo Clin Proc, 2013, 88(11):1222-1230.
[6] VILLENEUVE S, PEPIN V, RAHAYEL S, et al. Mild cognitive impairment in moderate to severe COPD: a preliminary study[J]. Chest, 2012, 142(6):1516-1523.
[7] RUSANEN M, NGANDU T, LAATIKAINEN T, et al. Chronic obstructive pulmonary disease and asthma and the risk of mild cognitive impairment and dementia: a population based CAIDE study[J]. Curr Alzheimer Res, 2013, 10(5):549-555.
[8] SCHOU L, OSTERAGAARD B, RASMUSSEN LS, et al. Cognitive dysfunction in patients with chronic obstructive pulmonary disease--a systematic review[J]. Respir Med, 2012,106(8):1071-1081.
[9] INCALZI RA, GEMMA A, MARRA C, et al. Chronic obstructive pulmonary disease. An original model of cognitive decline[J]. Am Rev Respir Dis, 1993, 148(2):418-424.
[10] 冯芳,陈长香,陈桂芝. 老年慢性阻塞性肺疾病患者记忆障碍的病例对照研究[J]. 吉林大学学报(医学版), 2012, 38(2):324-327.
[11] BARNES PJ. Chronic obstructive pulmonary disease[J]. N Engl J Med, 2000, 343(4):269-280.
[12] HILL AT, BAYLEY D, STOCKLEY RA. The interrelationship of sputum inflammatory markers in patients with chronic bronchitis[J]. Am J Respir Crit Care Med, 1999, 160(3):893-898.
[13] KEATINGS VM, COLLINS PD, SCOTT DM, et al. Differences in interleukin-8 and tumor necrosis factor-alpha in induced sputum from patients with chronic obstructive pulmonary disease or asthma[J]. Am J Respir Crit Care Med, 1996, 153(2):530-534.
[14] ROBERTS RO, GEDA YE, KNOPMAN DS, et al. Association of C-reactive protein with mild cognitive impairment[J]. Alzheimer’s Dement, 2009, 5(5):398-405.
[15] ROBERTS RO, GEDA YE, KNOPMAN DS, et al. Metabolic syndrome, inflammation, and nonamnestic mild cognitive impairment in older persons: a population-based Study[J]. Alzheimer Dis Assoc Disord, 2010, 24(1):11-18.
[16] YAFFE K, LINDQUIST K, PENNINX BW, et al. Inflammatory markers and cognition in well-functioning African-American and white elders[J]. Neurology, 2003,61(1):76-80.
[17] MULLEROVA H, AGUSTI A, ERQOU S, et al. Cardiovascular comorbidity in COPD: Systematic literature review[J]. Chest, 2013, 144(4):1163-1178.
[18] ROBERS RO, GEDA YE, KNOPMAN DS, et al. Cardiac disease associated with increased risk of nonamnestic cognitive impairment: stronger effect on women[J]. JAMA Neurol, 2013, 70(3):374-382.
[19] ETTORRE E, CERRA E, MARIGLIANO B, et al. Role of cardiovascular risk factors (CRF) in the patients with mild cognitive impairment (MCI)[J]. Arch Gerontol Geriatr, 2012, 54(2):330-332.
[20] WYSOCKI M, LUO X, SCHMEIDLER J, et al. Hypertension is associated with cognitive decline in elderly people at high risk for dementia[J]. Am J Geriatr Psychiatry, 2012, 20(2):179-187.
[21] DE LA TORRE JC. Critical threshold cerebral hypoperfusion causes Alzheimer’s disease?[J]. Acta Neuropathol, 1999, 98(1):1-8.
[22] STUSS DT, PETERKINI, GUZMAN DA, et al. Chronic obstructive pulmonary disease: effects of hypoxia on neurological and neuropsychological measures[J]. J Clin Exp Neuropsychol, 1997, 19(4):515-524.
[23] SCHRIJVERS EM, KOUDSTAAL PJ, HOFMAN A, et al. Plasma clusterin and the risk of Alzheimer disease[J]. JAMA, 2011, 305(13):1322-1326.
(编辑 韩维栋)
Association between chronic obstructive pulmonary disease and the risk for mild cognitive impairment: a retrospective cohort study
FENG Ai-fang1, WANG Liang2, LI Jing3, YANG Qin-ling1, ZHANG Yu-lin1
(1. Department of Hepatobiliary; 2. Department of Neurology; 3. Department of Respiratory,the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
Objective Cross-sectional relationship between chronic obstructive pulmonary disease (COPD) and mild cognitive impairment (MCI) has been found according to recent literature. The present study intends to explore whether COPD is an increased risk for MCI. Methods We randomly selected 850 cognitively normal individuals aged 70-90 years from the outpatient department of the First Affiliated Hospital, Xi’an Jiaotong University, using the medical records linkage system. All the individuals were examined with an interview, neurological examination and neuropsychological testing at baseline and every 15 months thereafter. COPD was assessed as a risk factor for MCI and its subtype with the help of Cox proportional hazards models. Results During the follow-up (range: 3.5-6.0 years, median value: 5.5 years ), 265 out of 850 recruited individuals developed MCI. COPD led to an increased risk for MCI (HR2.12; 95%CI: 1.36-3.18;P<0.01) and non-amnestic mild cognitive impairment (na-MCI) (HR2.65; 95%CI: 1.86-3.89;P<0.01). Cox multi-factor analysis revealed that COPD was not an independent risk factor for MCI or a-MCI. We found a positive correlation of COPD severity with the incidence of MCI (HR2.52; 95%CI: 1.97-3.62;P<0.01) and na-MCI (HR2.07; 95%CI:1.67-2.83;P<0.01) in subjects with chronic COPD. Conclusion The data here support that COPD is a risk factor for MCI and the two are positively correlated. Early intervention is important in preventing or delaying the onset and progression of MCI.
chronic obstructive pulmonary disease (COPD); mild cognitive impairment (MCI); retrospective cohort study; Cox proportional hazards model
2016-03-17
2016-05-13
冯爱芳. E-mail: 876987261@qq.com
R749
A
10.7652/jdyxb201606019
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20161013.1417.018.html(2016-10-13)

