术后辅助放疗可提高HPV16阴性Ⅱa期食管鳞癌患者根治术后的生存率
张 丽,席儒兴,宋张骏,车少敏,张晓智
(1. 西安交通大学医学部附属陕西省肿瘤医院乳腺病院,陕西西安 710061;2. 西安交通大学第一附属医院肿瘤放疗科,陕西西安 710061)
◇临床研究◇
术后辅助放疗可提高HPV16阴性Ⅱa期食管鳞癌患者根治术后的生存率
张 丽1,2,席儒兴2,宋张骏1,车少敏2,张晓智2
(1. 西安交通大学医学部附属陕西省肿瘤医院乳腺病院,陕西西安 710061;2. 西安交通大学第一附属医院肿瘤放疗科,陕西西安 710061)
目的 回顾性分析术后辅助放疗对HPV16相关Ⅱa(pT3)期食管鳞癌根治术后患者长期生存的价值。方法 选取2007年1月至2009年9月期间,西安交通大学第一附属医院术后病理分期为Ⅱa(pT3)期食管鳞癌患者的97例病理标本以及54例正常食管黏膜或癌旁组织标本,采用免疫组化法检测HPV16E6、p75NTR及P13K的表达,并分析HPV16、PI3K与患者的临床特征、预后之间的相关性,以及术后辅助放疗对Ⅱa(pT3)期食管鳞癌患者术后生存率的影响。结果 97例Ⅱa(pT3)期食管鳞癌组织的HPV16E6和PI3K的表达阳性率分别为64.9%、69.1%;全组患者5年生存率42.3%,中位生存期52个月;HPV16阴性与阳性的5年生存率分别为67.6%、25.3%,术后放疗与未放疗的5年生存率分别为60.9%和31.9%,差异均有统计学意义(P<0.05)。分层分析示,HPV16阴性者术后放疗与未放疗的5年生存率分别为69.0%和38.7%,差异有统计学意义(P=0.040)。亚组分析示,HPV16阴性组中年龄≤61.5岁、女性、无吸烟史者应用术后辅助放疗提高生存率更明显,差异均有统计学意义(P<0.05)。结论 HPV16可能是通过激活PI3K/AKT信号通路,改变了Ⅱa期食管鳞癌患者固有的辐射敏感性。术后辅助放疗只能提高HPV16阴性Ⅱa期食管鳞癌患者根治术后的生存率。
食管鳞状细胞癌;HPV16;PI3K;p75NTR;术后辅助放疗;生存率
食管癌是一种常见的恶性肿瘤,2015年美国癌症学会公布的全球肿瘤流行病学统计数据显示,全世界食管癌新发病例455 800例,死亡病例达400 200例[1]。我国食管癌的发病率和死亡率一直位居世界前列,2015中国肿瘤登记年报统计数据显示食管癌的发病率居我国各类恶性肿瘤第5位,死亡率高居肿瘤相关死亡的第4位,5年生存率仅为20.9%[2]。
手术是早中期食管癌最常用的根治性治疗手段,但其治疗效果也并不理想,局部复发是治疗失败的主要原因,根治术后的局部复发率仍在41.5%~49%[3]。对国际抗癌联盟(UICC)分期为Ⅲ期的术后食管癌患者,术后放疗不仅可以提高无病生存率,还可以延长总生存率,已为目前推荐的标准治疗模式[4]。但术后UICC分期为Ⅱa期者,是否需要行术后辅助性放疗或/和化疗,目前仍有较大争议。有研究回顾性分析了820例术后病理分期为Ⅱa期的食管鳞癌患者的预后不良因素[5],建立了包括9个独立预后不良因素的Nomogram预后预测模型,通过该模型计算出高危患者术后5年生存率(37.4%)与术后Ⅲa期患者生存率相似,而低危患者5年生存率(85.9%)与Ⅰa期相似[6],说明该期别的患者预后存在高度异质性。因此,在分子水平上寻找Ⅱa期食管鳞癌预后不良因素及放疗不敏感因素,可为食管鳞癌个体化治疗提供依据。联合应用相关标志物检测,早期鉴别其对患者预后的影响,采取相应的干预措施,是目前食管癌临床研究和治疗的重要方向。
我们前期研究发现,陕西地区食管鳞癌中人乳头瘤状病毒16(HPV16)感染率较高[7],可能是食管鳞癌发病的危险因素之一。HPV16E6、神经营养素低亲和型受体(p75NTR)及磷脂酰肌醇-3激酶(PI3K)蛋白表达增强是食管癌患者的预后不良因素。针对术后辅助放疗能否提高HPV16相关Ⅱa期食管鳞癌患者的生存率,本研究回顾性分析西安交通大学第一附属医院2007-2009年行根治性切除、且术后病理分期为Ⅱa期的食管鳞癌病例资料,基于HPV16感染状态分析术后辅助放疗对食管鳞癌患者术后长期生存的影响,为临床选择辅助性治疗方法提供参考和依据。
1 对象与方法
1.1 研究对象 选择自2007年1月至2009年9月在西安交通大学第一附属医院行手术且术后病理分期为Ⅱa期的食管鳞癌患者为研究对象,共97例。入组标准:所有病例均经病理确诊为胸上中段原发性食管鳞状细胞癌;依据UICC分期为Ⅱa期,即TNM分期为T2N0M0和T3N0M0;术前未接受过放疗和/或化疗,术后辅助性放疗者均完成放疗计划DT50 Gy/25f,其中胸上段肿瘤放疗靶区为上界至环甲膜、下界至隆突下2.5 cm,并包括吻合口及相应的淋巴结引流区;胸中段肿瘤放疗靶区为上界至胸1椎体上缘,下界至瘤床下缘3 cm,吻合口及相应的纵膈淋巴结引流区;卡氏评分(KPS)≥70分;术前经CT、B超及临床查体等证实无远处转移;病例资料记录完整。
1.2 临床资料收集 收集食管鳞癌患者年龄、性别、吸烟史、饮酒史、肿瘤分化、病理分型等方面详细的资料。
1.3 组织标本收集及免疫组化染色 从病理科获取患者的病理报告,并调取其存档石蜡块,做4 μm厚的连续切片,免疫组化染色检测组织标本中HPV16、PI3K及p75NTR的表达。严格按照SP法染色试剂盒的推荐步骤进行操作。分别选择一抗鼠单克隆抗HPV16E6蛋白[mouse momoclonal, (C1P5) to HPV16 E6, Abcam]、兔多克隆抗人p75NTR(MAB367; R&D Systems, Inc., Minneapolis, MN, USA)和兔多克隆抗人PI3K((#4249; Cell Signaling Technology, Danvers, MA, USA)。正常上皮组织中HPV16E6、PI3K及p75NTR的染色阳性作为阳性对照,未添加一抗的组织染色作为阴性对照。
结果判定:在高倍镜下(×400)每张切片随机选取5个视野,计数染色阳性细胞比例并评价染色深度。未见阳性细胞为0分,阳性细胞占比≤10%为1分,>10%且≤50%为2分,>50%且≤75%为3分,>75%为4分。染色阴性为0分,染色弱阳性为1分,染色中等阳性为2分,染色强阳性为3分。两者得分相乘,综合得分≥4分认为是阳性,反之则为阴性。免疫组织化学染色结果由2名不了解患者临床资料的高年资病理科医师独立判读,结果分级差异由2位医师讨论后获得一致性。
1.4 相关性分析 分析HPV16、PI3K及p75NTR免疫组化染色结果与患者预后的相关性;分析术后辅助放疗对HPV16相关食管鳞癌患者生存率的影响。
1.5 随访 随访时间按月计算,每位患者随访截至其治疗后5年或死亡,最后1次随访时间为2014年9月,97例食管鳞癌患者治疗结束后前2年每3个月复查1次,2年后每半年复查1次直至死亡或治疗后5年,随访内容包括一般状况、体格检查、影像学检查、生化检查以及生存质量记录。总生存期(overall survival, OS)为患者接受治疗之日起至因任何原因引起死亡的时间。
1.6 统计学分析 采用SPSS 19.0软件和Graphpad Prism5软件进行统计分析。计数资料的组间比较用卡方检验;相关性分析用Pearson检验;单因素生存分析用Kaplan-Meier生存曲线和Log-rank检验;多因素生存分析用Cox回归模型,生存曲线图用Graphpad Prism5软件;Cox比例风险模型确定变量的风险比(hazard ratio, HR),P<0.05为差异具有统计学意义。
2 结 果
2.1 食管鳞癌组织中HPV16、PI3K和p75NTR的表达 HPV16E6蛋白免疫组化染色主要位于ESCC细胞核和细胞质内,p75NTR及PI3K蛋白主要位于细胞质和细胞膜内(图1)。HPV16E6、PI3K的表达阳性率分别为64.9%、69.1%。Pearson相关分析结果显示,PI3K蛋白和HPV16E6蛋白表达阳性率呈正相关(r=0.350,P=0.001),HPV16E6蛋白与p75NTR蛋白的表达阳性率呈正相关(r=0.642,P<0.001)。p75NTR与PI3K的表达无明显相关性(r=0.168,P>0.05)。
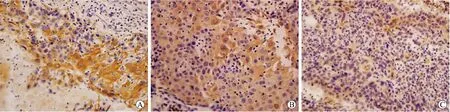
图1 食管鳞癌组织中HPV16、p75NTR和PI3K的免疫组化染色Fig.1 The expressions of HPV16 E6, p75NTR, and PI3K in ESCC tissues detected by immunohistochemical staining (×40)
2.2 患者总体生存情况 全组97例患者随访截至2014年9月,收集了94例患者的随访记录,失访3例,随访率为96.9%。随访期间共有56例死亡,全组自手术之日起的5年生存率为42.3%,中位生存期为52月。总生存曲线图见图2。

图2 Ⅱa期食管鳞癌患者的5年总生存曲线Fig.2 5-year overall survival curve of ESCC patients
2.3 Ⅱa期食管鳞癌患者预后的单因素分析 Kaplan-Meier分析显示,与预后有关的因素有年龄、性别、吸烟史、术后放疗、HPV16E6、p75NTR及PI3K表达情况(P<0.05)。HPV16阴性者和阳性者5年生存率分别为67.6%、25.3%,差异有统计学意义(P=0.001,图3);而饮酒史、肿瘤分化程度、病理分型与预后无显著相关,差异无统计学意义(P>0.05,表1)。
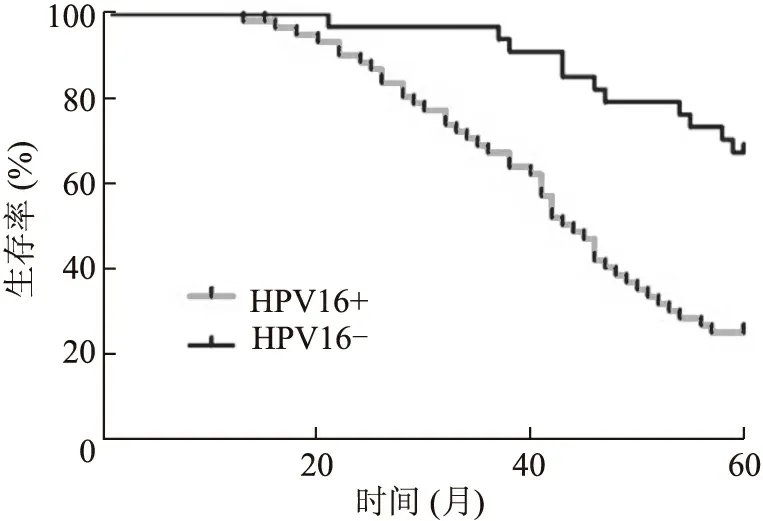
图3 HPV不同感染状态的Ⅱa期食管鳞癌患者生存曲线Fig.3 Survival curves of 5-year OS of ESCC patients according to HPV16 expression
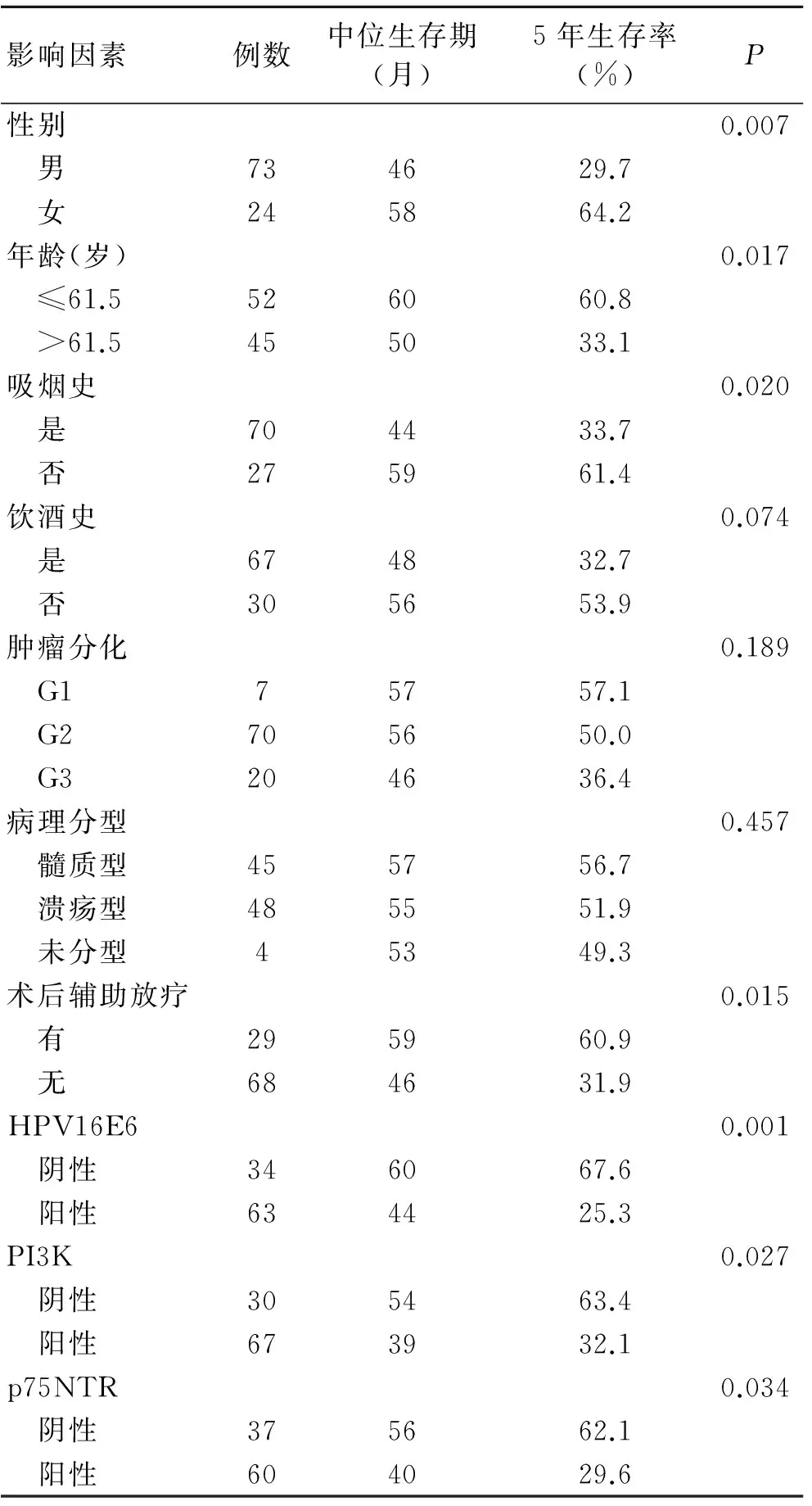
表1 影响Ⅱa期食管鳞癌患者预后的单因素分析Tab.1 Kaplan-Meier analysis of the survival of stage IIa ESCC patients
2.4 Ⅱa期食管鳞癌患者预后的多因素分析 将年龄、性别、吸烟史、饮酒史、肿瘤分化、病理分型、HPV16E6、p75NTR、PI3K等多项纳入多变量分析显示,性别、吸烟史、HPV16、PI3K是判断患者预后的指标,男性、有吸烟史者预示较差的5年OS,HPV16阳性者5年OS差于HPV16阴性者(表2)。

表2 影响Ⅱa期食管鳞癌患者预后的多因素分析Tab.2 Multivariate analysis of the survival of stage Ⅱa ESCC patients
2.5 术后放疗对食管鳞癌患者术后生存率的影响 94例Ⅱa期食管鳞癌患者中,术后行辅助放疗者27例,未行辅助放疗者67例,术后放疗与未放疗的5年生存率分别为60.9%和31.9%,中位生存期分别为59个月与46个月,差异有统计学意义(P=0.015)。
分层分析显示,HPV16阳性者术后放疗与未放疗的5年生存率分别为31.7%和22.3%,差异无统计学意义(P>0.05);HPV16阴性者术后放疗与未放疗的5年生存率分别为69.0%和38.7%,差异有统计学意义(P=0.040),术后辅助放疗提高了HPV16阴性者的生存率(表3)。
进一步亚组分析显示,在HPV16阴性者中,年龄≤61.5岁组术后放疗与未放疗的5年生存率分别为37.7%和70.6%,差异有统计学意义(P=0.032);女性患者术后放疗与未放疗的5年生存率分别为67.7%和52.5%,差异有统计学意义(P=0.038);不吸烟者术后放疗与未放疗的5年生存率分别为72.7%和40.3%,差异有统计学意义(P=0.017,表4)。

表3 术后放疗对HPV相关Ⅱa期ESCC生存率影响的分析Tab.3 Effect of postoperative radiotherapy on the survival of stage IIa ESCC patients
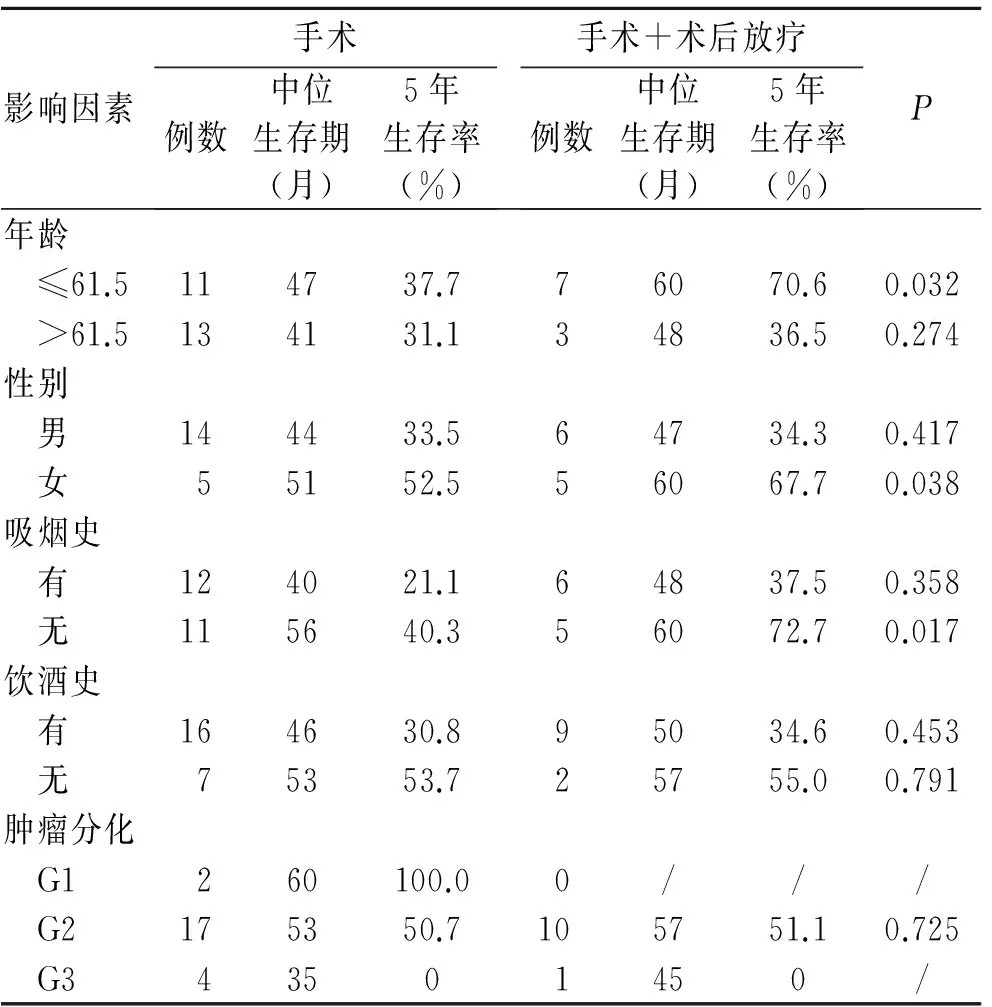
表4 术后放疗对HPV16阴性Ⅱa期ESCC生存率影响的分层分析Tab.4 Subgroup analysis of the survival of HPV-negative stage Ⅱa ESCC patients
3 讨 论
自1982年SYRJANEN[8]首次提出并证实高危型HPV感染与食管癌存在相关性后,许多学者关注并研究了高危型HPV,尤其HPV16,在食管鳞癌中的感染状态以及预后价值。我们的前期研究发现,在陕西地区感染HPV16的食管鳞癌患者预后较差,并且HPV16感染与PI3K/Akt信号通路活化密切相关。食管上皮细胞中的p75NTR阳性细胞具有增殖、自我更新及多向分化能力,鉴定其为食管上皮干细胞。而肿瘤干细胞的“逃逸”和某些异常信号通路持续激活导致肿瘤细胞在放疗后重新进入细胞周期和增殖,是肿瘤放疗抗拒的主要机制[9-10],PI3K/AKT信号通路活化后延长DNA已发生损伤的肿瘤细胞的存活,产生辐射抵抗,在肿瘤细胞中通过选择性抑制PI3K或AKT,其辐射敏感性增强[11]。高危型HPV所编码的多个蛋白(如VLPs、E5、E6和E7等)也都能激活PI3K/Akt信号通路,促进细胞存活,造成辐射抵抗[12-13]。
本研究发现HPV16E6蛋白在Ⅱa期食管鳞癌组织中的阳性表达率为64.9%,PI3K蛋白的阳性表达率为69.1%。PI3K蛋白和HPV16E6蛋白之间呈正相关(r=0.350,P=0.001),HPV16E6蛋白与p75NTR蛋白的表达呈正相关(r=0.642,P<0.001)。p75NTR与PI3K的表达无明显相关性(r=0.168,P>0.05)。HPV16E6表达阳性或PI3K表达阳性患者均提示有较差的5年OS,HPV16阴性者5年生存率67.6%,HPV16阳性者5年生存率25.3%,差异有统计学意义(P=0.001)。与我们前期的研究结果相符[7]。
本研究单因素分析显示,性别是预后影响因素之一,女性患者5年生存率显著高于男性患者(P=0.007);多因素分析结果也显示,性别是患者独立预后因素,这与其他研究结论一致[14]。一直以来,吸烟被认为是食管癌发病的重要危险因素。本研究显示,有吸烟史者预后差于无吸烟史者,差异有统计学意义(P=0.020),表明吸烟是患者预后的独立因素。这与一些学者的报道一致,如SITU等[15]通过COX多因素分析证实吸烟是影响pT3N0M0期食管鳞癌患者预后的独立因素。
食管鳞癌根治术后放疗能否提高Ⅱa期食管鳞癌患者生存率,目前仍有争议。有研究证实食管鳞癌根治术后辅助放疗对于Ⅱa期的食管鳞癌患者有生存获益[16],能降低放疗部位的复发,改善总生存率[17]。对于根治性手术后中上段Ⅱa期食管鳞癌患者推荐术后放疗。也有研究显示术前未接受任何治疗的R0切除的食管鳞癌患者,无论淋巴结阳性与否,术后放疗反而降低了生存率、无生存获益[18]。2013年ASTRO会议上报道581例Ⅱa期的胸段食管癌患者手术组和术后放疗组的5年生存率分别为59.2%、72.3%[19],认为术后辅助放疗对Ⅱa期患者有生存获益。本研究单因素分析结果显示,术后行辅助放疗者和单纯手术者5年生存率分别为60.9%、31.9%,差异有统计学意义(P=0.015)。术后辅助放疗能提高Ⅱa期食管鳞癌患者的生存率。
多项基础研究及临床试验均发现HPV感染相关肿瘤具有独特的分子生物学机制和临床特点。有研究报道,由于PI3K/AKT通路的激活,HPV阳性的头颈部鳞癌细胞系的辐射抵抗性明显高于HPV阴性的细胞系[20]。还有研究发现,HPV感染相关宫颈癌细胞株对放疗不敏感,阻断E6蛋白的表达后,宫颈癌细胞株对放射治疗的敏感性显著增强[21]。本研究进一步基于食管鳞癌患者HPV16感染状态的不同,进行分层分析,探讨在HPV感染的情况下,术后辅助放疗对Ⅱa期患者的生存获益,结果发现在HPV16阴性的Ⅱa期食管鳞癌患者中,单纯手术与手术+术后放疗的5年生存率差异有统计学意义(P=0.040),而HPV16阳性的Ⅱa期食管鳞癌患者中,单纯手术与手术+术后放疗的5年生存率差异无统计学意义(P=0.512)。术后辅助放疗只能提高HPV阴性Ⅱa期食管鳞癌患者的生存率。此外,免疫组化检测结果显示食管鳞癌患者组织中PI3K表达与HPV16感染有相关性,提示可能与HPV16阳性食管鳞癌患者组织中PI3K通路的活化并导致辐射抵抗有关。
本研究在HPV16阴性患者中进一步进行亚组分析显示,术后辅助放疗对HPV16阴性组中年龄≤61.5岁、女性、无吸烟史者的生存率提高更明显。这可能与年轻患者合并症少、女性及无吸烟史者HPV16感染率较低有关。当然,对于此期别HPV16感染相关食管鳞癌患者术后辅助性放疗的价值,还有待大样本研究或者前瞻性研究。
[1] TORRE LA, RAY FB, SIEGEL RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[2] CHEN WQ, ZHENG RS, BAADE PD, et al. Cancer Statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2):115-132.
[3] VISBAL AL, AUEN MS, MILLER DL, et al. Ivor Lewis esophagogastrectomy for esophageal cancer[J]. Ann Thorac Surg, 2001, 6(71):1803-1808.
[4] XIAO ZF, YANG ZY, MIAO YJ, et al. Influence of number of metastatic lymph nodes on survival of curative resected thoracic esophageal cancer patients and value of radiotherapy: report of 549 cases[J]. Int J Radiat Oncol Biol Phys, 2005, 1(62):82-90.
[5] 杨劲松,章文成,肖泽芬,等. 术后辅助3DRT改善pT2_3N0M0期食管癌患者长期生存[J]. 中华放射肿瘤学杂志, 2015, 24(2):101-105.
[6] WANG J, WU N, ZHENG QF, et al. Evaluation of the 7thedition of the TNM classification in patients with resected esophageal squamous cell carcinoma[J]. World J Gastroenterol, 2014, 20(48):18397-18403.
[7] XI RX, ZHANG XZ, CHEN X, et al. Human papilloma virus 16 infection predicts poor outcome in patients with esophageal squamous cell carcinoma[J]. Onco Targets Ther, 2015, (8):573-581.
[9] MANNINO M, CHALMERS AJ. Radioresistance of glioma stem cells: intrinsic characteristic or property of the 'microenvironment-stem cell unit?[J]. Mol Oncol, 2011, 5(4):374-386.
[10] WANG WJ, WU SP, LIU JB, et al. MYC Regulation of CHK1 and CHK2 promotes radioresistance in a stem cell-like population of nasopharyngeal carcinoma cells[J]. Cancer Res, 2013, 73(3):1219-1231.
[11] ZHANG T, SUN Q, LIU T, et al. MiR-451 increases radiosensitivity of nasopharyngeal carcinoma cells by targeting ras-related protein 14(RAB14)[J]. Tumor Biol, 2014, 35(12):12593-12599.
[12] PIM D, MASSIMI P, DILWORTH SM, et al. Activation of the protein kinase B pathway by the HPV-16 E7oncoprotein occurs through a mechanism involving interaction with PP2A[J]. Oncogene, 2005, 24(53):7830-7838.
[13] CONTRERAS-PAREDES A, DE LA CRUZ-HERNANDEZ E, MARTINEZ-RAMIREZI, et al. E6 variants of human papilloma virus 18 differentially modulate the protein kinase B/phosphatidylinositol 3-kinase (Akt/PI3K) signaling pathway[J]. Virology, 2009, 383(1):78-85.
[14] CHEN JQ, ZHU J, PAN JQ, et al. Postoperative radiotherapy improved survival of poor prognostic squamous cell carcinoma esophagus[J]. Ann Thorac Surg, 2010, 90(2):435-442.
[15] SITU D, WEI W, LIN P, et al. Do tumor grade and location affect survival in esophageal squamous cell carcinoma? Survival analysis of 302 cases of pT3N0M0 esophageal squamous cell carcinoma[J]. Ann Surg Oncol, 2013, 20(2):580-585.
[16] SCHREIBER D, R INEER J, VONGTAMA D, et a1. Impact of postoperative radiation after esophagectomy for esophageal cancer[J]. J Thorac Oncol, 2010, 2(5):244-250.
[17] CHEN J, PAN J, LIU J, et al. Postoperative radiation therapy with or without concurrent chemotherapy for node-positive thoracic esophageal squamous cellcarcinoma[J]. Int J Radiat Oncol Biol Phys, 2013, 86(4):671-677.
[18] SHRIDHAR R, WEBER J, HOFFE SE, et al. Adjuvant radiation therapy and lymphadenectomy in esophageal cancer: a SEER database analysis[J]. J Gastrointest Surg, 2013, 17(8):1339-4516.
[19] LIU X, XIAO Z, ZHANG W, et al. Patterns of recurrence after radical esophagectomy and impact of postoperative radiation for thoracic esophageal squamous cell carcinoma with pT2-T3N0M0disease[J]. Int J Radiat Oncol Biol Phys, 2013, 87(2):S190-S191.
[20] GUPTA AK, LEE JH, WILKE WW, et al. Radiation response in two HPV-infected head-and-neck cancer cell lines in comparison to a non-HPV-infected cell line and relationship to signaling through AKT[J]. Int J Radiat Oncol Biol Phys, 2009, 74(3):928-933.
[21] 饶智国,张积仁,郑燕芳,等. 抗HPV16E6核酶对宫颈癌CaSKi细胞放疗影响的研究[J]. 癌症, 2002, 22(2):249-252.
(编辑 国 荣)
Postoperative adjuvant radiotherapy improves the survival of HPV16 negative esophageal squamous cell carcinoma at stageⅡa
ZHANG Li1,2, XI Ru-xing2, SONG Zhang-jun1, CHE Shao-min2, ZHANG Xiao-zhi2
(1. Mammary Gland Hospital, the Affiliated Shaanxi Provincial Tumor Hospital of Xi’an Jiaotong University Health Science Center, Xi’an 710061;2. Department of Radiotherapy, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To explore the prognostic factors and significance of postoperative adjuvant radiotherapy for HPV16-associated esophageal squamous cell carcinoma (ESCC) patients at UICC stage Ⅱa. Methods Pathological specimens of 97 patients with ESCC at stage IIa and esophageal mucosa or paracancerous tissues of 54 normal subjects in the First Affiliated Hospital of Xi’an Jiaotong University from January 2007 to September 2009 were retrospectively analyzed for the expressions of HPV16E6, p75NTR and PI3K using immunohistochemistry, their correlation with the patients’ clinical characteristics and prognosis, as well as the impact of postoperative adjuvant radiotherapy on the survival rate of patients with ESCC at stage Ⅱa. Results The expression of HPV E6 was 64.9% in ESCC. The 5-year overall survival rates was 42.3%, and the median was 52 months. The 5-year survival rates of HPV16 negative and HPV16 positive were 67.6% and 25.3%, respectively (P<0.001). The 5-year survival rates of adjuvant radiotherapy and non-radiotherapy were 60.9% and 31.9%, respectively (P=0.015). Stratification analysis showed that with or without adjuvant radiotherapy in HPV16 negative group, the 5-year survival rate was 69% and 38.7%, respectively (P=0.04). Subgroup analysis showed that postoperative adjuvant radiotherapy could only improve the 5-year survival rate of stage IIa ESCC patients who were HPV16 negative and ≤61.5 years old, or HPV16 negative females, or HPV16 negative non-smokers (P<0.05). Conclusion HPV16 infection may activate PI3K/AKT signaling pathway and alter the intrinsic radiosensitivity of patients at early stage in ESCC. Overall, postoperative adjuvant radiotherapy could improve the survival rate of HPV16 negative patients with ESCC.
esophageal squamous cell carcinoma; HPV16; PI3K; p75NTR; postoperative adjuvant radiotherapy; survival rate
2016-03-09
2016-05-31
国家自然科学基金资助项目(No.81201922)
Supported by the National Natural Science Foundation of China (No.81201922)
张晓智. E-mail: zhang9149@sina.com
R735.1
A
10.7652/jdyxb201606017
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20161013.0941.008.html(2016-10-13)

