ERRα/γ的能量代谢调节作用及其与HIF、运动关系研究进展
姬卫秀 张缨
北京体育大学运动人体科学学院(北京 100084)
ERRα/γ的能量代谢调节作用及其与HIF、运动关系研究进展
姬卫秀 张缨
北京体育大学运动人体科学学院(北京 100084)
雌激素相关受体(ERRs)家族的两个成员ERRα和ERRγ与机体能量代谢关系密切。近年来研究发现,ERRs与肥胖、2型糖尿病等代谢性疾病密切相关,ERRs对葡萄糖和脂肪酸有氧氧化以及线粒体能量代谢的调节作用引起了人们的关注。运动有利于改善肥胖、2型糖尿病和心血管疾病等代谢性疾病的临床症状。低氧运动渐受推崇,而低氧诱导因子(HIF)在细胞的低氧应答中起关键调节作用。本综述以ERRα/γ为切入点,对ERRα/γ在糖代谢、脂肪酸氧化和线粒体生物合成等方面的作用,以及ERRα/γ与HIF、运动之间关系的相关研究进展进行概述和归纳,为运动训练、运动对代谢性疾病的防治等相关领域的研究提供理论参考。
运动;ERRα;ERRγ;能量代谢
1998年人类发现了一种与雌激素受体在结构上具有很高同源性的新基因,可直接或间接地参与雌激素的应答反应,故被称之为雌激素相关受体(estrogenrelated receptors,ERRs)[1]。由于目前暂未发现ERRs的内源性配体,因此其又称为孤儿核受体。在无外源配体的情况下,ERRs的转录因子活性可以在辅激活因子,如过氧化物酶增殖激活物受体γ辅激活因子1α(PGC-1α)的存在下,以非配体依赖性方式被激活,从而与其靶基因启动子上相应序列结合,激活靶基因的转录,进而参与机体的代谢调节[2],如图1。ERRs有3个家族成员:ERRα、ERRβ、ERRγ。目前研究主要集中在ERRα和ERRγ。

图1 PGC-1α/ERRs的功能调节作用
与大多数核受体一样,ERRs含有高度保守的配体结合域(LBD)、DNA结合域(DBD)和保守度较低的N端结构域(NTD),如图2。DBD包含2个锌指结构,可识别和结合靶基因DNA上的雌激素相关受体反应元件(ERRE);LBD可与配体或辅激活因子结合;NTD主要参与ERRs蛋白的共价修饰。此外,ERRs还包含两个激活功能域,即包含在NTD中的活化功能区1(AF1)和LBD中的AF2,它们主要负责转录激活,调节ERRs的转录活性[3]。ERRα和ERRγ的氨基酸序列具有很高的同源性,它们可能结合相同的配体和靶基因序列,并在同一反应中发挥相同调节作用[4]。

图2 ERRs蛋白结构简图
早期对ERRs的研究主要集中在雌激素信号调节的相关方面,如骨质疏松和乳腺癌的发生等[5]。近年来研究发现,ERRs与肥胖、2型糖尿病等代谢性疾病密切相关,ERRs对葡萄糖和脂肪酸有氧氧化以及线粒体能量代谢的调节作用引起了人们的关注。
1 ERRα/γ的能量代谢调节作用
1.1 ERRα/γ对脂代谢的影响
中链乙酰辅酶A脱氢酶(MCAD)是脂肪酸β氧化的关键限速酶[6]。在心脏、肾脏和棕色脂肪组织等以脂肪酸为主要能源物质的组织中,MCAD蛋白表达水平较高[7,8]。对MCAD的信号调节通路进行研究发现,ERRα能识别MCAD基因启动子上的ERRE并与之结合,提示MCAD是转录调节因子ERRα的靶基因[9]。有研究报道,在大鼠新生心肌细胞和小鼠胚胎成纤维细胞中,
ERRα的过表达可导致棕榈酸酯的氧化显著增加,表明ERRα对脂肪酸氧化具有直接调节作用[10]。
过氧化物酶体增殖物激活受体-α(PPARα)在脂质代谢中占有重要地位,被认为是体内脂质平衡的生理传感器,对维持体内脂质代谢的动态平衡起着枢纽作用[10]。PPARα是转录因子ERRα的靶基因,其自身也是转录因子,控制着编码脂肪酸氧化酶如MCAD、肉毒碱棕榈酰转移酶(CPT-I)等基因的转录活性,调节脂肪酸氧化[10]。其中CPT-I可催化长链脂肪酸进入线粒体,也是脂肪酸β氧化的一个重要限速酶。
有研究发现,属于VEGF家族的血管内皮生长因子B(VEGF-B)与VEGF-A调节血管生长的作用不同,其主要调控血管内皮组织的脂肪酸摄取,目前被认为是II型糖尿病治疗的一个重要靶点[11]。VEGF-B启动子上有能够与ERRα结合的序列,可能是一个新发现的ERRα靶基因。ERRα可通过调节VEGF-B的表达,调控血管内皮细胞的脂肪酸摄取[11]。
1.2 ERRα/γ对糖代谢的影响
葡萄糖代谢中丙酮酸脱氢酶激酶4(PDK4)是ERRα转录的靶基因。在辅激活因子PGC-lα协同作用下,ERRα可与PDK4的启动子相应序列结合[12]。细胞中加入ERRα的小干扰RNA,ERRα对PDK4 DNA的转录活性受到抑制[13]。在大鼠肝癌细胞中,ERRα/γ均可激活对PDK4基因的转录活性[14]。PDK4能够抑制葡萄糖有氧氧化的关键限速酶——丙酮酸脱氢酶复合体(PDC)催化丙酮酸生成乙酰辅酶A进入三羧酸循环进行有氧氧化。因此,ERRα/γ可通过促进PDK4表达的调控抑制葡萄糖的有氧氧化。
ERRα对糖代谢的另一个调节作用是抑制糖异生。磷酸烯醇式丙酮酸羧激酶(PEPCK)是糖异生的关键限速酶,禁食可使该酶活性增强[15]。研究发现,PGC-lα可通过诱导肝细胞核因子4α(HNF-4α)和糖皮质激素受体(GR)等转录因子间接促进PEPCK基因的转录,使PEPCK mRNA表达增加[15]。而PEPCK基因启动子上也有与ERRE相类似的区域,虽然可与ERRα转录因子结合,但并非诱导ERRα对PEPCK的转录作用[16]。因这个区域与HNF-4α等转录因子的转录调节部位有一部分的碱基重叠,若ERRα与PEPCK的启动子结合,则会干扰PGC-lα对PEPCK的间接促转录作用,进而竞争性抑制PEPCK mRNA的表达[16]。动物实验表明,在ERRα敲除鼠中,PEPCK的蛋白表达增加,糖异生作用增强[17]。
1.3 ERRα/γ对线粒体生物合成和氧化磷酸化的影响
线粒体融合蛋白是线粒体酶,参与线粒体融合,协助维护细胞器。线粒体融合蛋白2的DNA启动子包含一个可与ERRα结合的保守ERRE,可在PGC-lα存在的情况下被ERRα激活[18]。ERRα可通过调节线粒体融合蛋白1和2的蛋白表达水平来参与调控线粒体的生成和维护[18,19]。
核呼吸因子1/2(NRF1/2)位于线粒体中,其本身也是转录因子,可调控一系列核编码的包括线粒体转录因子A(mtTFA)、细胞色素C氧化酶IV亚基(COXIV)等在内的线粒体和呼吸链基因的mRNA表达。当mtTFA蛋白转运到线粒体后,通过促进线粒体DNA复制和基因表达,可刺激线粒体生物合成[20]。研究发现,NRF1/2同样是ERRα的靶基因,ERRα可通过与NRF1/2的启动子序列结合,调节线粒体的生物合成[21]。
ATP合成酶主要参与线粒体氧化磷酸化,在跨膜质子动力势的推动下合成ATP。对整个酶来讲,β亚基是其催化亚单位。ATP5B是编码ATP合成酶β亚基的DNA分子,它的启动子相应序列可与ERRα/γ结合,也为ERRα/γ的靶基因[2]。
另外,对ERRα/γ临近启动子的结合区域进行分析,发现ERRα/γ可以调控线粒体功能的大部分基因,如图3。
总之,ERRα/γ通过调节其靶基因线粒体融合蛋白2、NRF1/2和ATP5B等的表达,从而影响线粒体的生物氧化和氧化磷酸化。
2 低氧诱导因子(HIF)与ERRα/γ
低氧诱导因子(HIF)是机体的氧感受器,低氧暴露可激活HIF介导的信号通路,从而产生一系列的低氧适应性变化[22]。细胞实验发现,HIF和ERRs可相互结合形成复合物[23]。在低氧下培养的细胞,加入ERRs的抑制剂——己烯雌酚(DES),ERRs的活性受到抑制,从而可导致HIF对其靶基因的转录活性受到影响[23]。反之,对HepG2细胞的研究发现,低氧暴露可促进ERRγ mRNA和蛋白表达[24]。但在低氧下孵育HepG2细胞时加入HIF-lα小干扰RNA(si-HIF-lα),则低氧诱导下的ERRγ的转录活性、mRNA和蛋白表达水平均显著降低[24]。动物在体实验表明,与野生鼠相比,HIF-lα低表达转基因鼠的骨骼肌核蛋白ERRα/γ表达量有增加趋势,以及ERRα/γ靶基因PPARα和MCAD的mRNA表达出现显著性提高;而HIF-lα高表达转基因鼠,骨骼肌核蛋白ERRα表达显著性下降,其靶基因PPARα和MCAD mRNA表达也呈下降趋势[25]。以上说明HIF与ERRα/γ可能存在相互调节关系。
3 运动与骨骼肌ERRα/γ
运动使机体能源物质消耗和能量代谢增强,是机体安静状态下的数倍,其中90%以上的能量由骨骼肌内脂肪酸和葡萄糖等的有氧氧化所提供[26]。ERR是脂
肪酸氧化、线粒体生物合成及氧化磷酸化的重要调节者,在运动中ERRα/γ对骨骼肌能量代谢的调节作用已获认可。
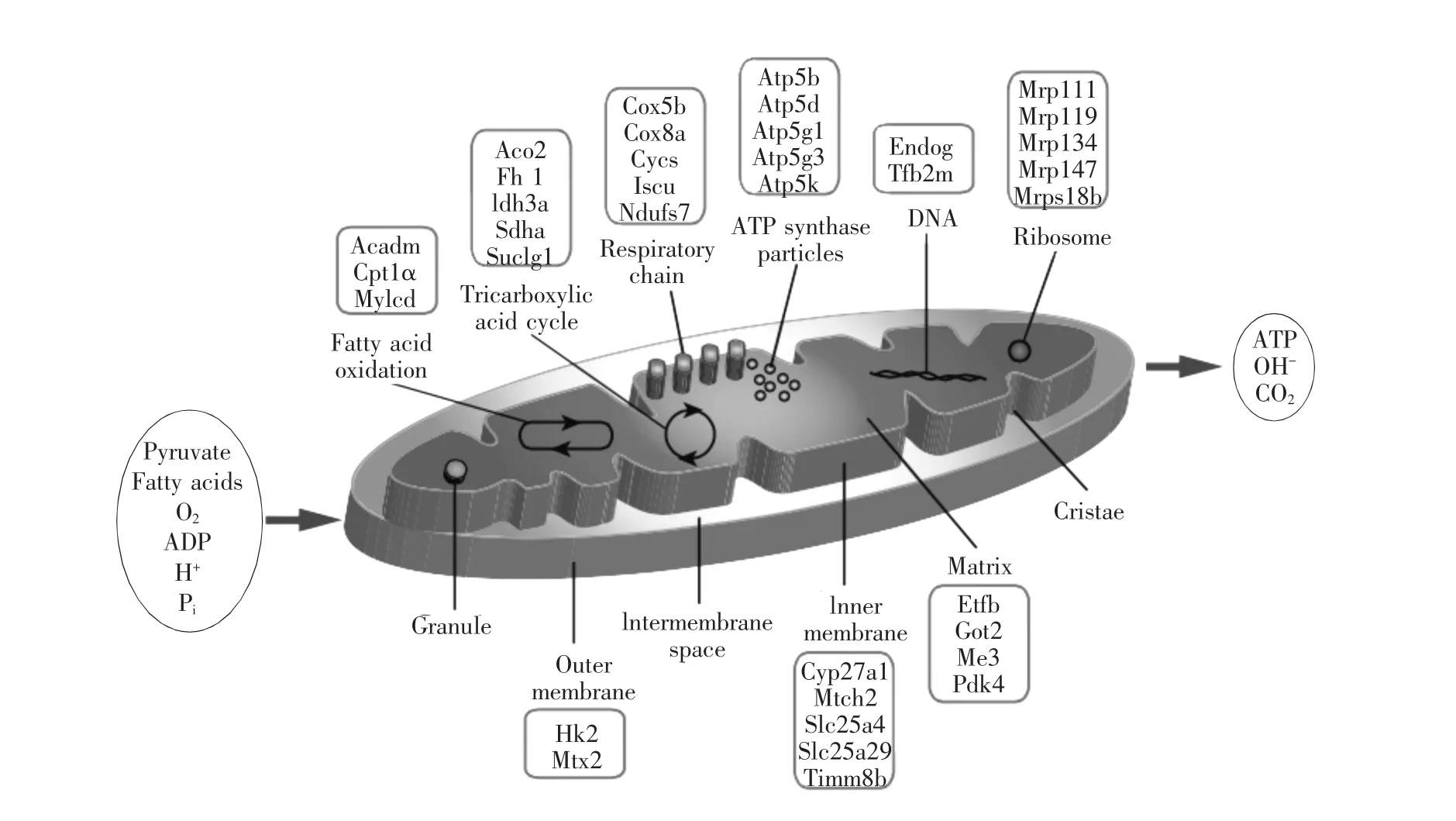
图3 ERRs调控的线粒体功能基因[2]
动物实验发现,野生鼠一次性耐力跑台运动1 h后骨骼肌核蛋白ERRγ表达呈显著增加,运动6 h后,ERRα/γ均出现显著升高[27]。另外,对ERRα/γ调控的下游靶基因进行研究发现,急性运动1 h和6 h后,ERR的靶基因MCAD、PPARα和NRF1的mRNA表达量变化与ERRα/γ蛋白表达水平变化相一致[27]。通过不同时间(7、14、28天)运动训练研究发现,运动14及28天可明显提高小鼠骨骼肌核蛋白ERRα以及mRNA的表达。随着运动时间延长,小鼠骨骼肌ERRα的总蛋白与核蛋白表达累积性增加[28]。4周耐力训练也可显著增加小鼠骨骼肌细胞核内ERRα蛋白表达[29]。人体实验发现,11名男性自行车运动员1次10公里自行车运动后2小时,其骨骼肌线粒体内ERRα mRNA表达量可增加至运动前的3倍,24小时后略有下降[18]。
综上所述,急性运动和长期耐力训练均可导致骨骼肌中ERRα和ERRγ的表达变化,以满足运动应激时的能量需求。ERRα/γ则可通过影响其靶基因的转录活性,进一步实现运动过程中对骨骼肌组织能量代谢的调控。
4 小结与展望
近年来,ERRα/γ对糖和脂肪代谢、线粒体生物合成和氧化磷酸化的影响及其机制研究已涉及医学的多种领域,而运动(低氧运动)可通过ERRα/γ调节能量代谢的研究,开阔了运动生理生化研究的新视野。目前运动对ERRα/γ的调节作用及其具体机制尚不十分清楚,仍需要进一步研究,其在运动的健康效应和低氧训练等领域拥有更广阔的应用前景。
[1]Giguere V,Yang N,Segui P,et al.Identification of a new class of steroid hormone receptors[J].Nature,1988,331(6151):91-94.
[2]Giguere V.Transcriptional control of energy homeostasis by the estrogen-related receptors[J].Endocr Rev,2008,29(6):677-696.
[3]Schwabe JW,Chapman L,Finch JT,et al.DNA recognition by theoestrogenreceptor:fromsolutiontothecrystal[J]. Structure,1993,1(3):187-204.
[4]DufourCR,WilsonBJ,HussJM,etal.Genome-wide orchestration of cardiac functions by the orphan nuclear receptors[J].Cell Metab,2007,5(5):345-356.
[5]Rajalin AM,Pollock H,Aarnisalo P.ERR alpha regulates osteoblastic and adipogenic differentiation of mouse bone[J]. Biochem Biophys Res Commun,2010,396(2):477-482.
[6]Schulz H.Beta oxidation of fatty acids[J].Biochim Biophys Acta,1991,1081(2):109-120.
[7]Nagao M,Parimoo B,Tanaka K.Developmental,nutritional,and hormonal regulation of tissue-specific expression[J].J Biol Chem,1993,268(32):24114-24124.
[8]Hainline BE,Kahlenbeck DJ,Grant J,et al.Tissue specific and developmental expression of rat long-and medium-chain
[J].Biochim Biophys Acta,1993,1216(3):460-468.
[9]Sladek R,Bader JA,Giguere V.The orphan nuclear receptor estrogen-related receptor alpha is a transcriptional[J].Mol Cell Biol,1997,17(9):5400-5409.
[10]Huss JM,Torra IP,Staels B,et al.Estrogen-related receptor alpha directs peroxisome proliferator-activated[J].Mol Cell Biol,2004,24(20):9079-9091.
[11]MehlemA,PalomboI,WangX,etal.PGC-1alpha coordinates mitochondrial respiratory capacity and muscular fatty acid[J].Diabetes,2016,65(4):861-873.
[12]WendeAR,HussJM,SchaefferPJ,etal.PGC-1alpha coactivates PDK4 gene expression via the orphan nuclear receptor[J].Mol Cell Biol,2005,25(24):10684-10694.
[13]Araki M,Motojima K.IdentificationofERRalphaasa specific partner of PGC-1alpha for the activation[J].FEBS J,2006,273(8):1669-1680.
[14]Zhang Y,Ma K,Sadana P,et al.Estrogen-related receptors stimulate pyruvate dehydrogenase kinase isoform 4 gene[J].J Biol Chem,2006,281(52):39897-39906.
[15]Yoon JC,Puigserver P,Chen G,et al.Control of hepatic gluconeogenesis through the transcriptional coactivator PGC-1[J].Nature,2001,413(6852):131-138.
[16]Herzog B,Hall RK,Wang XL,et al. Peroxisome proliferatoractivated receptor gamma coactivator -1alpha,as atranscription amplifier,is not essential for basal and hormone -induced phosphoenolpyruvate carboxykinase gene expression[J]. Mol Endocrinol,2004,18(4):807-819.
[17]HerzogB,CardenasJ,HallRK,etal.Estrogen-related receptor alpha is a repressor of phosphoenolpyruvate[J].J Biol Chem,2006,281(1):99-106.
[18]Cartoni R,Leger B,Hock MB,et al.Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle [J].J Physiol,2005,567(1):349-358.
[19]SorianoFX,LiesaM,BachD,etal.Evidencefora mitochondrial regulatory pathway defined by peroxisome[J]. Diabetes,2006,55(6):1783-1791.
[20]KraftCS,LemoineCM,LyonsCN,etal.Controlof mitochondrial biogenesis during myogenesis[J].Am J Physiol Cell Physiol,2006,290(4):C1119-1127.
[21]RangwalaSM,LiX,LindsleyL,etal.Estrogen-related receptor alpha is essential for the expression of antioxidant [J].Biochem Biophys Res Commun,2007,357(1):231-236.
[22]Lin Z,Weinberg JM,Malhotra R,et al.GLUT-1 reduces hypoxia-induced apoptosis and JNK pathway activation[J]. Am J Physiol Endocrinol Metab,2000,278(5):E958-966.
[23]AoA,WangH,KamarajugaddaS,etal.Involvementof estrogen-related receptors in transcriptional response to hypoxia[J].Proc Natl Acad Sci U S A,2008,105(22):7821-7826.
[24]Lee JH,Kim EJ,Kim DK,et al.Hypoxia induces PDK4 gene expression through induction of the orphan nuclear[J].PLoS One,2012,7(9):e46324.
[25]姬卫秀,张缨.一次有氧运动对诱导型HIF-1α转基因鼠骨骼肌ERRα/γ核蛋白表达的影响[J].北京体育大学学报,2015,12:73-77.
[26]Zurlo F,Larson K,Bogardus C,et al. Skeletal muscle metabolism is a major determinant of resting energy expenditure [J]. J Clin Invest,1990,86(5):1423-1427.
[27]姬卫秀,刘思雪,张缨.一次性不同时间跑台跑对ERRα/γ核蛋白表达的影响[J].北京体育大学学报,2014,12:51-55,78.
[28]石越丹,吕媛媛,李格,等.不同时间的运动训练对小鼠骨骼肌ERRα表达的影响[J].北京体育大学学报,2013,6:60-64.
[29]吕媛媛,石越丹,张缨.耐力训练对不同AMPKα2基因状态小鼠骨骼肌细胞核蛋白PGC-1α、ERRα表达及PGC-1α/ ERRα结合量的影响[J].中国运动医学杂志,2014,33(1):27-33.
2016.03.15
国家自然科学基金(编号:31171140)
张缨,Email:zhyi9265@126.com

