优秀男子青少年游泳运动员高原训练的血液指标变化
武铁男 范越 方子龙 闫会萍 陆一帆
1北京体育大学(北京 100084)2国家体育总局运动医学研究所(北京 100029)
优秀男子青少年游泳运动员高原训练的血液指标变化
武铁男1范越1方子龙2闫会萍1陆一帆1
1北京体育大学(北京 100084)2国家体育总局运动医学研究所(北京 100029)
目的:通过对血液指标的研究,观察高原训练对优秀青少年游泳运动员身体机能的影响,探讨身体机能的变化规律。方法:选择23名优秀男子青少年游泳运动员进行8周高原训练,训练周期包括高原前(100 m)准备期7天、高原(1890 m)训练期24天和高原后(100 m)调整期25天。在不同阶段的清晨采集安静血样。全血用于测试血常规,包括红细胞计数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)和白细胞计数(WBC)。血清用于测试睾酮(sT)、皮质醇(sC)、肌酸激酶(sCK)和尿素(sUREA)。结果:与高原前第7天相比,RBC和HGB在高原第2、14和21天均明显升高(P<0.01,P<0.01);HCT在高原第2、7、14和21天均显著升高(P<0.01);sCK在高原第2、7、14和21天以及高原后第11和18天均显著升高(P< 0.01);sUREA在高原第7天以及高原后第4、11、18和25天均显著升高(P<0.01)。与初入高原第2天相比,sT在高原第14天以及高原后第11和25天显著降低(P<0.01);sT/sC在高原后第11和25天显著降低(P<0.05,P<0.01)。结论:高原训练使青少年游泳运动员的造血机能产生适应性变化。青少年游泳运动员对高原训练的应激反应较大,身体机能恢复较慢,并伴有疲劳发生。
高原训练;血液指标;青少年;游泳运动员
对处于运动素质发展敏感期的青少年运动员进行系统的、持续的、不同负荷的刺激,使身体产生适应性变化,能有效改善身体各器官、系统的机能水平[1]。高原训练可使运动员接受运动和缺氧的双重刺激,使机体获得更好的适应性变化,提高运动能力[2]。
体能类项目的运动员可通过高原训练大幅度提升机能水平;但不合理的高原训练也可能导致运动能力下降,表现出竞技状态下滑。国内外对青少年运动员高原训练的报道很少,对青少年是否适合高原训练也持不同观点[3-5]。青少年处于生长发育期,肌肉和骨骼尚未完全发育成熟,尤其是心血管系统和呼吸系统的形态发育和生理功能正在逐渐成熟的过程中,采用高原训练手段更具有挑战性。然而,在我国游泳运动实践中,作为提高有氧能力的一种重要手段,很多优秀运动员在青少年时期就参加高原训练,并取得很好效果。游泳运动员参加专业训练和出成绩的年龄较小,在青少年时期进行高原训练更具有现实意义[6]。
血液指标可客观地反映生理适应性的变化。高原训练期间的血液指标变化,可作为机体是否适应高原环境和训练负荷的重要评价指标[7]。本研究系统地对青少年游泳运动员在高原训练不同阶段的血液指标进行监测,探讨身体机能的变化规律,为青少年游泳运动员高原训练提供参考依据。
1 对象与方法
1.1 研究对象
选择23名(6名国家级运动健将,17名国家一级运动员)优秀男子青少年游泳运动员为研究对象,年龄为16.0±1.4岁,身高为179.1±5.5 cm,体重为70.5± 7.7 kg,训练年限为8.5±1.8年。
1.2 训练安排
训练安排在2014年7~8月,目的是提高运动员的基础有氧能力。训练周期分为3个阶段[8]:高原前准备期7天(D-7~D-1,郑州100 m)、高原训练期24天(D1~D24,昆明1890 m)和高原后调整期25天(D+1~ D+25,郑州100 m),共8周。每周训练6天,周日休息。运动员统一饮食,不额外补充营养品。训练安排见表1。
1.3 测试指标
在不同训练阶段的清晨(7∶00 am)抽取安静静脉血,采血时间安排见表1。抗凝血(全血)用于血常规测试,包括红细胞(RBC)、血红蛋白含量(HGB)、红细胞压积(HCT)和白细胞(WBC)。非抗凝血分离血清,用于测试肌酸激酶(sCK)、尿素(sUREA)、睾酮(sT)和皮质
醇(sC)。受某些客观条件限制,sT和sC仅在D2、D14、D+11和D+25进行了测试。
1.4 测试仪器
采用Beckman Coulter LH 780血细胞分析仪测试血常规,采用Beckman Access 2全自动化学发光分析仪测试sT和sC,采用Beckman DxC 600全自动生化分析仪测试sCK和sUREA。试剂均为Beckman公司配套试剂盒。
1.5 数据处理
2 结果
2.1 血常规
单因素重复测量方差分析表明,高原训练期间的RBC(F=9.191,P<0.01)、HBG(F=12.902,P<0.01)、HCT(F=39.877,P<0.01)和WBC(F=2.653,P<0.05)均发生显著性变化。
如表2所示,RBC、HGB和HCT均在正常范围内,变化趋势基本一致,波动幅度较大。与高原前(D-7)相比,初入高原(D2)时RBC、HGB和HCT均显著升高(P<0.01),达到峰值。上高原1周后(D7),除HCT仍明显高于高原前(D-7)的水平(P<0.01)外,RBC和HBG均回落到高原前(D-7)的水平。上高原2周(D14)和3周(D21)后,RBC、HGB和HCT又上升,均显著高于高原前(D-7)的水平(P<0.01)。高原后平原期(D+4、D+ 11、D+18和D+25)的RBC、HGB和HCT回落至高原前(D-7)的水平。WBC均在正常范围内,波动较平稳,在初入高原(D2)时达到峰值,但各时间点与高原前(D-7)相比均无明显差异。

表2 血常规指标的变化
2.2 sCK和sUREA
单因素重复测量方差分析表明,高原训练期间的sCK(F=16.676,P<0.01)和sUREA(F=8.158,P<0.01)均发生显著性变化。
如表3所示,与高原前(D-7)相比,高原期间(D2、D7、D14和D21)的sCK均显著升高(P<0.01),于上高
原1周后(D7)达到峰值。高原后平原期(D+4、D+11、D+18和D+25)的sCK回落,但在D+11和D+18仍显著高于D-7的水平(P<0.01)。与高原前(D-7)相比,高原期间(D2、D7、D14和D21)的sUREA呈上升趋势,于上高原1周后(D7)达到峰值(P<0.01)。高原后平原期(D+4、D+11、D+18和D+25)的sUREA维持在较高水平,均显著高于高原前(D-7)的水平(P<0.01)。

表3 sCK和sUREA的变化
2.3 sT、sC和sT/sC
单因素重复测量方差分析表明,高原训练期间的sT(F=15.573,P<0.01)和sT/sC(F=8.042,P<0.01)均发生显著性变化,而sC(F=0.763,P>0.05)变化不明显。
如表4所示,与初入高原(D2)时相比,高原期间(D14)和高原后平原期(D+11和D+25)的sT均显著降低(P<0.01)。与初入高原(D2)时相比,高原期间(D14)和高原后平原期(D+11和D+25)的sC均无显著性差异。与初入高原(D2)时相比,高原后平原期(D+11和D+25)的sT/sC均显著降低(P<0.05,P<0.01)。
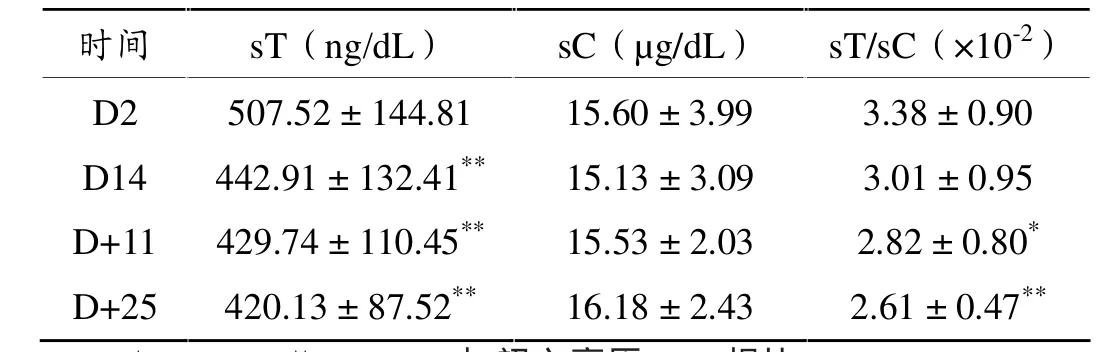
表4 sT、sC和sT/sC的变化
3 讨论
3.1 血常规指标的变化
血常规指标的变化对运动员的营养和机能状况评估有重要意义。红细胞中的HGB是血液中携带O2和运输CO2的蛋白质,HGB水平的高低直接影响到运动员的有氧能力,其变化反映某些项目运动强度和运动量对机体的影响[9]。HCT反映红细胞在血液中所占容积,过高或过低都影响血液运送O2的能力[6]。
Friedmann等[10]对16名青少年游泳运动员进行3周高原训练(2100~2300 m)的监测发现,与高原训练前相比,高原训练后HGB和HCT有所升高,但不具有显著性差异,且个体差异较明显。高扬[11]对31名青少年游泳运动员进行2周的高原训练(2366 m)的监测发现,高原训练期间RBC和HGB的变化呈一致趋势,即初入高原时明显升高,1周后有所下降,2周后又明显升高,回到平原后第2天迅速下降至高原前的水平;而HCT在高原阶段明显下降,回到平原后恢复到高原前的水平。
本研究结果与前述研究基本一致。青少年游泳运动员高原训练(1890 m)期间的RBC、HGB和HCT均在正常范围内,变化呈一致性,波动幅度较大,个体差异明显。初入高原(D2),RBC、HGB和HCT即出现明显升高。进入高原后RBC和HGB增多的主要原因是高原缺氧条件下血液浓缩和促红细胞生成素(EPO)释放增加[2]。由于急性低氧暴露后EPO的升高导致外周血RBC和HGB升高需要数天时间[12],因此推测本研究中高原早期(D2)的RBC和HGB升高的主要原因是血液浓缩,HCT同时升高也佐证了这一观点。在进入高原第1周(D7),RBC、HGB和HCT均有所降低。尽管运动员进入高原后接受低氧和运动的双重刺激,使EPO释放增多,会刺激RBC和HGB生成增加,但青少年运动员由于年龄较小,机体应激反应强烈,RBC破坏可能有所增多,使RBC、HGB和HCT呈下降趋势。随着高原训练时间的延长,EPO在低氧暴露条件下持续释放,加上机体逐步适应了高原环境和训练负荷,从进入高原第2周(D14)起,RBC、HGB和HCT持续维持在较高水平,有利于提高载氧能力。高原后平原阶段训练负荷不断加大,超过高原前训练总量,下高原后RBC、HGB和HCT有所降低,但直至本次高原训练结束(D+25),其绝对值仍略高于进行高原训练前的基础值(尽管没有显著性差异),提示机体对高原低氧刺激所产生的适应性变化效应在此时间内还存在影子效应,机体具备较好的有氧能力。
青少年由于心血管系统发育尚未完全,其疲劳消除的能力下降在高原训练过程中尤为突出。目前,可以肯定疲劳与免疫机能下降具有高度的相关。WBC作为反映免疫机能的指标,已应用于高原训练期间免疫机能的监控[13]。卢铁元等[14]对5名优秀竞走男运动员进行1个月高原训练(2366 m)的监测发现,初入高原第1天的WBC明显升高,随后4周呈波浪型(降-升-降-升)的变化趋势。陶晓黎[15]对8名男子游泳运动员进行
4周高原训练(1890 m)的监测发现,与高原前相比,第1周WBC下降,第2~4周WBC升高且高于高原前的水平,但差异不具有显著性。高欢等[16]对20名优秀男子赛艇运动员进行60天高原训练(2200 m)的监测发现,WBC均低于高原前的水平,提示长时间高原训练可能导致免疫机能下降。Pyne等[17]对澳大利亚国家游泳队进行21天高原训练(2102 m)的研究发现,对照组(8人,高原不运动)的WBC降低3%,而训练组(10人)的WBC降低38%,两组差异非常明显,提示高原训练导致免疫功能下降。
本研究中WBC的变化趋势与卢铁元等[14]的结果相似,也与红细胞系指标的变化相似,但波动幅度较小,且均在正常范围内,个体差异明显。结果提示机体在高原阶段免疫功能较稳定。在初入高原(D2),WBC升高较多,与高原低氧刺激引起机体自身免疫机能应激有关,同时也不排除血液浓缩的影响。在高原阶段的随后几周出现降低-升高-降低的趋势,可能与训练负荷逐步增大,机体不断调整适应有关。下高原后的平原阶段前3周(D+4~D+18),WBC指标持续降低,提示免疫机能有所下降,应结合机能状态指标判定机体是否疲劳。平原第4周为比赛周,训练负荷降低,D+25的WBC值有所升高,机体免疫功能有回升的趋势。
3.2 sCK和sUREA的变化
sCK是评价运动员是否适应运动强度及疲劳与损伤后恢复情况的重要指标[9]。高原训练时,缺氧引起细胞膜通透性改变,导致sCK在初上高原的24~36 h急剧升高,随后的训练进一步加剧这种趋势。Wilbler等[18]对16名青少年铁人三项运动员进行5周高原训练(1860 m)的监测发现,与高原前相比,初入高原24 h的sCK即明显升高,这种升高可持续到整个高原训练期间,推测是由于高原和训练的双重影响造成的。周磊[19]对6名优秀女子短距离游泳运动员进行4周半高原训练(1890 m)的监测发现,CK呈现出波浪式(升-降-升-降)的变化,受训练强度影响较大。
在本研究中,整个高原训练阶段运动员sCK变化幅度较大,个体差异明显。进入高原后(D2、D7)sCK明显升高,可能是由于青少年运动员肌肉承受负荷能力较差,缺氧和训练的双重刺激使骨骼肌细胞通透性[20]和破损程度[21]急剧增加所致。D14出现sCK降低的趋势,结合训练计划推测是由于第2周增量减强度的原因,因为sCK对强度较为敏感,同时也提示机体适应能力不断增强。第3周为高原训练负荷量和强度最大周,D21的sCK值又出现明显升高。平原第1周为高原到平原的过渡阶段,训练以调整为主,强度较小,D+4的sCK出现大幅度下降。平原第2周训练强度逐渐增大,D+11的sCK值又出现升高。尽管训练负荷逐步增加,但平原第3、4周(D+18和D+25)的sCK呈下降趋势,表明机体对负荷适应能力增强,机能状态良好。
sUREA是评价运动员对训练量反应及疲劳状况的敏感指标[9]。由于低氧环境刺激,运动员基础代谢增强,安静和训练后的sUREA均高于平原值[8]。周磊[19]对6名优秀女子短距离游泳运动员进行4周半高原训练(1890 m)的监测发现,sUREA在高原期间呈不断上升的趋势,提示高原训练引起疲劳累积,但高原后平原阶段sUREA下降明显。
在本研究中,在进入高原初期(D2、D7),sUREA呈升高趋势,提示高原缺氧环境和运动量不断加大使机体分解代谢不断增强。随后的第2、3周(D14和D21)sUREA下降,在第3周时接近高原前的基础值,提示机体对高原训练的适应能力增强。高原后平原第1周(D+ 4),sUREA出现明显增高,可能是平原氧供充足,机体基础代谢率明显升高所致。随后的2周,随着训练量不断加大,D+11和D+18的sUREA持续保持在较高水平。尽管第4周的训练负荷减小,但D+25的sUREA仍保持在较高水平,提示平原阶段运动员出现疲劳累积。3.3sT、sC和sT/sC的变化
sT是反映运动员合成代谢能力的重要指标,较高的sT水平有利于运动能力的提高和运动后疲劳的恢复。用sT水平来评定训练负荷引起的内分泌的变化,主要用于监控运动员的训练量[9]。sC是反映运动员分解代谢能力的重要指标,sC的主要功能是维持体内糖代谢正常进行,保持血糖浓度相对稳定。sC也可作为反映运动能力变化和疲劳的指标[22]。在正常生理状况下,sT和sC的代谢是平衡的[23],sT/sC的变化可客观地反映机体恢复状况[24]。研究表明,与高原前相比,初入高原时运动员的sT水平有所降低,并在随后的高原训练中逐步降低,主要与训练负荷密切相关[25-28]。同时,机体由于缺氧的影响,高原训练使sC呈现上升的变化趋势,分解代谢活动增强[29]。
受某些客观条件限制,本研究未在高原前测试sT和sC。与初入高原(D2)相比,高原第2周(D14)sT明显下降,与前人的研究结果相似[25-28],可能是因为青少年性腺发育尚未成熟,睾丸Leydig细胞分泌雄激素不足,而在高原训练期间机体一直处于应激消耗状态,导致sT出现明显下降。高原后的平原阶段,训练负荷不断加大,D+11和D+25的sT仍持续呈现下降趋势。sC在高原训练和高原后训练期间变化较为平稳,不是评价运动员高原训练机能状态的敏感指标。sT/sC的变化与sT的变化趋势相同,在高原训练和高原后训练期间呈下降趋势。结合血清sUREA和WBC的结果,提示高原训练对青少年运动员机体刺激较大,高原后平原阶段恢复较慢,伴有疲劳发生。
4 结论
高原训练使青少年游泳运动员的造血机能产生适应性变化。青少年游泳运动员对高原训练的应激反应较大,身体机能恢复较慢,并伴有疲劳发生。
[1]马新华,周月良.青少年运动员高原训练可行性探析[J].中国体育教练员,2009,17(4):56-57.
[2]冯连世.高原训练及其研究现状[J].体育科学,1999,19(5):64-66.
[3]翁庆章,钟伯光.高原训练的理论与实践[M].北京:人民体育出版社,2002:132-136.
[4]Son HJ,Kim HJ,Kim JH,et al.Erythropoietin,2,3 DPG,oxygen transport capacity,and altitude training in adolescent Alpine skiers[J].Aviat Space Environ Med,2012,83(1):50-53.
[5]Philo U.Altitude training and performance in elite athletes. Abstract Proceeding of 2009 China Duoba International Forum on Altitude Training and Health,Duoba,China,2009:17-20.
[6]陆一帆.游泳训练理论创新与实践[M].北京:北京体育大学出版社,2013:312-313.
[7]钱风雷,王晨.高原训练对游泳运动员血液成分、血乳酸和运动能力的影响[J].体育与科学,2004,25(6):69-71.
[8]陆一帆.高原训练个性化监控的探索[J].体育科研,2009,30(6):5-8.
[9]冯连世,冯美云,冯炜权.运动训练的生理生化监控方法[M].北京:人民体育出版社,2006:54-55.
[10]Friedmann B,Frese F,Menold E,et al.Individual variation in the erythropoietic response to altitude training in elite junior swimmers[J].Br J Sports Med,2005,39(3):148-153.
[11]高扬.短期高原暴露对青少年游泳运动员有氧能力的影响研究[D].北京:北京体育大学硕士学位(毕业)论文,2014:21-24.
[12]彭朋.EPO在高原训练中早期下降的机制及对高原训练效果的预测作用[D].北京:北京体育大学博士学位(毕业)论文,2009:46-54.
[13]BuchheitM,SimpsonBM,Garvican-LewisLA,etal. Wellness,fatigue and physical performance acclimatization to a 2-week soccer camp at 3600 m(ISA3600)[J].Br J Sports Med,2013,47(Suppl1):1-9.
[14]卢铁元,杨明.高原训练对我国优秀竞走运动员血5项的影响[J].中国体育科技,2001,37(10):34-35.
[15]陶晓黎.游泳运动员高原训练某些生理生化指标的训练监控研究[J].体育科学研究,2005,9(1):80-81.
[16]高欢,高炳宏,冯连世,等.长时间高原训练对优秀赛艇运动员免疫机能及血浆瘦素的影响[J].中国运动医学杂志,2011,30(11):986-991.
[17]Pyne DV,McDonald WA,Morton DS,et al.Inhibition of interferon,cytokine,and lymphocyte proliferative responses in elite swimmers with altitude exposure[J].J Interferon Cytokine Res,2000,20(4):411-418.
[18]Wilbler RL,Drake SD,Hesson JL,et al.Effect of altitude training on serum creatine kinase activity and serum cortisol concentration in triathletes[J].Eur J Appl Physiol,2000,81(1~2):140-147.
[19]周磊.对我国优秀女子短距离游泳运动员冬训期高原训练生理生化监控及机能评定[D].武汉:湖北大学硕士学位(毕业)论文,2012:22-27.
[20]Vasankari TJ,Kujala UM,Rusko H,et al.The effect of endurance exercise at moderate altitude on serum lipid peroxidation and antioxidative functions in humans[J].Eur J Appl Physiol Occup Physiol,1997,75(5):396-399.
[21]Dempsey JA,Forester HV.Mediation of ventilator adaptations [J].Physiol Rev,1982,62(1):262-346.
[22]程燕,许琦.游泳运动训练科学化理论及方法的研究[M].北京:北京体育大学出版社,2006:195-196.
[23]Vogt M,Puntschart A,Geiser J,et al.Molecular adaptation in human skeletal muscle to endurance training under simulated hypoxic conditions[J].J Appl Physiol,2001,91(1):173-182.
[24]李越,金考生.优秀游泳运动员高原训练期间VO2max、BLA和T/C值的变化[J].中国运动医学杂志,2004,23(3):256-260.
[25]Hartmann U,Mester J.Training and overtraining markers in selected sport events[J].Med Sci Sports Exerc,2000,32(1):209-215.
[26]冯连世,洪平,宗丕芳,等.高原训练对男子中长跑运动员血清激素的影响[J].体育科学,2000,20(4):49-52.
[27]陈伟,马琳.高原训练对优秀女子赛艇运动员血红蛋白、血清睾酮、血尿素和身体成分的影响[J].中国体育科技,2008,44(4):95-99.
[28]沈艳梅,楼霞.不同性别游泳运动员高原训练生理生化的监控研究[J].辽宁体育科技,2010,32(3):31-33.
[29]葛新发,罗鹰翔,徐菊生,等.中国女子皮艇队高原训练的实验研究[J].武汉体育学院学报,1998,32(4):55-59.
2016.01.05
国家体育总局课题(2013A084)
陆一帆,Email:luyifan@bsu.edu.cn

