CCL25/CCR9在溃疡性结肠炎中的表达研究
钟万锷 曹萍 许晶飞
CCL25/CCR9在溃疡性结肠炎中的表达研究
钟万锷曹萍许晶飞
目的 研究趋化因子CCL25,CCL25的受体CCR9在溃疡性结肠炎(UC)中的表达情况以及与UC病变程度和范围的关系及相关性,探讨其在UC发病机制中的作用。方法 用免疫组织化学法检测32例活动期UC及22例正常对照石蜡包埋组织中CCL25及CCR9的表达情况。结果 UC组CCL25及CCR9均为阳性表达。对照组为阴性或弱阳性表达。CCL25及CCR9在UC组的表达与对照组比较,差异有统计学意义(P<0.01)。UC病变范围越广、程度越重,CCL25及CCR9表达阳性率越高,CCL25和CCR9表达具有相关性(r=0.759,P<0.01)。结论 CCL25/CCR9相互作用参与了UC的发生和发展。CCL25/CCR9高低反映了疾病的炎症程度,且可能作为药物治疗的潜在靶点。
溃疡性结肠炎 CCL25 CCR9 免疫组织化学
溃疡性结肠炎(UC)是一种病因及发病机制尚未明确且反复发作的慢性非特异肠道炎症。目前认为其发病可能与免疫、遗传、感染及精神等多因素有关。肠道黏膜免疫系统异常反应所导致的炎症在溃疡性结肠炎中起重要作用。CCL25是CC类趋化因子家族成员,CCL25与CCR9相互作用调节T淋巴细胞的迁移。本文通过免疫组织化学的方法研究CCL25/CCR9在UC中的表达情况以及与病变程度的关系,探讨CCL25/ CCR9在UC发病中的作用。
1 临床资料
1.1一般资料 收集2013年10月至2014年11月在本院门诊和住院患者中因腹痛、腹泻、便血、腹胀及里急后重等行肠镜检查的患者32例,经内镜和病理证实为溃疡性结肠炎,诊断标准参照中华医学会消化病学分会炎症性肠病协作组制定的IBD诊断标准[1]。其中男18例,女14例;年龄16~72岁,平均年龄42岁。均为疾病活动期。按Sutherland疾病活动指数进行病情轻重分级[1]:轻度12例,中度15例,重度5例;按Baron评分标准进行内镜分级[2]:Ⅰ级8例,Ⅱ级15例,Ⅲ级9例;按病变累级部位分为:直肠炎6例,直乙结肠炎16例,左半结肠炎7例,全结肠炎3例。对照组20例为性别年龄相匹配的健康志愿者(7例)和结肠息肉行肠镜检查者,标本均经病理检查确认为正常肠黏膜。其中男13例,女7例;年龄15~17岁,平均年龄42岁,均来自于本院内镜室。所有观察对象常规进行肠道准备,然后作肠镜检查,在病变最明显处取组织2块,立即置于10%的甲醛固定。健康志愿者和肠道肿瘤待行肠镜检查者均取正常肠黏膜2块,立即置于10%的甲醛固定。制备组织切片,部分切片行 HE染色,光学显微镜下评价炎症及溃疡等组织学改变。另一部分用于检测CCL25和CCR9的表达。
1.2方法 (1)免疫组化检测步骤如下:检测CCL25/ CCR9的免疫组化过程:标本经10%甲醛固定,包埋成蜡块,切成4~5μm的薄片。切片经过常规脱蜡,水化,抗原修复。每张切片加1滴3%的H2O2,室温下孵育10min,以阻断内源性过氧化物酶的活性,PBS冲洗;加CCL25(工作浓度15μg/ml)及CCR9(工作浓度1:300)多克隆抗体,加二抗(工作浓度1:500),室温下孵育30min。DAB显色、复染、脱水、透明、封片。阴性对照以PBS代替一抗。阳性结果判断:光学显微镜下可见CCL25和CCR9表达阳性的细胞为棕黄色着色,背景为淡蓝色。阴性对照应无棕黄色反应产物。采用以下染色积分评价标准[3]:染色强度分为4级:阴性染色(0分),弱阳性染色(1分),中度阳性染色(2分),强阳性染色(3分);每张切片按所见阳性细胞范围分为5级:阴性为0分,阳性细胞占1%~25%为1分,阳性细胞占26%~50%为2分,阳性细胞占51%~75%为3分,阳性细胞占76%~100%为4分。每张切片的染色积分以这二者乘积之和表示。所用试剂:CCL25/CCR9多克隆抗体购自美国Santa cruz公司,均为兔源。羊抗兔IgG二抗购自美国Jackson公司。免疫组化试剂盒购自北京中杉生物技术开发公司。
2 结果
2.1UC组、正常黏膜CCL25和CCR表达的比较 UC患者病变肠组织和对照组肠组织H-E染色情况见图1。免疫组化染色情况见图2。CCL25主要表达在肠道上皮细胞的胞质或胞膜,CCR9表达在邻近CCL25表达区域的淋巴细胞。在正常结肠黏膜组织中,CCL25和CCR9无或仅有弱阳性表达。UC患者肠黏膜CCL25、CCR9表达水平分别为(4.38±1.64)和(4.78±1.96),均较对照组[分别为(0.66±0.52)和(0.72±0.46)]明显升高,差异有显著性(P<0.01)。CCL25和CCR9在UC中的表达与炎症程度正相关。
2.2CCL25、CCR9与UC病变程度之间的关系 CCL25、CCR9表达随UC病情加重明显增加,差异有统计学意义(P<0.01),见表2。
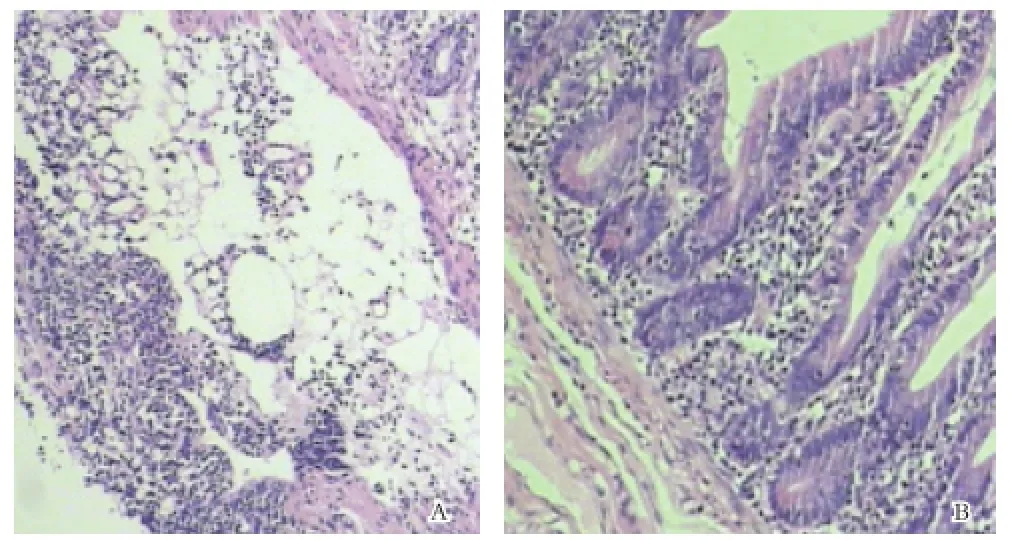
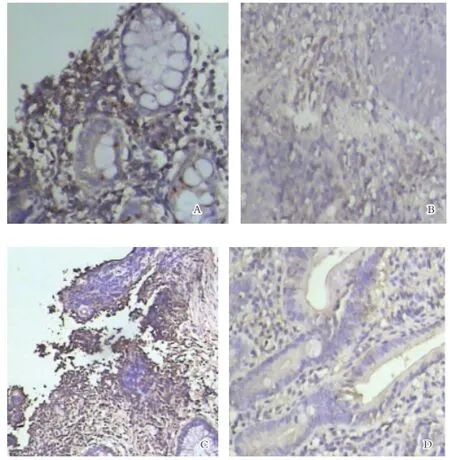
图2 A:UC患者病变肠组织见大量CCL25的表达(×400);B:对照组肠组织无或仅有少量CCL25的表达(×400);C:UC患者病变肠组织见大量CCR9的表达(×400);D:对照组肠组织无或仅有少量CCR9表达(×400)
表2 CCL25、CCR9表达与UC病变程度的关系(±s)
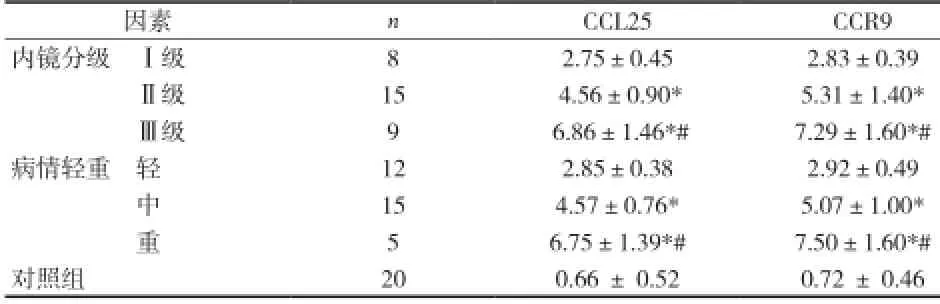
表2 CCL25、CCR9表达与UC病变程度的关系(±s)
注:与轻度(Ⅰ级)比较,*P<0.01;与中度(Ⅱ级),#P<0.01
因素nCCL25CCR9内镜分级 Ⅰ级82.75±0.452.83±0.39Ⅱ级15 4.56±0.90*5.31±1.40*Ⅲ级9 6.86±1.46*#7.29±1.60*#病情轻重 轻122.85±0.382.92±0.49中154.57±0.76*5.07±1.00*重5 6.75±1.39*#7.50±1.60*#对照组200.66 ± 0.520.72 ± 0.46
2.3CCL25和CCR9相关性分析 根据内镜及病理分级,UC结肠黏膜组织中CCL25与CCR9蛋白的表达正相关(r=0.759,P<0.01)。
3 讨论
趋化因子是一类可诱导产生的具有趋化吸引性的小分子蛋白质,趋化因子通过其相应受体对多种细胞如淋巴细胞、中性粒细胞、树突状细胞、单核细胞等的趋化作用而在多种疾病的免疫反应和炎症损伤中发挥重要作用。趋化因子可分为CXC、CC、C、CX3C四个亚族,CCL25是新近发现的CC类趋化因子家族成员,CCL25由Vicari等[4]在人和小鼠的胸腺中发现,所以又称胸腺表达调节趋化因子(Thymus-expressed Chemokine,TECK)。Zaballos等[5]研究证明CCR9是趋化因子家族CCL25的特异性受体。实时定量PCR研究发现,CCL25 mRNA主要表达于肠道上皮细胞和胸腺树突状细胞,在外周血单核细胞、T淋巴细胞和B淋巴细胞中也有表达,但表达水平不高。CCR9 mRNA主要表达于消化道归巢的T淋巴细胞及胃肠道和中枢神经系统的IgA分泌细胞表面[6-7]。
淋巴细胞归巢是UC的病理特征之一,淋巴细胞归巢离不开趋化因子的作用,UC通常是辅助性T细胞2(Th2)介导的肠道黏膜炎症。CCL25和CCR9的相互作用主要调节淋巴细胞的归巢,CCL25通过上调整合素受体a4b7和CCR9调节肠效应T淋巴细胞的迁移[8-9];CCL25通过CCR9趋化T淋巴细胞进入结肠黏膜,成熟树突状细胞(mDC)可以激活T淋巴细胞,进而产生一系列炎症反应[10-11]。Wurbel等[12-13]通过葡聚糖硫酸钠(DSS)诱导小鼠溃疡性结肠炎模型研究表明,CCL25和CCR9异常表达及其相互作用参与调节结肠炎症反应。Zhu等[14]通过恶唑酮小鼠结肠炎模型研究发现,CCL25及CCR9表达增加,CCL25与CCR9 相互作用调节并增强iNKT细胞的功能,进而参与UC的发生。Rivera-Nieves 等[15]通过自发鼠类动物模型研究发现,在慢性回肠炎早期CCR9表达增多,给予抗体阻断CCL25/CCR9能减轻早期慢性鼠类回肠炎。本资料结果发现,CCL25在UC组中阳性表达,表达的强弱与炎症程度成正相关,在对照组中不表达或仅有微弱的表达,差异具有统计学意义(P<0.05)。CCR9作为CCL25的特异性受体,其表达情况与CCL25的表达情况相一致。CCL25和CCR9的表达具有相关性。CCL25与CCR9反映了疾病的炎症程度,因而可作为病情程度监测的有效指标。
根据以上研究结果,作者认为:CCL25和CCR9参与了UC的发生和发展。CCL25通过其受体CCR9趋化淋巴细胞聚集至病变结肠,并进一步激活淋巴细胞,最终导致Th2介导的肠道黏膜炎症。由于CCL25和CCR9在UC发病中起着重要作用,表达的强弱与炎症程度成正相关,理论是可以将CCL25和CCR9作为治疗的靶点,通过拮抗其活性将减轻炎症损伤。由此可见,CCL25和CCR9在UC发病中起重要作用,聚集在病变结肠的淋巴细胞的激活直接导致了UC的病理变化。CCL25和CCR9反映了疾病的炎症程度,可能成为潜在治疗的靶点。
[1]中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见.胃肠病学,2007,12(8):488-495.
[2]Parente F,Molteni M,Marino B, et al.Bowel ultrasound and mucosal healing in ulcerative colitis.Dig Dis,2009,27(3):285-90.
[3]Koga H, Sakisaka S, Ohishi M, et al. Expression of cyclooxygenase-2 in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Hepatology, 1999:29(3): 688-696.
[4]Vicaria P, Figueroa DJ,Hedrick JA,et al. TECK: a novel CC chemokine specifically expressed by thymic dendritic cells and potentiallyinvolved in T cell development. Immunity, 1997, 7(2): 291-301.
[5]Zaballos A,Gutierrez J,Varona R,et al.Cutting edge:Identification of the orphan chemokine receptor GPR-9-6 as CCR9,the receptor for the chemokine TECK.J Immunol,1999,162(10):5671-5675.
[6]Meurens F, Berri M, Whale J, et al. Expression of TECK/CCL25 and MEC/CCL28 chemokines and their respective receptors CCR9 and CCR10 in porcine mucosal tissues. Vet Immunol Immunopathol, 2006,113(3-4): 313-327.
[7]Meurens F, Whale J, Brownlie R, et al. Expression of mucosal chemokines TECK/CCL25 and MEC/CCL28 during fetal development of the ovine mucosal immune system.Immunology, 2007, 120(4):544-555.
[8]Mora JR,Bono MR,Manjunath N,et al.Selective imprinting of gut-homing T cells by Peyer’s patch dendritic cells.Nature,2003, 424(6944): 88-93.
[9]Stenstad H,Ericsson A,Johansson-Lindbom B,et al.Gut-associated lymphoid tissue-primed CD4+T cells display CCR9-dependent and -independent homing to the small intestine.Blood, 2006, 107(9): 3447-3454.
[10]Wermers JD,McNamee EN,Wurbel MA,et al.The chemokine receptor CCR9 is required for the T-cell-mediated regulation of chronic ileitis in mice. Gastroenterology,2011,140(5):1526-35.[11]Jin Y,Fuller L,Ciancio G,et al.Antigen presentation and immune regulatory capacity of immature and mature-enriched antigen presenting(dendritic)cells derived from human bone marrow.Hum Immunol, 2004,65(2):93-103.
[12]Wurbel MA, McIntire MG, Dwyer P, et al. CCL25/CCR9 Interactions Regulate Large Intestinal Inflammation in a Murine Model of Acute Colitis.PloS one,2011,6(1): e16442.
[13]Wurbel MA,Le Bras S,Ibourk M,et al.CCL25/CCR9 Interactions Are Not Essential for Colitis Development but Are Required for Innate Immune Cell Protection from Chronic Experimental Murine Colitis.Inflammatory Bowel Diseases,2014,20(7):1165-1176.
[14]Zhu S,Bing Y,Wang X,et al.CCL25/CCR9 interactions regulate the function of iNKT cells in oxazolone-induced colitis in mice. PLoS One,2014,9(6):e100167.
[15]Rivera-Nieves J, Ho J, Bamias G, et al. Antibody Blockade of CCL25/CCR9 Ameliorates Early but not Late Chronic Murine Ileitis. Gastroenterology,2006,131(5):1518-1529.
Objective To investigate the role and the expression of chemokine CCL25and its receptor CCR9 in ulcerative colitis(UC)and to explore the relationship between CCL25 and CCR9 and the severity of disease. Methods The level of CCL25 and CCR9 in colon mucosa of UC patients was detected by immunohistochemistry method. Results The level of CCL25 and CCR9 in colon mucosa of UC patients were much higher than that of normal controls. The expressions of CCL25 and CCR9 were related to the extent of lesion and the degree of disease. The expression of CCL25 was significantly correlated with that of CCR9(r=0.759,P<0.01). Conclusions The expression of CCL25 is correlated with that of CCR9,CCL25 and CCR9 are closely related with the occurrence and development of UC. The expressions of CCL25 and CCR9 reflect the degree of inflammation of UC,and suggesting that CCL25 or CCR9 antagonism may represent a relevant pharmacological target for the design of novel pharmacological treatments in human UC.
Ulcerative colitis CCL25 CCR9 Immunohistochemistry
315040 浙江省宁波市第六医院
1.3统计学方法 采用Stata13.0 统计软件。计量资料以(±s)表示,组间比较采用t检验。CCL25和CCR9的相关性采用线性相关分析。P<0.05为差异有统计学意义。

