TGF-β、FGF-2和Ezrin在金黄地鼠口腔癌模型中的表达
崔焕焕,李耀银,高 岩
TGF-β、FGF-2和Ezrin在金黄地鼠口腔癌模型中的表达
崔焕焕,李耀银,高 岩
目的 研究TGF-β、FGF-2和Ezrin在7,12-二甲基苯并[A]蒽(7,12 -dimethyl-benzo[A]anthracene,DMBA)诱导的金黄地鼠颊黏膜癌模型中的表达,探讨其在口腔癌癌变中的作用。方法 在金黄地鼠的单侧颊囊黏膜涂抹0.5%的DMBA,获得不同病变组黏膜标本,进行免疫组织化学检测和相关性分析。结果 在上皮中至重度异常增生和早期癌变组中,TGF-β的高表达率分别为75%和100%,FGF-2的高表达率为83%和72%,而Ezrin高表达率分别为79%和77%,明显高于正常黏膜组和单纯及轻度异常增生组,差异均有统计学意义(均P<0.01)。相关性分析显示,三者表达呈正相关(P<0.01)。结论TGF-β、Ezrin、FGF-2可能共同在口腔癌癌变过程中起重要作用。
金黄地鼠口腔癌模型;口腔鳞癌;转化生长因子;碱性成纤维细胞生长因子;埃兹蛋白
7,12-二甲基苯并[A]蒽(7,12 - dimethyl-benzo [A] anthracene, DMBA)诱发金黄地鼠颊囊癌是较常用口腔癌模型[1]。但诱癌机制研究较少,其中TGF-β、Ezrin 和FGF-2表达的研究未见报道。转化生长因子-β(TGF-β)作为一种上皮细胞生长的负性生长因子,在鳞状细胞癌(OSCC) 发生发展过程中起重要作用。研究表明,TGF-β/Smads 信号通路在抑制恶性肿瘤发生及促进恶性肿瘤的侵袭和转移中均发挥一定作用[2]。FGF-2 作为一种细胞有丝分裂原和促血管生成因子,可直接作用于肿瘤细胞分泌各种蛋白分解酶和胶原酶,从而促进肿瘤转移和浸润。 埃兹蛋白(Ezrin)属连接于细胞膜和细胞骨架之间的ERM家族成员之一,能连接CD44等黏附分子和胞质肌动蛋白,参与细胞信号转导,具有调控细胞的形态、黏附、运动、物质转运,以及为细胞的增殖和生存转换生长信号等功能,而Ezrin的异常表达和活化与肿瘤的侵袭力、转移、临床预后有密切关系。本研究采用免疫组织化学技术对DMBA诱发金黄地鼠颊囊癌过程中 TGF-β、Ezrin 和FGF-2 的表达进行检测,探讨其在口腔黏膜癌前病变癌变过程中的作用。
1 材料与方法
1.1 实验试剂 化学致癌剂0.5%二甲基苯并[A]蒽(DMBA)丙酮溶液,麻醉药品1.5%戊巴比妥钠,由北京大学医学部实验动物部提供。兔多克隆抗体anti-FGF-2(sc-79,SANTA CRUZ BIOCHENOLOGY),兔多克隆抗体anti-TGF-β(ab66043,ABCAM)鼠单克隆抗体anti-Ezrin(ab4069,ABCAM)。兔/鼠二步法免疫组化试剂盒(PV-6001/6002,中山金桥生物技术有限公司)。
1.2 动物模型的建立 90只成年SPF级叙利亚金黄地鼠由北京大学医学部实验动物部提供。雌、雄各半,体重60~80 g,分为5组,每组18只。第一组正常组,不做处理。将其余4组金黄地鼠的单侧颊囊黏膜涂抹0.5%的DMBA,每周3次,在分别持续涂抹第8、10、12、14周后取材,用1.5%戊巴比妥类麻醉药腹腔内注射麻醉下,以断头方式处死,组织钳钝性分离颊囊黏膜,切取病变组织,大小约1 cm×1.5 cm,用10%甲醛固定48 h,石蜡包埋切片。造模过程中意外死亡6只,剩下的根据病理重新分组:单纯增生及轻度异常增生(27只)、中重度异常增生(24只)、早期浸润癌(18只)、正常颊囊黏膜(15只)。
1.3 免疫组化学
1.3.1 实验步骤 4 μm厚石蜡切片常规脱蜡水化后,用 3%H2O2溶液20 min后,置于柠檬酸缓冲液(PH6.0)或EDTA修复液(PH 8.0)中微波修复抗原15 min,冷却至室温。10%羊血清封闭 30 min后加一抗4 ℃孵育过夜(TGF-β抗体1∶300 稀释。FGF-2抗体1∶500稀释,Ezrin抗体1∶200稀释)。次日采用二步法染色,显色底物为DAB。苏木精复染,梯度乙醇脱水,二甲苯透明、封片后置于显微镜下观察。每次实验均以PBS代替一抗作为阴性对照,已知阳性片作为阳性对照。
1.3.2 结果判定 以细胞质和(或)细胞核中出现棕黄色或棕褐色细颗粒为阳性,根据细胞染色强度和阳性细胞百分数分四个等级:未见阳性细胞着色为阴性(-),阳性细胞数 <10%为弱阳性(+),阳性细胞数11%~25%为中度阳性(++),阳性细胞数>50%强阳性(+++)。将(++)和(+++)者视为高表达。
1.3.3 统计学处理 应用SPSS16.0软件,对计数资料进行χ2检验和Spearman相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组化表达 (1)TGF-β。阳性颗粒弥散分布于胞质内。在正常口腔黏膜和单纯增生病变中,多为弱阳性表达,位于基底层。在中重度异常增生病变中,阳性表达主要见于基底层或基底上层,呈带状分布。在癌变组织中,阳性表达弥散分布,癌巢中心细胞为强阳性表达,表达范围可扩展到棘细胞浅层甚至上皮全层(图1A~D)。(2) FGF-2。阳性染色位于胞质和胞核。正常口腔黏膜组织中可见基底层散在的细胞着色,染色较浅。单纯增生组中多数病例的FGF-2弱阳性着色。在中重度异常增生病变中,细胞着色加深,表达范围向上皮浅层扩展至棘层,呈深褐色带状。在早期癌变的组织中,阳性表达弥散分布于胞质和胞核,棘细胞浅层甚至上皮全层可见阳性染色,早期癌或在肿瘤中分化较高的区域着色较深,癌组织染色强度明显高于周围形态学上正常的黏膜上皮(图2A~D)。(3)Ezrin。 阳性染色位于胞质和胞膜。正常口腔黏膜只有3例在基底层有散在细胞为弱阳性表达,网状结构不清晰。单纯增生组可见基底层及附近棘层细胞弱阳性着色。中重度异常增生病变中,阳性表达加强,胞膜染色深,呈明显网状结构。早期浸润癌癌巢的中心细胞为强阳性表达,表达范围可扩展到棘细胞浅层甚至上皮全层(图3A~D)。
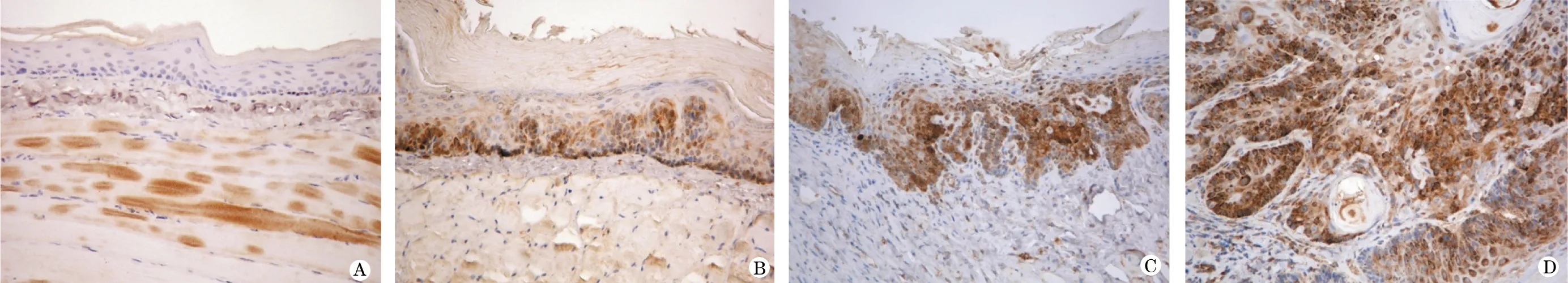
图1 TGF-β在7,12-二甲基苯并[A]蒽诱导金黄地鼠癌变过程中的表达(免疫组化染色,×100)

图2 FGF-2在7,12-二甲基苯并[A]蒽诱导金黄地鼠癌变过程中的表达(免疫组化染色,×100)

图3 Ezrin在7,12-二甲基苯并[A]蒽诱导金黄地鼠癌变过程中的表达(免疫组化染色,×100)
2.2 阳性表达率 中重度异常增生组和早期癌变组中的TGF-β、FGF-2和Ezrin阳性高表达率均明显高于正常颊囊黏膜组和单纯及轻度异常增生组的阳性率,差异均有统计学意义(P<0.01,表1)。在正常黏膜和不同增生程度的病变中,Ezrin与 FGF-2的表达(r=0.537,P<0.01),Ezrin与TGF-β的表达(r=0.695,P<0.01),以及FGF-2与TGF-β的表达(r=0.617,P<0.01)间均呈正相关关系。

表1 TGF-β、FGF-2和Ezrin在7,12-二甲基苯并[A]蒽诱导金黄地鼠癌变过程中的表达
注:与正常颊囊黏膜比较,①P<0.01;与单纯及轻度异常增生比较,②P<0.01;与中重度异常增生比较,③P<0.01
3 讨 论
有研究表明,正常生理条件下,TGF-β通过调控细胞周期,抑制细胞增殖,诱导细胞凋亡等抑制肿瘤的发生[2-4]。在肿瘤进展期,肿瘤细胞趋向于失去对 TGF-β肿瘤抑制作用的反应能力。而本实验免疫组化结果表明,随着口腔白斑上皮增生程度的加重,病变上皮中TGF-β表达逐渐增强,提示TGF-β与癌前病变的进展密切相关,促进了癌变的发生、发展。
FGF-2与多种肿瘤的发生、发展有密切关系。在肿瘤生长过程中,具备丝裂原活性的FGF-2不仅能够直接促进细胞的增殖,还可能参与肿瘤新生血管的形成[5]。有研究显示,FGF-2在口腔鳞癌中的表达比正常口腔上皮明显增强[6]。本实验结果显示,随着口腔白斑上皮增生程度的加重,病变上皮中FGF-2表达逐渐增强,且FGF-2的表达强度与口腔黏膜上皮病变程度呈正相关关系,提示FGF-2与口腔癌前病变的进展密切相关。
近年来的研究发现,在许多肿瘤组织中可见膜细胞骨架蛋白-Ezrin的高表达,如骨肉瘤[7]、乳腺癌[8]、食管癌[9]等,Ezrin蛋白异常高表达者预后较差,提示其在肿瘤的浸润、转移机制中发挥重要作用。Moilanen等[10]却发现,在浆液性卵巢癌中Ezrin蛋白表达低者预后较差,说明ezrin蛋白表达具有组织和细胞特异性,其表达水平与恶性肿瘤的转移、预后并非完全平行。本实验结果显示,Ezrin的表达强度与口腔黏膜上皮病变程度密切相关,随着上皮轻、中、重度异常增生的转变,病变上皮中Ezrin的表达逐渐增强。这与其他研究类似,提示Ezrin蛋白对口腔鳞状细胞癌的发生、发展具有促进作用。
有学者实验证明,TGF-β能够刺激成纤维细胞向肌成纤维细胞的表型转换,提示由癌细胞产生的TGF-β对有促癌作用的基质环境的形成有关键的作用[11]。Takuya等[12]发现,TGF-β可以促使上皮细胞FGFR进行同类转换,增加对FGF-2的敏感性,活化MEK-ERK通路,引起EMT的发生,从而在肿瘤发生发展中发挥重要作用。本研究发现,随口腔黏膜上皮异常病变程度的增高,TGF-β和FGF-2的表达率均提高,且两者为正相关关系,提示TGF-β和FGF-2之间的相互协同作用。本实验过程中也观察到各组病变的固有层结缔组织有不同程度的纤维增生的表现,也提示诱癌过程中有上皮间充质的相互作用。
还有研究表明,Ezrin促进食管癌生长和侵袭的机制可能与MAPK-ERK和TGF- β信号通路激活有关[9],表明TGF-β、FGF-2和Ezrin在肿瘤中的表达具有协同关系。
综上所述,随着口腔黏膜上皮异常病变程度的增高,TGF-β、FGF-2和Ezrin的表达水平逐渐增强,且三者之间的高表达有显著的正相关性,共同促进了口腔癌变的发展过程。对三者的深入研究将有助于我们进一步探究肿瘤的发生、发展的机制。
[1] Chen Y K, Lin L M. DMBA-induced hamster buccal pouch carcinoma and VX2-induced rabbit cancer as a model for human oral carcinogenesis [J]. Expert Rev Anticancer Ther, 2010, 10:1485-1496.
[2] Xu Y, Pasche B. TGF-β signaling alterations and susceptibility to colorectal cancer [J]. Hum Mol Genet, 2007, 16(R1): R14-R20.
[3] Leask A, Abraham D J. TGF-β signaling and the fibrotic response [J]. FASEB J, 2004, 18(7): 816-827.
[4] Roberts A B, Wakefield L M. The two faces of transforming growth factor beta in carcinogenesis [J]. Proc Natl Acad Sci, 2003, 100(15): 8621-8623.
[5] Polnaszek N, Kwabi-Addo B, Peterson L E,etal. Fibroblast growth factor 2 pro- motes tumor progression in an autochthonous mouse model of prostate cancer [J]. Cancer Res, 2003, 63(18): 5754-5760.
[6] Ninck S, Reisser C, Dyckhoff G,etal. Expression profiles of angiogenic growth factors in squamous cell carcinomas of the head and neck [J]. Cancer, 2003, 106: 34-44.
[7] Khanna C, Wan X, BOSE S,etal. The membrane-cytoskelet on linker ezrin is necessary for osteosarcoma metastasis [J]. Nat Med, 2004, 10(2):182-186.
[8] Li Q, Wu M, Wang H,etal. Ezrin silencing by small hairpin RNA reverses metastatic behaviors of human breast cancer cells[J]. Cancer Lett, 2008, 261(1): 55- 63.
[9] Xie J J, Xu L Y, Xie Y M,etal.Roles of ezrin in the growth and invasiveness of esophageal squamous carcinoma cells [J]. Cancer, 2009, 124(11): 2549-2558.
[10] Moilanen J, Lassus H, Leminen A,etal. Ezrin immunoreactivity in relation to survival in serous ovarian carcinoma patients [J]. Gynecol Oncol, 2003, 90(2): 273- 281.
[11] Micke P, Ostman A. Tumour-stroma interaction: cancer-associated fibroblasts as novel targets in anti-cancer therapy? [J]. Lung Cancer, 2004, 45 (Suppl2): S163-175.
[12] Takuya S, Kana H, Keiji M,etal. TGF-β regulates isoform switching of FGF receptors and epithelial-mesenchymal transition [J]. EMBO J, 2011, 30(4): 783-795.
(2015-10-20收稿 2016-03-10修回)
(责任编辑 武建虎)
Expression of TGF-β, FGF-2 and Ezrin in golden hamster oral cancer model
CUI Huanhuan, LI Yaoyin, and GAO Yan.
Department of Oral Pathology and Central Laboratory, Peking University School and Hospital of Stomatology, Beijing 100081, China
Objective To investigate the expression of TGF-β, Ezrin and FGF-2 in 7, 12 - dimethyl-benzo [A] anthracene (DMBA) induced golden hamster oral cancer model and evaluate the role of TGF-β, Ezrin and FGF-2 in oral mucosal precancerosis process.Methods The unilateral cheek mucosa of the golden hamsters was treated with 0.5% DMBA and a series of samples were obtained. The expression of TGF-β, Ezrin and FGF-2 was examined by immunohistochemistry. Meanwhile, the correlation between the expressions of these three factors was analyzed.Results In moderate to severe epithelial dysplasia and early cancer groups the high TGF-β-positive rate was 75% and 100% respectively, while high FGF-2-posotive rates was 83% and 72% and high expression rate of Ezrin was 79% and 77%. Compared with mild epithelial dysplasia group and normal mucosa group, there was a significant difference (P<0.01). Furthermore, there was a significant correlation among the expressions of TGF-β, Ezrin and FGF-2.Conclusions TGF-β, Ezrin and FGF-2 may play an important role and have an interaction effect in the carcinogenesis of oral squamous cell carcinoma.
golden hamster oral cancer model; oral squamous cell carcinoma; transforming growth factor-beta(TGF-β); basic fibroblast growth factor (FGF-2) ; Ezrin
国家自然基金课题(30973338)
崔焕焕,硕士,医师。
100081,北京大学口腔医学院·口腔医院口腔病理科与中央实验室
高 岩,E-mail:gaoyan0988@163.com
R730.4

