四君子汤对FCIR大鼠大脑皮质神经保护作用的实验研究
邓文祥,李亮,吴华英,潘继兴,蔡雄,曾光,黄惠勇*
(湖南中医药大学中医诊断学湖南省重点实验室,湖南长沙410208)
四君子汤对FCIR大鼠大脑皮质神经保护作用的实验研究
邓文祥,李亮,吴华英,潘继兴,蔡雄,曾光,黄惠勇*
(湖南中医药大学中医诊断学湖南省重点实验室,湖南长沙410208)
目的探讨四君子汤对局灶性脑缺血再灌注(focal cerebral ischemia-reperfusion,FCIR)大鼠大脑皮质神经保护作用的机制。方法将48只SD雄性大鼠随机分成对照组、模型组、尼莫地平组(10.80 mg/kg)、四君子汤组(6 g/kg),每组12只。运用大脑中动脉栓塞法制备大鼠FCIR模型,对照组和模型组给予生理盐水,其它各组则用相应药物连续灌胃14 d。运用Zea-Longa 5级评分法评定FCIR大鼠神经功能,免疫组化检测层粘连蛋白(laminin,LN)、组织金属蛋白酶抑制剂1(tissue inhibitor of matrix metalloproteinases 1,TIMP1)和基质金属蛋白酶9(matrix metalloproteinases 9,MMP9)表达。结果与对照组比较,模型组神经功能评分显著增加(P<0.01);与模型组比较,四君子汤组、尼莫地平组神经功能评分均明显减少(P<0.01),且四君子汤组、尼莫地平组组间差异无统计学意义(P>0.05)。模型组大脑皮质LN阳性表达明显低于对照组(P<0.01),四君子汤和尼莫地平组LN阳性表达明显高于模型组(P<0.01)。模型组大脑皮质TIMP1、MMP9阳性表达明显高于对照组(P<0.01)。四君子汤和尼莫地平组TIMP1阳性表达明显高于模型组(P<0.01),而MMP9阳性表达明显低于模型组(P<0.01)。结论四君子汤可能通过促进LN和TIMP1表达,抑制MMP9表达,减轻大鼠的神经功能症状,进而对FCIR大鼠大脑皮质起到神经保护作用。
四君子汤;脑缺血再灌注;层粘连蛋白;基质金属蛋白酶的组织抑制剂1;基质金属蛋白酶9
脑缺血损伤过程中,细胞外基质(extracellular matrix,ECM)在酶解作用下降解,导致细胞间信号传递失调,从而造成神经元损伤、凋亡。ECM是构成血脑屏障的主要成分,也是神经元赖以生存的外环境和载体,能稳定神经系统内环境学,与中医学“脾土”的功能相似,ECM的功能当属中医学“脾土”功能的范畴,因此刘旺华等提出健脾补土法治疗脑缺血的理论[1-2]。
血管细胞外基质成分的合成和降解在正常生理情况下保持着动态平衡,基质金属蛋白酶(matrix metalloproteinases,MMPs)参与了所有ECM成分的调节,能够降解ECM的大部分成分[3]。脑缺血过程中,微血管基底膜的损伤导致层粘连蛋白(laminin,LN)表达减少,与纤溶酶原激活系变化有关;组织金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinases,TIMPs)是MMPs的特异性内源性抑制剂,可阻断MMPs与底物的结合,防止ECM降解,TIMP1为其家族主要成员之一。ECM的降解可以破坏脑微血管结构的完整性,同时损坏血脑屏障,导致继发性脑水肿以及脑损伤。研究发现,健脾补土法组方能减少神经元凋亡对于脑卒中后遗症,其机制可能是通过抑制MMP9表达以及LN降解[4]。本研究从LN、TIMP1和MMP9蛋白的表达探讨健脾补土法名方四君子汤对大脑皮质的神经保护作用,探讨四君子汤脑保护作用的可能机制,以期为临床抗脑缺血/再灌注损伤提供新的思路。
1 材料
1.1动物
清洁级SD大鼠48只,雄性,体质量280~ 300 g。动物由湖南斯莱克景达实验动物有限司提供,许可证号:SCXK(湘)2013-0004。常规饲养,运用12 h交替光线进行照明,实验室通风良好,室温控制在21~26℃,相对湿度保持在40%~50%。
1.2药物
选用健脾补土名方四君子汤(由人参9 g,白术9 g,茯苓9 g,炙甘草6 g组成)。水煎液浓缩为含生药2 g/mL,4℃冰箱冷藏备用。尼莫地平:购于德国拜耳公司,规格30 mg,溶于蒸馏水配成3.6 mg/mL备用。
1.3主要试剂和仪器
TIMP1兔抗鼠多克隆抗体(Proteintech公司),MMP9兔抗鼠多克隆抗体(Proteintech公司),LN兔抗鼠多克隆抗体(Proteintech公司),PV-9000二步法通用试剂盒(北京中杉金桥生物公司),DAB显色试剂盒(北京中杉金桥生物公司)。手动石蜡切片机(中国浙江金华),显微摄像图像分析系统(麦克奥迪实业集团公司)。
2 方法
2.1动物分组及给药
将48只SD大鼠随机分为4组,对照组、模型组、尼莫地平组(10.8 mg/kg)、四君子汤组(6 g/kg)每组12只。从造模前3 d开始给药,每天1次,剂量根据人临床剂量按动物体表面积换算,对照组、模型组大鼠用等体积蒸馏水灌胃。连续灌胃14 d。
2.2模型制备及模型筛选
采用大脑中动脉栓塞法制备大鼠局灶性脑缺血/再灌注(focal cerebral ischemia/reperfusion, FCIR)模型[5]。运用Zea-Longa[6]的5级4分评分标准对模型进行筛选:0分,正常,无神经功能缺损;1分,左前肢不能充分伸展,轻度神经功能缺损;2分,行走时,大鼠向瘫痪侧(左侧)转圈,中度神经功能缺损;3分,行走时,大鼠身体向瘫痪侧(左侧)倾倒。重度神经功能缺损;4分,不能自发行走,有意识丧失。模型只保留神经功能障碍在1级以上的大鼠,不成功者剔除,补充动物,保证每组动物12只。
2.3标本采集及处理
灌胃后第15 d,用10%水合氯醛腹腔注射麻醉并固定大鼠,用200 mL生理盐水经左心室快速灌注,至流出液变清,再用4%多聚甲醛缓慢灌注固定30 min,至肝脏变硬白后断头取脑,置于4%多聚甲醛固定4 h。石蜡切片机做冠状切片,片厚5μm。
2.4指标检测
2.4.1神经功能评分神经功能评分参照Longa 5级4分法[6],各组动物在手术完全清醒后和灌注后第15天处死前2 h进行评分。
2.4.2免疫组化检测LN、TIMP1和MMP9表达具体步骤如下:切片脱蜡、水化组织切片;3%双氧水孵育10 min以阻断内源性过氧化物酶;入PBS修复液置微波炉修复抗原,PBS冲洗,2 min×3次;滴加一抗LN、TIMP1或MMP9(均为1∶100),4℃过夜;PBS冲洗,2 min×3次;滴加试剂1,37℃孵育20 min,PBS冲洗,2 min×3次;滴加试剂2(试剂盒自带)37℃孵育20 min,PBS冲洗,2 min×3次;应用DAB溶液显色,自来水充分冲洗、复染、脱水、透明、封片。
显微镜下LN主要为细胞外基质染成棕黄色颗粒状。TIMP1、MMP9阳性主要表达于细胞质,为黄色或棕黄色。采用彩色图像分析系统,每张切片400倍下随机取6个不重叠的视野,测定阳性表达的面积密度及平均光密度,计算整合光密度值(IOD),IOD=面积密度×平均光密度;阳性反应越大,表示反应越强。
2.5统计学分析
应用SPSS 17.0统计软件进行分析,所有数据均采用“±s”表示。组间两两比较方差齐者用LSD法检验,方差不齐者用Dunnett's T3法检验,P<0.05为差异有统计学意义。
3 结果
3.1各组大鼠肢体神经功能评分情况
与对照组比较,模型组神经功能评分显著增加,差异有显著统计学意义(P<0.01);与模型组比较,四君子汤组、尼莫地平组神经功能评分均明显减少,差异有统计学意义(P<0.01),且四君子汤组、尼莫地平组组间差异无统计学意义(P>0.05)。见表1。
3.2四君子汤对FCIR大鼠大脑皮质LN蛋白表达的影响
对照组LN在神经元及血管细胞外基质呈强阳性表达,染色呈深棕色,厚度适中。模型组、四君子汤组、尼莫地平组表达减弱,染色较淡和厚度变小等。对照组LN在颞叶皮质表达呈强阳性表达;模型组LN表达明显降低,染色淡;四君子汤组和尼莫地平组LN表达降低,染色较淡。模型组大脑皮质LN阳性表达明显低于对照组(P<0.01),四君子汤和尼莫地平组LN阳性表达明显高于模型组(P<0.01)见表1,图1。
3.3四君子汤对FCIR大鼠大脑皮质TIMP1、MMP9蛋白表达的影响
胞浆或胞核着色呈棕黄色为TIMP1阳性细胞。对照组偶见少量TIMP1、MMP9阳性表达;模型组TIMP1、MMP9阳性表达应激性升高;四君子汤组和尼莫地平组TIMP1阳性表达增多,MMP9阳性表达减少。模型组大脑皮质TIMP1、MMP9阳性表达明显高于对照组(P<0.01)。四君子汤和尼莫地平组TIMP1阳性表达明显高于模型组(P<0.01),而MMP9阳性表达明显低于模型组(P<0.01)。见表1,图2、3。

图1 各组大鼠皮质LN表达显微光镜图(免疫组化×400)

图2 各组大鼠皮质TIMP1显微光镜图(免疫组化×400)
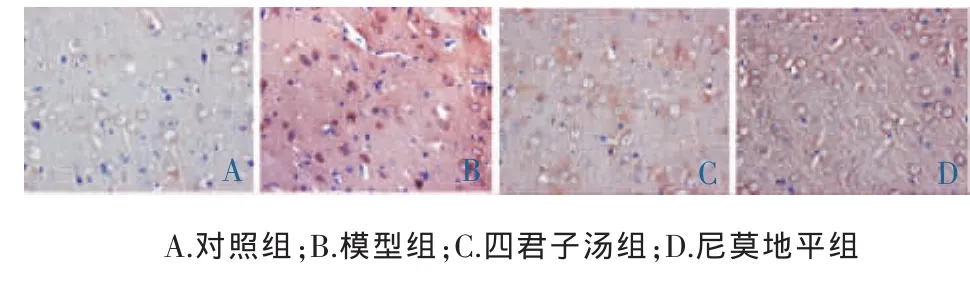
图3 各组大鼠皮质MMP9显微光镜图(免疫组化×400)
表1 各组大鼠神经功能评分及LN、TIMP1、MMP9表达的光密度比较(±s)
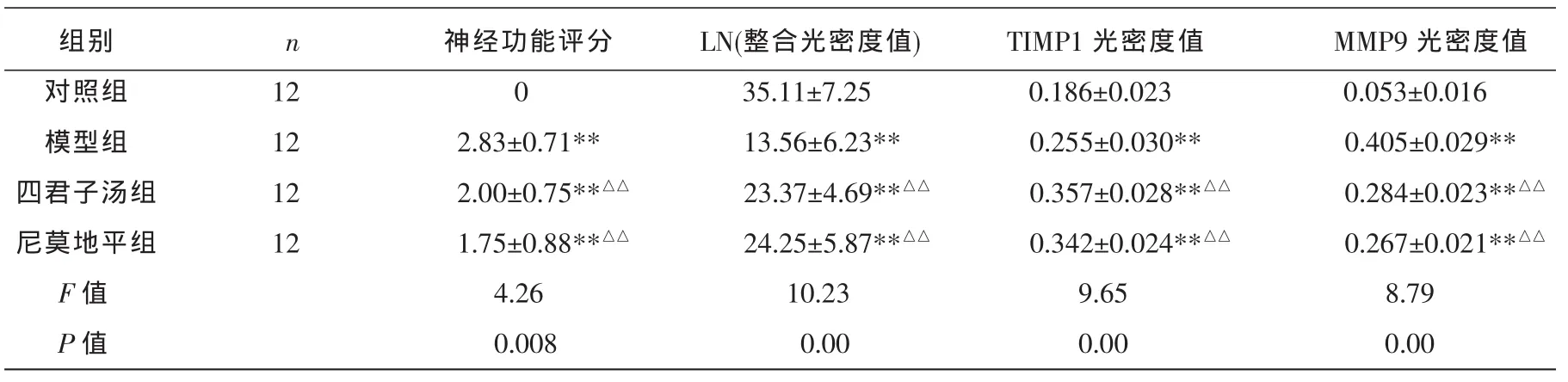
表1 各组大鼠神经功能评分及LN、TIMP1、MMP9表达的光密度比较(±s)
注:与对照组比较**P<0.01,与模型组比较△△P<0.01。
组别n神经功能评分LN(整合光密度值)TIMP1光密度值MMP9光密度值对照组12 0 35.11±7.25 0.186±0.023 0.053±0.016模型组12 2.83±0.71**13.56±6.23**0.255±0.030**0.405±0.029**四君子汤组12 2.00±0.75**△△23.37±4.69**△△0.357±0.028**△△0.284±0.023**△△尼莫地平组12 1.75±0.88**△△24.25±5.87**△△0.342±0.024**△△0.267±0.021**△△F值4.26 10.23 9.65 8.79 P值0.008 0.00 0.00 0.00
4 讨论
缺血性脑血管病以其高发病率和高致残率成为当前威胁人类健康的三大主要疾病之一,是威胁中老年人健康的常见疾病[7]。
脑缺血后神经元凋亡是脑损伤和神经功能缺损的重要原因,近年来研究发现,“失巢凋亡”是神经元凋亡的重要途径,脑缺血损伤过程中,ECM在酶解作用下降解,同时,导致细胞间信号传递失调,从而造成神经元损伤、凋亡,即所谓“失巢凋亡”。“脾为后天之本,气血生化之源”是中医学的基本理论之一,“脾者土也……土者生万物……”,土为坤元,“至哉坤元,万物滋生,坤厚载物”。而ECM是神经元赖以生存的外环境和载体,如同神经元的“巢穴”,具有承载、营养、保护、促进神经元突触生长、促进干细胞转化为神经元的作用,从这一角度来看,ECM的功能当属中医学“脾土”功能的范畴,而“失巢凋亡”当属脾虚承载功能不足的范畴。神经细胞外ECM的破坏和降解在FCIR损伤过程中发挥重要作用,LN为ECM的重要组成成分。李瑞梅等[8]研究发现FCIR后LN的表达先降低后回升,与血脑屏障的病理性改变有关,其可造成继发性脑水肿损伤;与促使新生血管生成相关联。TIMPs是MMPs的特异性抑制剂,特异性抑制MMPs的活性。当机体出现缺血缺氧性变化出现在脑组织中时,大量的MMP9将由组织中的血管内皮细胞以及中性粒细胞分泌并且释放,同时,MMP9与炎症的发生关系较为密切,ECM的降解与其释放呈正相关,可能增加血脑屏障的通透性,进一步诱导血管脑源性水肿[9]。正常情况下,MMPs和TIMPs相互作用,使ECM处于动态平衡中。因此,如果MMP和TIMP之间的平衡被打破,有可能会影响到ECM的合成与降解。黄越等[10]研究发现TIMP1在新生鼠缺血脑组织表达明显增加,可能与新生鼠缺血脑组织损伤有关。
四君子汤出自《太平惠民和剂局方·卷三》,是健脾补土的名方,该方以人参为君,甘温益气,补中健脾养胃;白术苦温,健脾燥湿,湿去脾自健,合人参益气助运之力为臣;茯苓甘淡为佐,健脾渗湿,苓术合用,则进一步增强健脾除湿以及运化之力;炙甘草甘温,益气和中,调和诸药,共同发挥补气健脾功效为使。四药配伍,共奏益气健脾之功。脾为后天之本,气血生化之源,《灵枢·海论》记载“脑为髓之海脑”,《素问·脉要精微论》记载“头者,精明之府”,其与人体的生命、精神以及感觉等方面密切相关。《素问·经脉别论》记载:“饮入于胃,游溢精气,上输于脾,脾气散精,上归于肺。及脾主升清,运化水谷精微濡养脑髓。由此可见脾脑相关的桥梁可能通过脾胃的气机升降功能实现,为其脑部病变的防治提供了理论依据[11]。
本实验结果显示,FICR后可见明显神经功能损害,ECM在酶解作用下降解,与文献报道基本相符[8-10],提示ECM在FCIR所致神经元损伤中发挥重要作用。而四君子汤组和尼莫地平组TIMP1阳性表达高于模型组,MMP9阳性表达明显减少,LN阳性表达明显多于模型组,提示四君子汤对神经功能具有保护作用,其机制可能与促进LN和TIMP1表达,抑制MMP9表达,从而维护细胞外基质完整性、保护神经元细胞有关。其具体机制有待研究。现代研究表明[12]人参皂苷Rb1可能在脑缺血死后神经可塑性中起促进作用,与其促进大鼠局灶性脑缺血后脑白质重塑有关;研究发现[13]人参皂苷Rg2可通过减少缺血再灌注大鼠神经功能评分,减少脑梗死面积,提高胆碱能神经活性,对脑缺血再灌注损伤具有防护作用。这可能是四君子汤脑保护作用的物质基础之一。
[1]刘旺华,李花,周小青.论神经细胞外基质与中医脾土相关及其对脑缺血保护的启示[J].中国中医药信息杂志,2010,17(3):5-6,56.
[2]付小金,刘旺华,李花,等.健脾补土方对脑缺血/再灌注损伤大鼠NF-κB和IκBα蛋白表达水平的影响[J].湖南中医药大学学报, 2015,35(3):5-8+73.
[3]Chang JH,Huang YH,Cunningham CM,et al.Matrix metalloprotei nase 14 modulates signal transduction and angiogenesis in the cornea[J].Surv Ophthalmol,2015,61(4):478-97.
[4]李花,刘旺华,周小青,等.健脾补土法对脑缺血再灌注大鼠脑组织MMP-2的表达及血脑屏障通透性的影响[J].湖南中医杂志, 2013,29(2):115-117.
[5]Gui YK,Su LL,Niu XL,et al.Effects of MK-801 concentration on cell proliferation in rats with focal cerebral ischemiareperfusion[J].Genet Mol Res,2015,14(4):12841-12847.
[6]陈斌,李钻芳,林如辉,等.电针调控细胞周期相关蛋白对局灶性脑缺血大鼠皮质细胞增殖的影响[J].中国康复医学杂志,2016,31 (07):729-733.
[7]雷丽萍,刘旺华,周鸿图,等.中医药促进神经干细胞增殖与分化用于抗脑缺血损伤的研究进展[J].医学综述,2013,19(19):3466-3469.
[8]李瑞梅,杨迎春,任占川.大鼠脑缺血再灌注后层粘连蛋白表达的研究[J].中外医疗,2011,5(14):23-24.
[9]王思念,黄志梅.银杏达莫注射液对急性脑梗死患者MMP-9、血管内皮功能及预后的影响[J].医学综述,2016,22(8):1597-1599.
[10]黄越,吴春,刘增荣,等.新生鼠缺血脑组织MMP-9、TIMP1表达及其意义[J].川北医学院学报,2012,27(3):250-252.
[11]陈丽娟,冯珂.论脾与脑的相关性[J].山东中医药大学学报, 2016,40(1):11-13.
[12]胡光强,张慧,萧洪文,等.人参皂苷Rbl对大鼠局灶性脑缺血白质重塑的影响[J].中国临床解剖学杂志,2015,33(4):451-454.
[13]陈美华,吴月鹏,张颜波,等.人参皂苷Rg2对脑缺血再灌注大鼠神经保护作用的研究[J].中风与神经疾病杂志,2014,31(12): 1089-1092.
(本文编辑 杨瑛)
Neuroprotective Effect of Sijunzi Decoction on Cerebral Cortex in FCIR Rats
DENG Wenxiang,LI Liang,WU Huaying,PAN Jixing,CAI Xiong,ZENG Guang,HUANG Huiyong*
(Provincial Key Laboratory of TCM Diagnostics,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
Objective To explore the mechanism of neuroprotective effect of Sijunzi Decoction on cerebral cortex in focal cerebral ischemia-reperfusion (FCIR)rats.Methods 48 male Sprague Dawley(SD)rats were random ly divided into control group,model group,nimodipine group and Sijunzi Decoction group,with 12 rats in each group.The FCIR rat models were established by middle cerebral artery occlusion.The control and model groups were treated with normal saline for 14 d, while nimodipine and Sijunzi Decoction groups were treated with nimodipine(10.80 mg/kg)and Sijunzi Decoction(6 g/kg)for 14 d,respectively.The neural function of FCIR rats was assessed according to five grade scale proposed by Zea-Longa.The expressions of LN,TIMP1 and MMP9 protein were determined by immunohistochemistry.Results Compared with the control group,scores of neural function increased remarkably in model group(P<0.01).Compared with the model group,the scores of nimodipine and Sijunzi decoction groups decreased remarkably(P<0.01),but there was no difference between nimodipine and Sijunzi decoction groups(P>0.05).The expression of LN in model group was lower than that in the control group(P<0.01),while the LN expression in nimodipine and Sijunzi decoction groups was higher than that in the model group(P<0.01).The expression of TIMP1 and MMP9 in the model group was obviously higher than that in the control group(P<0.01).The TIMP1 postive expression of nimodipine and Sijunzi decoction groups was obviously higher than that in model group(P<0.01),while the expressiom of MMP9 was lower than that in the model group(P<0.01).ConclusionThe neuroprotective effect of Sijunzi Decoctioon on cortex in FCIR rats may be by promoting the expression of LN and TIMP1,inhibiting the expression of MMP9,improving the neural function.
Sijunzi Decoction;cerebral ischemia reperfusion;LN;TIMP1;MMP9
R285.5;R743.3
A
10.3969/j.issn.1674-070X.2016.11.003
2016-05-21
湖南省教育厅科学研究项目重点项目(60010408);湖南省科技厅社会发展支撑计划重点项目(2014S2032);湖南省中医药科研计划项目(2014153);中医诊断学国家重点学科建设项目(2013ZYZD04);湖南中医药大学研究生院华润三九科研创新项目(2015SJ01)。
邓文祥,男,在读硕士研究生,研究方向:中医辨证学与数字中医药。
*黄惠勇,男,教授,博士研究生导师,E-mail:tony427000@aliyun.com。

