苦参碱逆转人结肠癌细胞株(HT-29)奥沙利铂耐药性的作用及机制研究
张冬梅,张雅明*
(上海中医药大学附属曙光医院,上海200000)
苦参碱逆转人结肠癌细胞株(HT-29)奥沙利铂耐药性的作用及机制研究
张冬梅,张雅明*
(上海中医药大学附属曙光医院,上海200000)
目的研究苦参碱对结肠癌耐药细胞HT-29/奥沙利铂(Oxaliplatin,OXA)耐药性的逆转作用并探讨其可能的作用机制。方法采用逐步增加药物浓度的方法建立奥沙利铂耐药结肠癌细胞株HT-29/OXA;CCK-8法测定苦参碱对HT-29/OXA细胞的耐药性逆转作用,流式细胞术检测细胞凋亡、周期变化;实时定量PCR检测各组细胞肺耐药蛋白(lung resistance protein LRP)和P-glycoprotein(P-gp)mRNA表达水平;Western blot检测各组细胞LRP和P-gp蛋白的表达水平。结果苦参碱使HT-29/OXA细胞对奥沙利铂的敏感性增加,耐药性得到部分逆转。奥沙利铂(0.5μg/mL)和苦参碱(3.0μg/mL)单独用药对结肠癌耐药细胞株HT-29/OXA细胞周期以及细胞凋亡没有影响;联合用药对HT-29/OXA生长增殖具有明显抑制作用并且能够通过改变细胞周期引起凋亡(P<0.05)。奥沙利铂(0.5μg/mL)和苦参碱(3.0μg/mL)单独用药对HT-29/OXALRP和P-gp mRNA以及蛋白的表达没有影响;联合用药作用后LRP mRNA和P-gp mRNA表达水平降低(P<0.01),同时下调了LRP和P-gp蛋白表达(P<0.01)。结论苦参碱部分逆转HT-29/OXA细胞对奥沙利铂的耐药性,其机制可能与细胞内LRP和P-gp表达降低有关。
结肠癌;HT-29;奥沙利铂;多药耐药性;苦参碱
结肠癌的发病率以及死亡率位居我国恶性肿瘤的第三位,目前的治疗手段以手术切除为主,同时联合放疗、化疗来降低手复发率,提高生存率[1-2]。但目前应用的化疗药物以及方案的总体疗效并不理想,其主要原因是化疗过程中结肠癌细胞的多药耐药现象导致化疗失败[3-4]。苦参碱(Matrine)是中药苦参的主要活性成分之一,广泛存在于豆科植物苦参、苦豆子及广豆根中,药用广泛。苦参碱是苦参中的抗癌有效成分,对肝癌、胃癌、肺癌、乳腺癌和直肠癌等细胞均具有生长抑制作用[5-9],但是其对癌细胞耐药性的逆转作用尚未有报道。本研究旨在探讨苦参碱对结肠癌耐药细胞HT-29/奥沙利铂(oxaliplatin,OXA)耐药性的逆转作用并探讨其可能的作用机制。
1 材料与仪器
1.1细胞
HT-29细胞株购自美国ATCC公司。
1.2主要试剂与药物
RPMI1640培养基,小牛血清购自美国Gibco公司;奥沙利铂、苦参碱、四甲基偶氮唑蓝(MTT)购自Sigma公司;CCK-8试剂盒购自日本同仁化学研究所;Annexin V-FITC apoptosisdetection kit凋亡检测试剂盒及Cycle TESTTTM PLUS DNA Reagent Kit细胞周期检测试剂盒均购自美国BD公司;Trizol购自Invitrogen公司;肺耐药蛋白(lung resistance protein LRP mRNA)、P-glycoprotein(P-gp)、GAPDH引物由广州瑞博公司合成;鼠抗人LRP蛋白单克隆抗体以及鼠抗人P糖蛋白(P-gp)单克隆抗体购自Abcam公司。
1.3主要仪器
Synergy 2多功能酶标仪(广州吉源生物科技有限公司);Light Cycler 480实时定量PCR仪(德国罗氏公司);Attune NxT流式细胞仪(美国Thermo Fisher Scientific公司)。
2 方法
2.1细胞培养
结肠癌细胞HT-29常规培养于RPMI1640培养液中,内含10%小牛血清、1%双抗液(青霉素100 U/mL、链霉素100 U/mL),于5%CO2、37℃培养箱中恒温培养。
2.2奥沙利铂耐药结肠癌细胞的建立
取对数生长期HT-29细胞,调整细胞密度为1×105/mL,加入奥沙利铂(0.1μg/mL)培养液连续作用48 h,弃去上清液;加入不含奥沙利铂的新鲜培养液继续培养,待细胞恢复正常生长后,消化传代,再用奥沙利铂(0.1μg/mL)培养液连续作用细胞48 h。如此反复换液、传代,逐步提高奥沙利铂的浓度(0.1、0.15、0.2、0.25、0.3μg/mL),当细胞在含0.3μg/mL奥沙利铂培养液中稳定生长时,以含加倍质量浓度(0.6、1.2μg/mL)大剂量奥沙利铂培养液对HT-29细胞进行间断诱导,最终获得对奥沙利铂耐药的HT-29细胞,即HT-29/OXA。用于后续实验的细胞于实验前1周停止奥沙利铂的处理。
2.3CCK-8法检测HT-29细胞活力
取对数生长期的HT-29/OXA细胞以1×105个细胞/孔接种于96孔培养板培养,分为对照组(生理盐水)、苦参碱单药组(1.0、3.0、10.0μg/mL)、奥沙利铂单药组(0.05、0.5、5.0μg/mL)及梯度浓度奥沙利铂与苦参碱联合用药组,每组设3个复孔,将各组细胞培养48 h后,每孔加入CCK-8试剂10μL,37℃孵育1 h,多功能酶标仪在450 nm波长处测定OD值。细胞生长率(%)=实验组OD平均值/对照组OD平均值×100%。
2.4流式细胞仪分析
将HT-29/OXA细胞接种于6孔培养板,24 h后分为对照组(溶剂组)、苦参碱单药(3.0μg/mL)、奥沙利铂单药(0.5μg/mL)及奥沙利铂与苦参碱联合用药,继续培养48 h后获取细胞,PBS洗涤,加入70%冷乙醇固定后重新收集细胞,PBS洗去固定液,加入RNA酶反应过夜,与碘化丙啶(PI)染液混匀后,用流式细胞仪作流式细胞分析,汞激发波长为488 nm,并用ModFit LT2.0软件分析细胞周期分布及凋亡情况,计算各期细胞所占比例及凋亡率。
2.5实时定量PCR分析LRPmRNA和P-gp mRNA的表达
将HT-29/OXA细胞接种于6孔培养板24 h后,分为对照组(溶剂组)、苦参碱单药(3.0μg/mL)、奥沙利铂单药(0.5μg/mL)及奥沙利铂与苦参碱联合用药,继续培养48 h后获取细胞,根据使用说明书,使用Trizol试剂提取HT-29/OXA细胞中的RNA,检测所提RNA的浓度和纯度,使用总RNA作为模板合成cDNA第一链。根据操作说明,使用LightCycler 480实时定量PCR仪对cDNA样品进行实时定量聚合酶链反应,LRP,P-gp,GAPDH引物序列如下:LRP上游5’-GCATTATTCGCACTGCTGTC-3’,下游5’-AGCCTCCAGCTCCAAGAGTT-3’;P-gp上游5’-GATATTGCCTGGTTTGATGA-3’,下游5’-TGCATTTTGTGTTAAGACGC-3’,GAPDH上游5’-TTTG-GTATCGTGGAAGGACT-3’;下游5’-AGTAGAGGCAGGGATGATGT-3’。GAPDH作为内参,通过比较2-ΔΔCt值进行相对定量分析。
2.6 Western-blot分析LRP和P-gp蛋白表达
将HT-29/OXA细胞接种于6孔培养板24 h后,分为对照组(溶剂组)、苦参碱单药(3.0μg/mL)、奥沙利铂单药(0.5μg/mL)及奥沙利铂与苦参碱联合用药,继续培养48 h后获取细胞,提取蛋白质后,进行SDS-PAGE电泳(分离胶12%,浓缩胶5%),每孔加入50 pg蛋白质,恒压120 V电泳至分离胶底部,转移到硝酸纤维素膜上,封闭2 h,加入1∶2 000稀释的LRP单克隆抗体或者1∶1 500稀释的P-gp单克隆抗体,4℃孵育过夜,PBST洗涤3次,每次15 min。再加入1∶400稀释的羊抗小鼠IgG-HRP,振摇2 h,PBST洗涤3次,ECL试剂显色、曝光并拍照,扫描后用ImageJ图像分析软件进行光密度积分值分析。
2.7统计学分析
采用SPSS 16.0软件进行数据分析。采用独立样本的t检验或者单因子方差分析(One-way ANOVA)检验,对不同实验组之间的数据进行比较。所有数据以“±s”来表示,P<0.05为差异有统计学意义。
3 结果
3.1苦参碱对HT-29/OXA细胞的耐药性逆转作用
通过CCK-8实验进一步发现(表1),不同浓度(0-5μg/mL)的奥沙利铂联合1.0、3.0、10.0μg/mL苦参碱作用于HT-29/OXA细胞,其IC50分别为3.7、1.6、1.1μg/mL,与空白对照组(0μg/mL苦参碱,IC50为4.2μg/mL)相比具有显著性差异(P<0.001)。苦参碱使HT-29/OXA细胞对奥沙利铂的敏感性增加,耐药性得到部分逆转。
3.2苦参碱联合奥沙利铂用药对HT-29/OXA细胞的细胞周期分布以及细胞凋亡率的影响
表1 CCK-8检测梯度浓度苦参碱联合奥沙利铂作用HT-29/OXA细胞的生存率(%)及IC50的比较(±s,n=3,%)
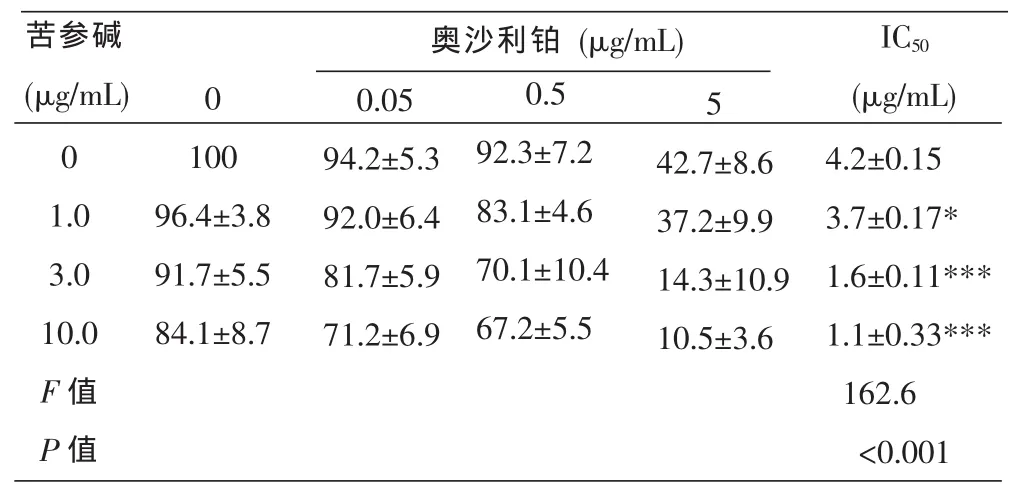
表1 CCK-8检测梯度浓度苦参碱联合奥沙利铂作用HT-29/OXA细胞的生存率(%)及IC50的比较(±s,n=3,%)
注:奥沙利铂联合1.0μg/mL苦参碱组IC50与奥沙利铂联合0μg/mL苦参碱组IC50相比,*P<0.05;奥沙利铂联合3.0、10.0 μg/mL苦参碱组IC50分别与奥沙利铂联合0μg/mL苦参碱组IC50相比,***P<0.001。
奥沙利铂(μg/mL)苦参碱(μg/mL)0 5 0 1.0 3.0 10.0 F值P值100 96.4±3.8 91.7±5.5 84.1±8.7 0.05 94.2±5.3 92.0±6.4 81.7±5.9 71.2±6.9 0.5 92.3±7.2 83.1±4.6 70.1±10.4 67.2±5.5 42.7±8.6 37.2±9.9 14.3±10.9 10.5±3.6 IC50(μg/mL) 4.2±0.15 3.7±0.17* 1.6±0.11*** 1.1±0.33*** 162.6<0.001
与对照组相比,奥沙利铂(0.5μg/mL)和苦参碱(3.0μg/mL)单独用药对细胞周期以及细胞凋亡没有影响。奥沙利铂(0.5μg/mL)联合苦参碱(3.0μg/mL)作用于HT-29/OXA细胞48 h后,流式细胞仪的检测结果显示HT-29/OXA细胞周期明显受到影响,其中G0/G1期细胞的比例显著性地高于奥沙利铂组(P=0.027)和苦参碱组(P=0.032),而S期和G2/M细胞比例显著性地高于奥沙利铂组(S期: P=0.012;G2/M期:P=0.024)和苦参碱组(S期:P=0.041;G2/M期:P=0.021),证实了奥沙利铂联合苦参碱用药可以抑制HT-29/OXA细胞的增殖。流式细胞术结果同时显示联合组的细胞凋亡率(45.3± 6.7)%显著高于奥沙利铂组[(20.7±5.5)%;P=0.0025]和苦参碱组[(20.3±4.5)%;P=0.0037),进一步证明了奥沙利铂联合苦参碱对结肠癌耐药细胞株HT-29/ OXA生长增殖具有明显抑制作用。见表2。
3.3实时定量PCR检测LRPmRNA和P-gp mRNA表达的变化
结果显示,与对照组相比,奥沙利铂(0.5μg/mL)和苦参碱(3.0μg/mL)单独用药对LPR mRNA以及P-gp mRNA的表达水平没有影响(图1A);奥沙利铂(0.5μg/mL)联合苦参碱(3.0μg/mL)作用于HT-29/ OXA细胞48 h后,LRP mRNA和P-gp mRNA表达水平相对于奥沙利铂组(LRP mRNA:P=0.0082; P-gp mRNA:P=0.0073)或者苦参碱组(LRP mRNA: P=0.0056;P-gp mRNA:P=0.0087)显著性地降低(图1A)。
表2 流式细胞仪分析不同药物作用48 h后HT-29/OXA细胞的细胞周期和凋亡(±s,n=3,%)
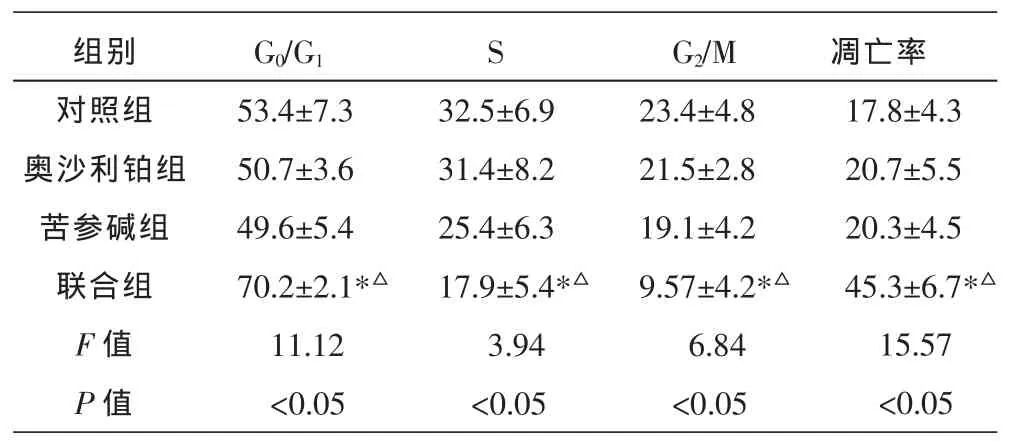
表2 流式细胞仪分析不同药物作用48 h后HT-29/OXA细胞的细胞周期和凋亡(±s,n=3,%)
注:与奥沙利铂组相比,*P<0.05;与苦参碱组相比,ΔP<0.05。
组别对照组奥沙利铂组苦参碱组联合组F值P值G0/G153.4±7.3 50.7±3.6 49.6±5.4 70.2±2.1*Δ11.12<0.05 S 32.5±6.9 31.4±8.2 25.4±6.3 17.9±5.4*Δ3.94<0.05 G2/M 23.4±4.8 21.5±2.8 19.1±4.2 9.57±4.2*Δ6.84<0.05凋亡率17.8±4.3 20.7±5.5 20.3±4.5 45.3±6.7*Δ15.57<0.05
3.4 LRP蛋白和P-gp蛋白表达的变化
实时定量PCR实验结果显示,与对照组相比,奥沙利铂(0.5μg/mL)和苦参碱(3.0μg/mL)单独用药对LPR蛋白以及P-gp蛋白的表达水平没有影响(图1B);奥沙利铂(0.5μg/mL)联合苦参碱(3.0μg/mL)作用于HT-29/OXA细胞48 h后,LRP蛋白和P-gp蛋白表达水平相对于奥沙利铂组(LRP蛋白:P=0.000 23;P-gp蛋白:P=0.004 5)或者苦参碱组(LRP蛋白:P=0.000 29;P-gp蛋白:P= 0.000 54)显著性地降低(图1B)。电泳图见图2。
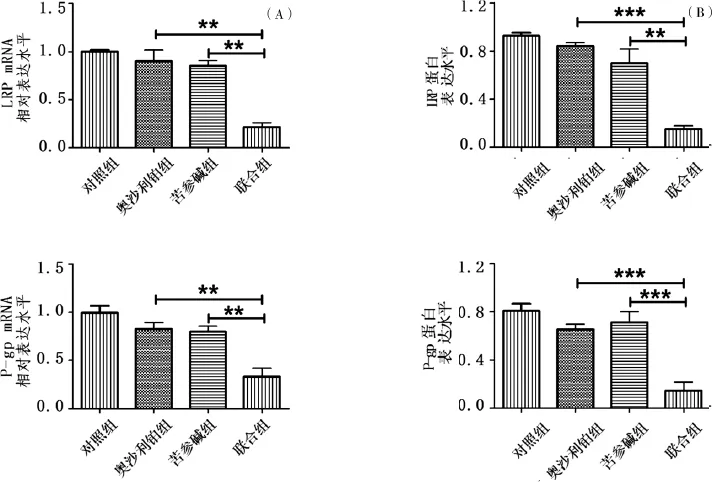
图1 不同药物作用48 h后对HT-29/OXA中LRP和P-gp mRNA以及蛋白表达的影响柱形图

图2 不同药物作用48 h后对HT-29/OXA中LRP和P-gp mRNA以及蛋白表达的影响电泳图
4 讨论
中药苦参为豆科多年生落落叶灌木植物苦参(Sophora flavescens Ait.)的干燥根。苦参性苦、寒,具清热燥湿、杀虫、利尿等功效,用于热痢、便血、黃疸尿闭、赤白带下、湿疹等。苦参碱是苦参中的抗癌有效成分,对肝癌、胃癌、肺癌、乳腺癌和直肠癌等细胞均具有生长抑制作用[5-9]。
奥沙利铂能够通过作用于DNA形成链内和链间交联来抑制DNA的合成,产生抗肿瘤活性以及细胞毒作用[10]。由于因个体基因遗传差异,结肠癌患者对于奥沙利铂化疗敏感性存在较大的差异,其中产生奥沙利铂的耐药性是导致患者化疗失败的主要原因。肿瘤细胞多药耐药(multi drug resistance,MDR)机制复杂,如MDR基因过多表达、DNA拓扑异构酶Ⅱ活性降低或含量减少、谷胱甘肽解毒酶系统活性增高、MDR相关蛋白基因表达增高等[11]。其中P-gp和LRP介导的MDR研究较多,是机制最为明确的MDR产生途径。P-gp和LRP在细胞的表达水平与细胞耐药程度呈正相关[12-14]。
最近已经有多项研究表明苦参碱能够抑制结肠癌细胞的生长。Huang等研究发现2.0 mg/mL苦参碱能够抑制结肠癌细胞HT-29的生长并且能够抑制COX-2的表达[15];Zhou等人也观察了苦参碱能够抑制结肠癌细胞SW116的增殖,并且抑制细胞端粒酶的活性[16];Chang等人进一步深入研究发现苦参碱通过上调Bax的表达以及下调Bcl-2的表达来诱导HT-29细胞的调亡,从而起到抑制结肠癌细胞HT-29增殖的作用[17]。最新的研究也发现苦参碱通过抑制Akt信号从而抑制结肠癌细胞的增殖[9]。本研究结果显示低浓度的苦参碱能增强奥沙利铂对HT-29/ OXA细胞增殖的抑制作用,当奥沙利铂与低毒剂量苦参碱(3.0μg/mL)共同作用HT-29/OXA细胞时,奥沙利铂的IC50值明显降低,提示奥沙利铂联合苦参碱对HT-29/OXA具有较好的化疗增敏作用。同时流式细胞仪检测结果显示,奥沙利铂联合低毒剂苦参碱组的细胞凋亡率和单药组相比显著增加。
P-gp是由1280个氨基酸构成的跨膜蛋白,通过激活ATP泵阻碍药物向细胞内被动扩散,将细胞内诸如阿霉素、长春新碱等细胞毒药物向膜外主动转运,降低细胞内的药物浓度,从而产生多药耐药作用[18]。LRP仅表达于大肠癌的细胞质中,主要通过核靶点屏蔽机制引起多药耐药,即阻止以细胞核为靶点的药物通过核孔进入细胞核,进入胞核的药物也能够通过转运载体运出胞核,降低药物的核质分布比例,也可使进入胞质的药物通过胞吐作用排出细胞[19]。本研究中实时定量PCR检测结果显示奥沙利铂联合苦参碱干预HT-29/OXA细胞后能有效降低细胞LRP mRNA和P-gp mRNA的表达;蛋白印迹实验结果显示HT-29/OXA细胞经奥沙利铂联合苦参碱干预后,其LRP和P-gp蛋白的表达均明显降低,提示苦参碱的作用机制与降低细胞内LRP和P-gp表达降低,进而逆转抗肿瘤药物外排、增加细胞内药物蓄积有关。至于奥沙利铂耐药的结肠癌细胞对苦参碱的作用机制是否与其他凋亡信号通路相关蛋白有关,有待进一步的探索和研究。相信通过进一步的研究,苦参碱作为有效的临床抗肿瘤辅助药物,其逆转结肠癌细胞的多药耐药将得到更深层次分子机制的支持。
[1]DeSantis CE,Lin CC,Mariotto AB,et al.Cancer treatment and survivorship statistics[J].CA Cancer JClin,2014,64(4):252-271.
[2]Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer J Clin,2012,62(1):10-29.
[3]Metzger-Filho O,Moulin C,Awada A.Molecular targeted therapy in prevalent tumors:learning from the past and future perspectives[J].Curr Clin Pharmacol,2010,5(3):166-177.
[4]Temraz S,Mukherji D,Alameddine R,et al.Methods of overcoming treatment resistance in colorectal cancer[J].Crit Rev Oncol Hematol,2014,89(2):217-230.
[5]Guo B,Zhang T,Su J,et al.Oxymatrine targets EGFR(p-Tyr845)and inhibits EGFR-related signaling pathways to suppress the proliferation and invasion of gastric cancer cells[J]. Cancer Chemother Pharmacol,2015,75(2):353-363.
[6]Li H,Li X,Bai M,et al.Matrine inhibited proliferation and increased apoptosis in human breast cancer MCF-7 cells via upregulation of Bax and downregulation of Bcl-2[J].Int J Clin Exp Pathol,2015,8(11):14793-14799.
[7]Lin Y,Lin L,Jin Y,et al.Combination of Matrine and Sorafenib Decreases the Aggressive Phenotypes of Hepatocellular Carcinoma Cells[J].Chemotherapy,2014,60(2):112-118.
[8]Rong B,Zhao C,Gao W,et al.Matrine promotes the efficacy and safety of platinum-based doublet chemotherapy for advanced non-small cell lung cancer[J].Int J Clin Exp Med, 2015,8(9):14701-14717.
[9]Zhang S,Cheng B,Li H,et al.Matrine inhibits proliferation and induces apoptosis of human colon cancer LoVo cells by inactivating Akt pathway[J].Mol Biol Rep,2014,41(4):2101-2108.
[10]Peixoto RD,Kumar A,Lim HJ.Palliative oxaliplatin-based chemotherapy after exposure to oxaliplatin in the adjuvant setting for colon cancer[J].JGastrointest Oncol,2015,6(5):487-491.
[11]Rahman M,Hasan MR.Cancer Metabolism and Drug Resistance[J].Metabolites,2015,5(4):571-600.
[12]Higgins CF.The multidrug resistance P-glycoprotein[J].Curr Opin Cell Biol,1993,5(4):684-687.
[13]Izquierdo MA,Scheffer GL,Flens MJ,et al.Broad distribution of the multidrug resistance-related vault lung resistance protein in normal human tissues and tumors[J].Am J Pathol,1996, 148(3):877-887.
[14]Laurencot CM,Scheffer GL,Scheper RJ,et al.Increased LRPmRNA expression is associated with the MDR phenotype in intrinsically resistant human cancer cell lines[J].Int JCancer,1997,72 (6):1021-1026.
[15]Huang J,Zhang MJ,Qiu FM.Study on inhibitory effect of matrine on cyclooxygenase-2 expression in colon cancer HT-29 cell line[J].Zhongguo Zhong Xi Yi Jie He Za Zhi, 2005,25(3):240-243.
[16]周喜汉.韦星,黄赞松,等.苦参碱对结肠癌SW1116细胞增殖及端粒酶活性的影响[J].中药材,2009,32(6):923-925.
[17]Chang C,Liu SP,Fang CH,et al.Effects of matrine on the proliferation of HT29 human colon cancer cells and its antitumor mechanism[J].Oncol Lett,2013,6(3):699-704.
[18]Borst P,Schinkel AH,Smit JJ,et al.Classical and novel forms of multidrug resistance and the physiological functions of P-glycoproteins in mammals[J].Pharmacol Ther,1993,60(2): 289-299.
[19]Scheffer GL,Schroeijers AB,Izquierdo MA,et al.Lung resistance-related protein/major vault protein and vaults in multidrugresistant cancer[J].Curr Opin Oncol,2000,12(6):550-556.
(本文编辑 杨瑛)
The Reversal Effects of Matrine on the Multi-drug Resistance of Oxaliplatin in Human Colon HT-29 Cells and its Mechanism Research
ZHANG Dongmei,ZHANG Yaming*
(Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 200000,China)
Objective To study of matrine on the reversal of multi-drug resistance in HT-29/OXA cells and explore its underlying mechanisms.Methods Oxaliplatin resistant HT-29/OXA cells were established by gradually increasing the concentration of medicines.The reverse efficacy of Matrine on HT-29/OXA cells was determined by CCK-8 assay.The apoptosis and cell cycle were detected by flow cytometry.The expression levels of lung resistance protein(LRP)and P-glycoprotein(P-gp)mRNA and proteins was determined by quantitative real time PCR(qRT-PCR)and Western blot, respectively.Results Matrine can increase the sensibility of HT-29/OXA to oxaliplatin and reverse the part resisitance.Matrine(0.5μg/mL)and matrine(3.0μg/mL)alone had no effect on the cell cycle and apoptosis in HT-29/OXA cells.The oxaliplatinin combination with matrine significantly inhibited cell proliferation and induced apoptosis.Oxaliplatin(0.5μg/mL) and matrine(3.0μg/mL)alone had no effect on the expression level of LRP and P-gp mRNA and protein in HT-29/OXA cells.The expression of LRP and P-gp mRNA and protein was lower with drug combination.Conclusion Matrine could partially reverse the multi-drug resistance of HT-29/OXA cells to oxaliplatin,which may be related to the lower expression levels of LRP and P-gp.
colon cancer;HT-29;oxaliplatin;multi-drug resistance;matrine
R285.5;R735.3+5
A
10.3969/j.issn.1674-070X.2016.11.006
2016-03-26
上海市进一步加快中医药事业发展三年行动计划资助(2014-2016年,编号ZY3-CCCX-1-1008)。
张冬梅,女,副主任医师,硕士研究生。研究方向:中西医结合肛肠疾病防治。
*张雅明,女,硕士,主任医师,硕士研究生导师,E-mail:ym_zhang56@sina.com。

