血清miR-146a、miR-663的表达变化与不稳定型心绞痛的相关性
尚丹 刘晓鹏 丁红玉 黄晶 孙绍光
1.北京铁路局石家庄卫生防疫站,河北石家庄050000;2.河北省儿童医院检验科,河北石家庄050000;3.河北医科大学基础医学院生物化学与分子生物学教研室,河北石家庄050017
血清miR-146a、miR-663的表达变化与不稳定型心绞痛的相关性
尚丹1刘晓鹏1丁红玉1黄晶2孙绍光3
1.北京铁路局石家庄卫生防疫站,河北石家庄050000;2.河北省儿童医院检验科,河北石家庄050000;3.河北医科大学基础医学院生物化学与分子生物学教研室,河北石家庄050017
目的检测不稳定型心绞痛患者与健康人血清中miR-146a和miR-663表达水平差异,探讨miR-146a和miR-663与不稳定型心绞痛的相关性。方法随机选择2014年8~12月河北医科大学第二医院不稳定型心绞痛15例作为观察组,选取2014年3~5月北京铁路局石家庄卫生防疫站体检中心的健康体检者15名作为对照组。通过实时定量PCR方法检测两组血清miR-146a和miR-663的表达水平。结果观察组患者血清中miR-146a浓度较对照组升高,差异有统计学意义(P<0.05);观察组患者血清miR-663浓度较对照组降低,差异有统计学意义(P<0.05)。结论血清miR-146a、miR-663表达水平的变化对不稳定型心绞痛的辅助诊断具有潜在的指导意义。
不稳定型心绞痛曰microRNA曰miR-146a曰miR-663
不稳定型心绞痛(Unstable angina,UA)是急性冠脉综合征(acute coronary syndrome,ACS)的常见类型之一,其病理基础为冠状动脉严重狭窄导致的冠状动脉血流减少和心肌供血不足。目前治疗手段有限,治疗效果也不理想,因此有效的早期诊断、干预对于改善患者的远期预后具有重要的意义。
microRNA(miRNA)是一类内源的、长约22nt的非编码RNA。miRNA通过不完全碱基配对的方式与靶mRNA的3'UTR结合,降解mRNA或抑制靶基因的翻译[1]。研究表明[2-10],miRNA在心血管疾病的发生发展过程中发挥了重要调控作用。miRNA在进化上高度保守,具有组织、细胞或病理特异性。由于囊泡和蛋白的保护,血清、尿液、唾液等体液中的miRNA非常稳定,是一类理想的新型疾病诊断生物标志物[11-12]。
血管平滑肌细胞表型发生转化并获得增殖能力,是动脉硬化、高血压等血管重塑性疾病的重要病理学事件。Ji等[13]和本课题组[14]的研究均表明,miR-146a在增殖型血管平滑肌细胞中表达升高,能够促进血管平滑肌细胞增殖,在血管重塑中起到重要调控作用。Li等[15-16]研究发现,miR-663在增殖型血管平滑肌细胞的表达水平比分化血管平滑肌细胞显著降低,能够抑制血管平滑肌细胞增殖和新生内膜的形成。基于以上依据,本研究组提出,血管重塑疾病患者血清miR-146a、miR-663能否作为生物标志物用于临床诊断?在本次研究中使用实时定量PCR技术,检测了不稳定型心绞痛患者和健康人血清中miR-146a、miR-663表达水平,以期为miR-146a、miR-663作为生物标志物用于辅助诊断不稳定型心绞痛提供了实验依据。
1 资料与方法
1.1一般资料
选择2014年8~12月河北医科大学第二医院不稳定型心绞痛15例作为观察组,其中男10例,女5例,年龄35~73岁,平均(51.34±8.75)岁。选取2014年3~5月北京铁路局石家庄卫生防疫站体检中心的健康体检者15名作为对照组,其中男8例,女7例,年龄32~68岁,平均(44.76±9.52)岁。纳入标准:无血缘关系,无急慢性感染、血液系统疾病、肝肾疾病、恶性肿瘤、高血压等。两组年龄、性别、血压、体重指数(BMI)、总胆固醇(TC)、三酰甘油(TG)、HDL-C(高密度脂蛋白胆固醇)、LDL-C(低密度脂蛋白胆固醇)、白细胞比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
表1 两组一般资料比较情况(依s)
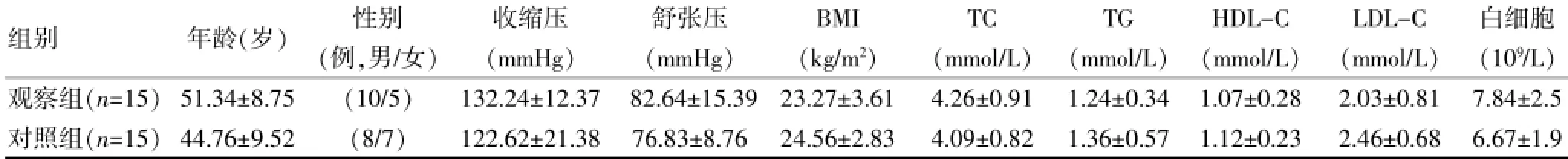
表1 两组一般资料比较情况(依s)
注:BMI:体重指数;TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇
组别年龄(岁)性别收缩压舒张压BMITCTGHDL-CLDL-C白细胞(例,男/女)(mmHg)(mmHg)(kg/m2)(mmol/L)(mmol/L)(mmol/L)(mmol/L)(109/L)观察组(n=15)51.34±8.75(10/5)132.24±12.3782.64±15.3923.27±3.614.26±0.911.24±0.341.07±0.282.03±0.817.84±2.5对照组(n=15)44.76±9.52(8/7)122.62±21.3876.83±8.7624.56±2.834.09±0.821.36±0.571.12±0.232.46±0.686.67±1.9
1.2主要仪器与试剂
实时定量PCR仪型号为ABI7300。miRcute血清/血浆miRNA提取试剂盒(货号:DP503)、miRcute miRNA第一链cDNA合成试剂盒、miRcute Plus miRNA定量PCR检测试剂盒(SYBR Green)(货号:FP411)、miRNA外参(货号:CR100-01)、miR-146a正向引物(货号:CD201-0013)、miR-191正向引物(货号:CD201-0019)和miRNA外参正向引物(货号:CD200-01)均购自天根生化科技(北京)有限公司,miR-663正向引物购自广州复能基因有限公司。
1.3血清中miRNA的提取
每200 μL血清加入900 μL裂解液,振荡器振荡混匀30 s至完全匀浆,加入4 μL 2.5 nmol/L的检测外参,颠倒混匀。室温静置5 min,使得核酸蛋白复合物完全分离。加入200 μL氯仿,剧烈振荡15 s,室温静置5 min。12 000 r/min,4℃,离心15 min,把水相转移到新管中。缓慢加入转移液2倍体积的无水乙醇,混匀。转入吸附柱,室温放置2 min,室温12 000 r/min离心30 s,离心后弃掉流出液,保留吸附柱。加入700 μL去蛋白液,室温静置2 min,室温12 000 r/min离心30 s,弃废液。加入500 μL漂洗液,室温静置2 min,室温12 000 r/min离心30 s,弃废液。重复漂洗1次。室温12 000 r/min离心2 min,弃收集管。将吸附柱转入一个新的无核酸酶的离心管中,向吸附膜中心位置加20 μL无核酸酶H2O,室温放置2 min,室温12 000 r/min离心2 min。
1.4miRNA的RT-qPCR检测
逆转录反应体系:RNA 5 μL(1.5 μg),2×miRNA逆转录反应缓冲液10 μL,miRNA逆转录酶混合液2 μL,无核酸酶水补足20 μL。轻轻混匀表中配制的反应液,42℃,反应60 min进行miRNA加A尾反应和逆转录反应,最后95℃灭活3 min。实时定量PCR反应体系:2×miRcutePlusmiRNA Premix(withSYBR&ROX) 10 μL,正反向特异引物(10 μmol/L)各0.4 μL,miRNA第一链cDNA 1.2 μL,50×ROX Reference Dye 2 μL,无核酸酶水补足20 μL。程序如下:95℃预变性15 min;95℃变性20 s,60℃退火延伸34 s,重复40个循环,然后进行溶解曲线分析。采用相对定量方法(2-ΔΔCt)对实时定量PCR的结果进行分析。
1.5统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差(依s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1不稳定型心绞痛患者血清miR-146a的表达水平
实时定量PCR检测结果显示,经过与内参miR-191相比较,观察组患者血清miR-146a的表达水平较对照组升高了(1.82±0.23)倍,差异有统计学意义(P<0.05),见图1A。与外参相比较,观察组患者血清miR-146a的表达水平较对照组升高了(1.64±0.17)倍,差异有统计学意义(P<0.05),见图1B。
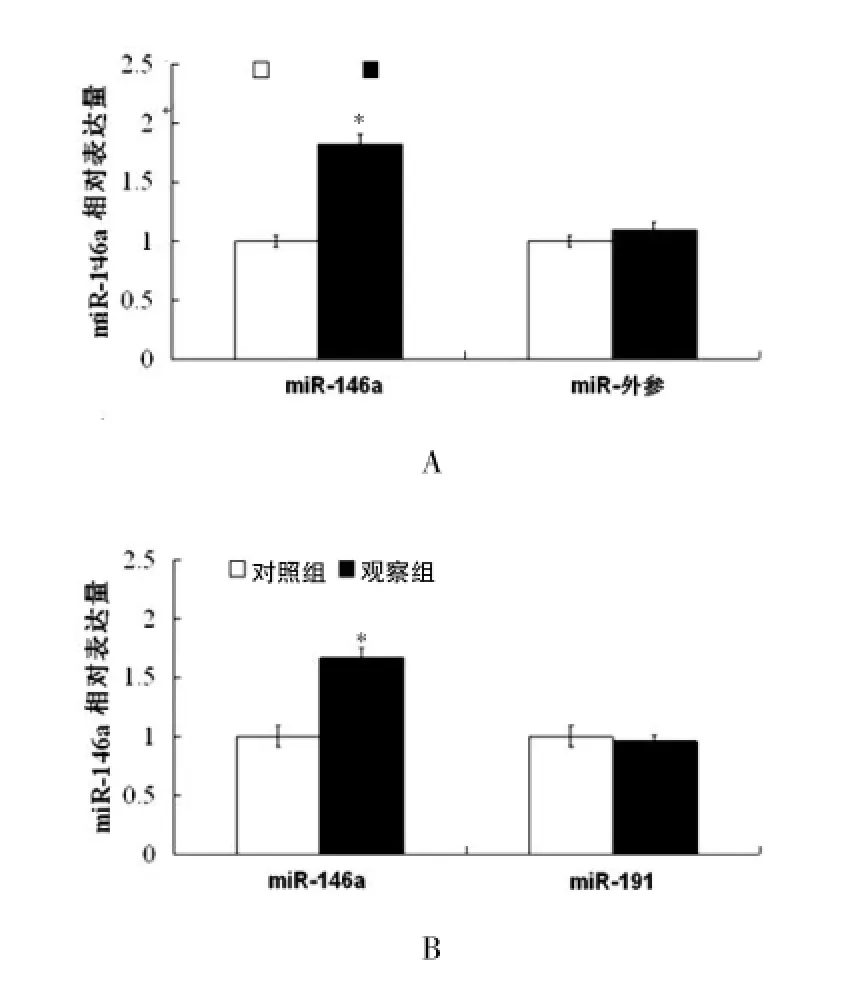
图1 miR-146a在不稳定型心绞痛患者和健康人群血清中的表达水平
2.2不稳定型心绞痛患者血清miR-663的表达水平
实时定量PCR检测结果显示,与内参miR-191比较,观察组患者血清miR-663的表达水平是对照组的(0.41±0.04)倍,差异有统计学意义(P<0.05),见图2A;与外参相比较,观察组患者血清miR-146a的表达水平是对照组的(0.49±0.03)倍,差异有统计学意义(P<0.05),见图2B。

图2 miR-663在不稳定型心绞痛患者和健康人群血清中的表达水平
3 讨论
理想的生物标志物应该具备以下标准:可以通过无创方法获取、高度特异性和敏感性、较长半衰期、能够被快速而准确的检测等。体液miRNA完全满足以上标准。miRNA不同于其他RNA,能够耐受RNA酶的水解,在体液中非常稳定,而且可以采用实时定量PCR、基因芯片、测序等高灵敏度、高通量的分子生物学技术进行检测,目前已成为深受关注的一类临床生物标志物。近几年将miRNA作为疾病的生物标志物的研究越来越多,已成为生物标志物的研究热点。血清miRNAs的变化与多种人类疾病如癌症[17-18]、阿尔兹海默[19-20]等相关,其表达水平异常具有协助疾病诊断的潜在价值。在心血管疾病领域也有很多报道[21-25], Widera等[24]对444例ACS患者血浆中的心肌细胞富含的miR-1、miR-133a、miR-133b、miR-208a、miR-208b和miR-499浓度进行了检测,并分析它们与ACS病情发展及预后的相关性。Fichtlscherer等[25]首次探讨了稳定型心血管疾病患者血浆中几十种miRNA水平,发现内皮细胞中表达丰富的miR-126、miR-92a、miR-17在心血管疾病患者血浆的水平下降,炎症相关miRNA-155和血管平滑肌细胞富含的miRNA-145也在稳定型心血管疾病患者血浆中下调。但结果中只有miRNA-145的变化与预期相符,其他与预期结果相反,表明筛选特异有效的miRNA用于心血管疾病预测和诊断,仍需要进一步的深入研究。
本研究发现,不稳定型心绞痛患者血清miR-146a的表达水平比健康者升高,而miR-663的表达水平比健康者下降。这一结果与之前报道的增生血管中miR-146a[13-14]表达水平升高及miR-633[15-16]的表达水平降低相吻合。这为miR-146a、miR-663作为生物标志物用于辅助诊断不稳定型心绞痛提供了实验依据。本研究联合使用了内参法和外参法分别进行miRNA表达量分析,所得结果一致,反映出了所用检测方法的可靠性。miR-191是一种在血清中稳定表达的miRNA,被作为内参用于阿尔兹海默等患者血清中的miRNA表达谱分析[19]。已有研究表明[13],与正常动脉血管比较,内膜增生动脉血管中的miR-191表达水平没有改变,推测其未参与血管重塑性疾病的发生发展,因此本实验选取miR-191作为内参。但是考虑到样本量较少,miR-146a、miR-663作为生物标志物用于不稳定型心绞痛临床诊断的价值尚需进一步探讨。
目前,未见血清miR-633与其他疾病的相关性报道。已有研究报道了血清miR-146a与多种疾病的相关性,例如,血清miR-146a在乳腺癌[26]、非小细胞肺癌[27]等患者中表达水平升高,在败血症[28]、系统性红斑狼疮[29]等患者中表达水平下降。因此单独使用血清miR-146a用来诊某一疾病缺少特异性,最好是采用多种miRNA联合分析,或者结合其他血液指标进行联合分析。
本研究使用的miRNA提取试剂盒是专门针对血清、血浆样本miRNA提取而开发的。其中的裂解液具有较高的裂解能力和提取灵敏度,吸附柱采用特殊的硅基质膜填料,大大增强了对小RNA分子的吸附能力,提取得到的miRNA纯度更好、质量更高,效果明显优于传统的Trizol提取法。本实验使用的miRNA第一链cDNA合成试剂盒采用了双组分形式,简化了实验操作流程,降低了操作失误的可能性。其中的Poly(A)聚合酶不但具有高效的加A尾效率,还能够特异性地识别单链miRNA,从而避免了具有双链结构的miRNA前体的逆转录反应;另外,所使用的逆转录酶经过分子改造,去掉了RNase H活性,增加了RNA模板亲和力,从而保证了miRNA的逆转录反应具有更高的效率和灵敏度,同时能保证miRNA末端的Poly(A)修饰过程和逆转录过程同时高效进行。
综上所述,本研究分析了不稳定型心绞痛患者血清miR-146a、miR-663表达水平变化,为血清miR-146a、miR-663作为生物标志物用于辅助诊断不稳定型心绞痛提供了实验依据。
[1]ChuaJH,ArmugamA,JeyaseelanK.MicroRNAs:biogenesis, function and applications[J].Curr Opin Mol Ther,2009,11(2):189-99.
[2]Cordes KR,Sheehy NT,White MP,et al.miR-145 and miR-143 regulate smooth muscle cell fate and plasticity[J]. Nature,2009,460(7256):705-710.
[3]Sarkar J,Gou D,Turaka P,et al.MicroRNA-21 plays a role in hypoxia-mediated pulmonary artery smooth muscle cell proliferation and migration[J].Am J Physiol Lung Cell Mol Physiol,2010,299(6):861-871.
[4]Wang M,Li W,Chang GQ,et al.MicroRNA-21 regulates vascular smooth muscle cell function via targeting tropomyosin1inarteriosclerosisobliteransoflowerextremities[J]. Arterioscler Thromb Vasc Biol,2011,31(9):2044-2053.
[5]Chen J,Yin H,Jiang Y,et al.Induction of microRNA-1 by myocardin in smooth muscle cells inhibits cell proliferation[J].Arterioscler Thromb Vasc Biol,2011,31(2): 368-375.
[6]Torella D,Iaconetti C,Catalucci D,et al.MicroRNA-133 controls vascular smooth muscle cell phenotypic switch in vitro and vascular remodeling in vivo[J].Circ Res,2011, 109(8):880-893.
[7]Choe N,Kwon JS,Kim JR,et al.The microRNA miR-132 targets Lrrfip1 to block vascular smooth muscle cell proliferation and neointimal hyperplasia[J].Atherosclerosis, 2013,229(2):348-355.
[8]Merlet E,Atassi F,Motiani RK,et al.miR-424/322 regulates vascular smooth muscle cell phenotype and neointimal formation in the rat[J].Cardiovasc Res,2013,98(3):458-468.
[9]Liao XB,Zhang ZY,Yuan K,et al.MiR-133a modulates osteogenicdifferentiation of vascular smooth muscle cells[J]. Endocrinology,2013,154(9):3344-3352.
[10]Remus EW,Lyle AN,Weiss D,et al.miR181a protects against angiotensinⅡ-induced osteopontin expression in vascular smooth muscle cells[J].Atherosclerosis,2013, 228(1):168-174.
[11]Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
[12]Liang H,Gong F,Zhang S,et al.The origin,function,and diagnostic potential of extracellular microRNAs in human body fluids[J].Wiley Interdiscip Rev RNA,2014,5(2): 285-300.
[13]Ji R,Cheng Y,Yue J,et al.MicroRNA expression signature and antisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation[J].Circ Res,2007,100(11):1579-1588.
[14]Sun SG,Zheng B,Han M,et al.miR-146a and Krüppellike factor 4 form a feedback loop to participate in vascular smooth muscle cell proliferation[J].EMBO Rep,2011,12(1):56-62.
[15]Li P,Liu Y,Yi B,et al.MicroRNA-638 is highly expressed in human vascular smooth muscle cells and inhibits PDGFBB-induced cell proliferation and migration through targeting orphan nuclear receptor NOR1[J].Cardiovasc Res,2013,99(1):185-193.
[16]Li P,Zhu N,Yi B,et al.MicroRNA-663 regulates human vascularsmoothmusclecellphenotypicswitch andvascular neointimal formation[J].Circ Res,2013,113(10):1117-1127.
[17]Mitchell PS,Parkin RK,Kroh EM,et al.Circulating micro RNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci USA,2008,105(30): 10 513-10 518.
[18]Cuk K,Zucknick M,Heil J,et al.Circulating microRNAs in plasma as early detection markers for breast cancer[J]. Int J Cancer,2013,132(7):1602-1612.
[19]Geekiyanage H,Jicha GA,Nelson PT,et al.Blood serum miRNA:non-invasivebiomarkersforAlzheimer'sdisease[J]. Exp neurol,2012,235(2):491-496.
[20]Kiko T,Nakagawa K,Tsuduki T,et al.Circulating miRNAs as potential biomarkers in Alzheimer's disease[J].J Alzheimers Dis,2014,42(4):1261-1267.
[21]Wang GK,Zhu JQ,Zhang JT,et al.Circulating microRNA: a novel potential biomarker for early diagnosis of acute myocardial infarction in humans[J].Eur Heart J,2010,31(6):659-666.
[22]Tijsen AJ,Creemers EE,Moerland PD,et al.MiR423-5p as a circulating biomarker for heart failure[J].Circ Res, 2010,106(6):1035-1039.
[23]HowlettP,WaheedA,HortonA,etal.9MicrornasRepresent NovelBiologicalMarkersofCoronaryArteryCalcification[J]. Heart,2015,101(Suppl 4):A6.
[24]Widera C,Gupta SK,Lorenzen JM,et al.Diagnostic and prognostic impact of six circulating microRNAs in acute coronary syndrome[J].J Mol Cell Cardiol,2011,51(5): 872-875.
[25]Fichtlscherer S,De Rosa S,Fox H,et al.Circulating micro RNAs in patients with coronary artery disease[J].Circ Res, 2010,107(5):677-684.
[26]Wang RJ,Zheng YH,Wang P,et al.Serum miR-125a-5p, miR-145 and miR-146a as diagnostic biomarkers in nonsmall cell lung cancer[J].Int J Clin Exp Patho,2015,8(1):765-771.
[27]Kumar S,Keerthana R,Pazhanimuthu A,et al.Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients[J].Indian J Biochem Biophys,2013,50(3):210-214.
[28]Wang J,Yu M,Yu G,et al.Serum miR-146a and miR-223 as potential new biomarkers for sepsis[J].Biochem Bioph Res Co,2010,394(1):184-188.
[29]Wang G,Tam LS,Li EKM,et al.Serum and urinary cellfree MiR-146a and MiR-155 in patients with systemic lupus erythematosus[J].J Rheumatol,2010,37(12):2516-2522.
Correlations between expression levels of serum miR-146a,miR-663 and unstable angina
SHANG Dan1LIU Xiaopeng1DING Hongyu1HUANG Jing2SUN Shaoguang3
1.Shijiazhuang Health and Epidemic Prevention Station,Beijing Railway Bureau,Hebei Province,Shijiazhuang 050000,China;2.Clinical Laboratory,Children's Hospital of Hebei Province,Hebei Province,Shijiazhuang050000, China;3.Department of Biochemistry and Molecular Biology,Basic Medical College,Hebei Medical University,Hebei Province,Shijiazhuang050017,China
Objective To detect the expression levels of serum miR-146a and miR-663 in unstable angina patients and healthy controls,explore the correlations between the expression levels of serum miR-146a,miR-663 and unstable angina.Methods 15 patients with unstable angina from the Second Hospital of Hebei Medical University from August to December 2014 were randomly selected as the observation group,while 15 heath from Shijiazhuang Health and Epidemic Prevention Station of Beijing Railway from March to May 2014 were randomly selected as the control group.The expression levels of serum miR-146a and miR-663 in two groups were analyzed by quantitative real-time PCR.Re鄄sults Expression level of serum miR-146a in the observation group were increased,as compared with those in the control group,the difference was statistically significant(P<0.05);compared with those in the control group,the expression level of serum miR-663 in the observation group were decreased,the difference was statistically significant(P<0.05).Conclusion The changes of serum expression levels of miR-146a or miR-663 have potential significance for the diagnosis of unstable angina.
Unstable angina;miRNA;miR-146a;miR-663
R541.4
A
1673-7210(2016)06(b)-0045-05
河北省医学科学研究重点课题计划项目(11201 40198);国家自然科学基金资助项目(81200215);河北省自然科学基金资助项目(H2013206151)。
尚丹(1980.5-),女,硕士,主管技师;研究方向:分子诊断。孙绍光(1978.4-),男,博士,副教授;研究方向:调控性非编码RNA。
(2016-03-09本文编辑:任念)

