腹腔镜与开腹手术治疗胃间质瘤的对比研究
潘金铎 刘兴国吴文峰 陈镜沛 梁盛佳 廖毅平 陈国健
(暨南大学第六附属医院 广东省江门市五邑中医院普通外科,江门 529000)
·临床研究·
腹腔镜与开腹手术治疗胃间质瘤的对比研究
潘金铎 刘兴国*吴文峰 陈镜沛 梁盛佳 廖毅平 陈国健
(暨南大学第六附属医院 广东省江门市五邑中医院普通外科,江门 529000)
目的 比较腹腔镜与开腹手术治疗胃间质瘤(gastric stromal tumor,GST)的临床疗效。 方法 回顾性分析2007年4月~2014年10月胃间质瘤切除术69例临床资料,其中腹腔镜组38例,开腹组31例,对比2组手术时间、术中出血量、术后进食时间、术后排气时间和术后住院时间、术后并发症。 结果 腹腔镜组手术时间(77.1±15.7)min,与开腹组(82.4±15.7)min差异无统计学意义(t=-1.390,P=0.169);腹腔镜组术中出血量(71.1±23.3)ml,显著少于开腹组(98.1±38.3)ml(t=-3.604,P=0.001);腹腔镜组术后排气时间(40.7±6.8)h,明显短于开腹组(46.6±9.0)h(t=-3.090,P=0.003);腹腔镜组术后进流食时间(53.7±8.8)h,明显早于开腹组(59.2±9.7)h(t=-2.485,P=0.015);腹腔镜组术后肺部感染1例、胃漏1例,开腹组切口感染1例、胃漏1例,2组术后并发症发生率无统计学差异(χ2=0.000,P=1.000)。腹腔镜组术后住院时间(7.9±1.5)d,明显短于开腹组(9.2±1.7)d(t=-3.286,P=0.002)。69例术后随访8~86个月,2例肿瘤复发,腹腔镜组及开腹组各1例。 结论 腹腔镜胃间质瘤切除术是一种安全可行的微创术式,与开腹手术比较具有术中出血少、术后恢复快的优点。
胃间质瘤; 腹腔镜; 手术
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是一种胃肠道间叶源性肿瘤,主要好发部位为胃。胃肠道间质瘤对放、化疗不敏感,又因肿瘤无淋巴结转移特性,手术切除被认为是本病最合理有效的治疗手段[1]。自1992年Siani等[2]首次开展腹腔镜胃间质瘤(gastric stromal tumor,GST)手术以来,腹腔镜技术在GST的治疗领域得到广泛应用。本文回顾性分析我院2007年4月~2014年10月胃间质瘤切除69例的临床资料,其中腹腔镜组38例,开腹组31例,探讨腹腔镜技术在GST治疗中的应用价值。
1 临床资料与方法
1.1 一般资料
选取2007年4月~2014年10月术后病理诊断为胃间质瘤行手术切除的病例,排除存在种植转移或淋巴结转移病例。手术方式主要为术者选择,前期多选择开腹手术,随着腹腔镜技术的提高,后期以腹腔镜手术为主。
腹腔镜组38例,年龄38~73岁,无症状腹部包块10例,上腹不适14例,黑便6例,8例无临床表现,为B超或CT体检发现,均行胃镜检查提示胃黏膜隆起性病变,行超声内镜提示肿瘤直径3~15 cm。开腹组31例,年龄40~75岁,无症状腹部包块11例,上腹不适8例,黑便8例,4例无临床表现,均行胃镜及超声内镜检测,肿瘤直径4~13 cm。所有病例均行CT定位。2组一般资料比较无统计学差异(P>0.05),有可比性,见表1。

表1 2组一般资料比较
1.2 手术方法
1.2.1 腹腔镜组 气管插管全身麻醉,患者取平卧“大”字位。于脐下切开皮肤约10 mm,Veress针穿刺建立CO2气腹,压力12~14 mm Hg(1 mm Hg=0.133 kPa)。根据肿瘤大小及位置,另取2~3孔作为操作孔。肿瘤位于胃窦-幽门部时,一般于左侧腹壁做两孔作为术者操作孔;肿瘤位于胃体部时,一般于右锁骨中线肋缘下、左腋前线肋缘下两处作为术者操作孔;肿瘤位于胃底-贲门部时,需增加剑突下一5 mm切口作为助手操作孔。对于胃窦、胃体前壁肿瘤及后壁近大弯侧肿瘤,行胃楔形切除术,直接用Endo-GIA(腔内直线切割缝合器)闭合切除;对于胃后壁近小弯侧肿瘤,需先切断胃结肠韧带、胃脾韧带,把胃后壁向后下翻转,再行胃楔形切除术;对于胃底近贲门部肿瘤,先将胃底贲门大小弯侧充分游离,再行胃楔形切除术。对于胃窦近幽门部肿瘤,估计狭窄者,行远端胃大部切除术。对于肿瘤小、定位困难者,术中联合胃镜,准确定位后手术切除。切缘离肿瘤>2 cm。切除的肿瘤装入无菌标本袋中由扩大的观察孔处切碎后取出。术中均冰冻病理检查,保证切缘阴性。
1.2.2 开腹组 开腹手术中应严格遵循“非接触,少挤压”原则,行胃楔形切除术切缘要求离肿瘤>2 cm,对于近贲门及幽门肿瘤,切除后有狭窄者,需行近端胃或远端胃大部切除术,对怀疑切缘不够者,常规行术中冰冻病理检查。
1.3 观察指标
包括手术时间、术中出血量、术后进食时间、术后排气时间和术后住院时间、术后并发症、随访情况、病理学结果等。肿瘤最大直径以病理学结果为准,术中出血量、手术时间以麻醉记录单为准。
1.4 统计学方法
采用SPSS17.0统计软件进行分析,计量资料比较采用独立样本t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2组手术均顺利完成。腹腔镜组无中转开腹,5例术中联合胃镜定位。与开腹组相比,腹腔镜组术中出血少,术后排气和进流食早,术后住院时间短,2组手术时间和术后并发症发生率差异无显著性,见表2。腹腔镜组术后肺部感染1例,治愈出院,胃漏1例,经保守治疗治愈出院。开腹组术后切口感染1例,行二期缝合,胃漏1例,胃镜下行瘘口夹闭术,均治愈出院。2组术后病理切缘均为阴性,按Fletcher分级标准,2组肿瘤恶性潜能分级差异无显著性,见表3。
69例电话随访,截止至2015年1月,随访时间8~86个月,平均46个月,2例肿瘤复发(2组各1例)。腹腔镜组复发病例肿瘤初次位于近贲门处,直径8 cm,行腹腔镜联合胃镜胃楔形切除术,术后病理诊断恶性潜能为高度,术后22个月再次出现黑便,行胃镜及CT确诊复发,复发部位为胃体,开腹行肿瘤楔形切除,并口服伊马替尼1年(400 mg/d),随访2年无复发及转移;开腹组复发病例肿瘤初次位于胃体大弯侧,直径6 cm,高度恶性潜能,行开腹胃部分切除术,术后28个月B超检查怀疑复发,行胃镜确诊,复发部位为胃体近幽门处,再次开腹行远端胃切除术,术后病理诊断恶性潜能亦为高度,随访3年半无复发。

表2 2组观察指标比较
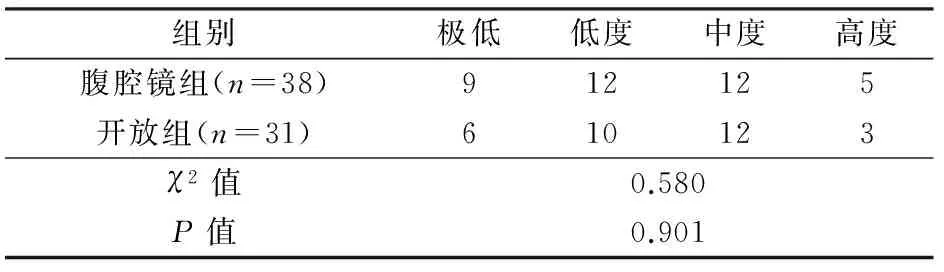
表3 2组肿瘤恶性潜能Fletcher分级
3 讨论
GST临床表现无特异性,主要为上腹部不适、黑便甚至呕血等,主要诊断方法为内镜检查及超声内镜。GST来源于间质组织而非黏膜组织,通过胃镜进行病理活检的阳性率较低。最终确诊主要依赖术后的病理切片及免疫组化结果。典型的免疫组化表现为CD117及CD34阳性[3]。虽然分子靶向药物甲磺酸伊马替尼对治疗GST有效,但治疗间质瘤的首选方法仍是手术切除[4]。间质瘤主要通过血行扩散,较少发生淋巴结转移,因此,术中无需行淋巴结清扫[5],这一点为腹腔镜手术治疗GST提供了良好的基础。Karakousis等[6]报道直径≤8 cm的GST腹腔镜手术比开腹手术更具优势。对于较大直径GST腹腔镜手术亦有报道[7]。本研究中,肿瘤直径最大15 cm,因此我们认为较大直径GST亦可以行腹腔镜手术。Chang等[8]认为开腹条件下完整切除GST手术难度并不大,但相对腹腔镜手术而言,存在手术创伤大、术中出血多、术后恢复慢等缺点。本研究中,腹腔镜组术中出血量、术后排气时间、术后进流食时间及住院时间均少于开腹组,因此我们认为腹腔镜GST切除术与开腹手术相比,具有手术创伤小、术后胃肠功能恢复快、住院时间短等优点。
腹腔镜GST的切除方式有单纯腹腔镜手术及与胃镜联合手术,需根据肿瘤大小、位置及生长方式决定,应遵循以下原则:①避免挤压肿瘤及术中播散;②包括包膜在内的完整肿瘤切除;③尽可能保留胃壁组织;④避免术后胃肠道狭窄。通常手术方式有胃部分切除术、间质瘤剜除+胃壁修补术、打开胃壁+间质瘤切除+胃壁修补术等。腹腔镜技术缺乏触觉反馈,对于较小或未侵及浆膜层肿瘤,术中定位较困难,如果为寻找肿瘤而术中反复挤压肠管,则不符合肿瘤手术原则,可联合胃镜及内镜超声准确定位,既保证肿瘤完整切除,也可最大限度保留正常胃壁组织。靠近贲门、幽门的肿瘤切除后,亦可通过胃镜观察吻合口及胃腔有无狭窄。本研究腹腔镜组中,5例联合胃镜通过术中胃腔内准确定位,明确肿瘤与贲门及幽门的距离,从而确定手术切除范围,避免胃肠道狭窄。
GST大小是否会影响腹腔镜GST切除术的远期效果,曾一度成为讨论的焦点。2014年美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)及欧洲医学肿瘤学会(European Society of Medical Oncology,ESCO)指南中指出,腹腔镜在GIST手术中不断得到肯定[9],只要严格遵循恶性肿瘤的手术原则,直径≤5 cm的胃间质瘤可通过腹腔镜手术治疗,更大肿瘤可通过腹腔镜辅助的方式手术切除。国内外均有直径>10 cm的胃间质瘤成功实施腹腔镜手术的报道[7,10]。本研究腹腔镜组肿瘤最大直径为15 cm,因此, 我们认为只要严格遵守“无瘤”原则,肿瘤达15 cm亦可以考虑通过腹腔镜手术切除。避免术中播散是影响肿瘤复发的重要因素,同时必须保证足够的切缘。本研究2组切缘均>2 cm,术中病理切缘均为阴性。肿瘤装入标本袋中,切碎后小切口取出,既可减少创伤,又可以减少腹腔及切口播散。术后随访8~86个月,腹腔镜组及开腹组各1例肿瘤复发,无远处转移。2例初次术后病理恶性潜能均为高度,肿瘤复发可能与此有关。
综上所述,腹腔镜GST切除术与开腹手术相比,具有手术创伤小、术后胃肠功能恢复快、住院时间短等优点,具有明显的微创优势。随着腹腔镜技术水平的不断提高,腹腔镜手术将成为治疗GST的“金标准”。
1 常 青,党建锋,吴惠泽,等.腹腔镜下切除胃间质瘤25例报告.中国微创外科杂志,2014,14(1):63-65.
2 Siani LM,Ferranti F,Stefanuto A,et al.Laparoscopic total gastrectomy for multifocal gastric GST:a case report and review of the literature.Chir Ital,2009,61(2):199-203.
3 Kikuta K,Kubota D,Saito T,et al.Clinical proteomics identified ATP-dependent RNA helicase DDX39 as a novel biomarker to predict poor prognosis of patients with gastrointestinal stromal tumor.J Proteomics,2012,75(4):1089-1098.
4 Pantaleo MA,Di Battista M,Catena F,et al.Surgical debulking of gastrointestinal stromal tumors:is it a reasonable option after second-line treatment with sunitinib.J Cancer Res Clin Oncol,2008,134(5):625-630.
5 Nishimura J,Nakajima K,Omori T,et al.Surgical strategy for gastric gastrointestinal stromal tumors:laparoscopic vs open resection.Surg Endosc,2007,21(6):875-878.
6 Karakousis GC,Singer S,Zheng J,et a1.Laparoscopic versus open gastric resections for primary gastrointestinal stromal tumors (GISTs):a size-matched comparison.Ann Surg Oncol,2011, 18(6):1599-605.
7 Nguyen SQ,Divino CM,Wang JL,et al.Laparoscopic management of gastrointestinal stromal tumors.Surg Endosc,2006,20(5):713-716.
8 Chang SC,Ke TW,Chiang HC,et al.Laparoscopic excision is an alterative method for rectal gastrointestinal stromal tumor.Surg Laparosc Endosc Pereutan Tech,2010,20(4):284-287.
9 Ohtani H,Maeda K,Noda E,et al.Meta-analysis of laproscopic and open surgery for gastric gastrointestinal stromal tumor.Anticancer Res,2013,33:5031-5041.
10 陈 健,陈艳艳,许世萍,等.腹腔镜、胃镜治疗胃间质瘤48例.中国微创外科杂志,2014,14(12):1151-1153.
(修回日期:2016-08-03)
(责任编辑:王惠群)
A Comparison of Laparoscopic and Open Surgery for Gastric Stromal Tumor
PanJinduo,LiuXingguo,WuWenfeng,etal.
DepartmentofGeneralSurgery,TheSixthAffiliatedHospitalofJinanUniversity,Jiangmen529000,China
Correspondingauthor:LiuXingguo,E-mail:lrlxg2013@163.com
Objective To compare clinical effects between laparoscopic and open operation in the treatment of gastric stromal tumor (GST). Methods Clinicopathological data of 69 cases of GST resection from April 2007 to October 2014 were retrospectively analyzed. These cases were divided into laparoscopic group including 38 cases and open surgery group including 31 cases, respectively. The surgical duration, blood loss and postoperative recovery were compared.Results The surgical duration in the laparoscopic group [(77.1±15.7) min] had no significant difference as compared with the open group [(82.4±15.7) min,t=-1.390,P=0.169]. The amount of blood loss in the laparoscopic group [(71.1±23.3) ml] was less than that in the open group [(98.1±38.3) ml,t=-3.604,P=0.001]. The postoperative flatus time in the laparoscopic group [(40.7±6.8) h] was less than that in the open group [(46.6±9.0) h,t=-3.090,P=0.003]. The time to liquid diet in the laparoscopic group [(53.7±8.8) h] was less than that in the open group [(59.2±9.7) h,t=-2.485,P=0.015]. After laparoscopic surgery, there were 1 case of lung infection and 1 case of gastric leakage; whereas after open surgery, there were 1 case of incisional infection and 1 case of gastric leakage. The complication rates were 5.3% (2/38) and 6.5% (2/31), respectively, without significant difference (χ2=0.000,P=1.000). The hospital stay in the laparoscopic group [(7.9±1.5) d] was shorter than that in the open group [(9.2±1.7) d,t=-3.286,P=0.002]. During the follow-up period for 8-86 months, 2 cases of postoperative recurrence were observed, including 1 case from the laparoscopic group and 1 case from the open group, respectively. Conclusion Laparoscopic operation in the treatment of GST has no significant difference in clinical effects as compared with open operation, bearing advantages of less blood loss and quick recovery.
Gastric stromal tumor; Laparoscopy; Surgery
A
1009-6604(2016)11-0999-04
10.3969/j.issn.1009-6604.2016.11.011
2016-02-18)
* 通讯作者,E-mail:lrlxg2013@163.com

