瘦素对小鼠脑缺血/再灌注损伤神经元凋亡的影响*
司艺玲, 张金英, 邓子辉, 薛 辉, 颜光涛
(解放军总医院基础医学研究所生物化学研究室, 北京 100853)
瘦素对小鼠脑缺血/再灌注损伤神经元凋亡的影响*
司艺玲, 张金英, 邓子辉, 薛 辉, 颜光涛△
(解放军总医院基础医学研究所生物化学研究室, 北京 100853)
目的:研究Leptin在脑缺血性损伤神经元凋亡中的作用及其机制。方法:将75只雄性昆明小鼠完全随机分成3组,即假手术组、缺血/再灌注模型组、Leptin干预组;通过大脑中动脉栓塞(MCAO)复制小鼠局灶性脑缺血再灌注损伤模型,Leptin干预组在缺血0 min腹腔注射Leptin(1 μg/g体重),TUNEL染色检测神经元凋亡,RT-PCR检测凋亡相关基因bcl-2和caspase-3 mRNA表达,免疫组化凋亡相关基因bcl-2和caspase-3 蛋白水平的表达。结果:模型组脑缺血中心区神经元以坏死为主,与假手术组相比,其半影区神经元凋亡数量显著增多、促凋亡基因caspase-3和抑凋亡基因bcl-2的mRNA和蛋白表达水平均显著升高(P<0.01);与模型组比较,Leptin干预组半影区凋亡神经元数量显著减少、caspase-3 mRNA和蛋白表达水平显著降低(P<0.01),抑凋亡基因bcl-2 mRNA和蛋白表达水平显著升高(P<0.01)。结论:Leptin能够通过上调抑凋亡基因bcl-2表达,下调促凋亡基因caspase-3表达抑制神经元凋亡,在脑缺血性损伤中发挥神经保护作用。
瘦素;脑缺血;神经元;凋亡;神经保护;小鼠
【DOI】 10.13459/j.cnki.cjap.2016.04.005
瘦素(leptin)是由ob基因编码的一种脂源性多肽分子,在机体的能量调节方面具有重要作用。然而越来越多的证据也表明,Leptin与脑发育关系密切,啮齿类动物出生第二周Leptin水平就显著升高,此时Leptin并不是作为能量调节因子在起作用,而是作为营养因子促进下丘脑摄食控制环路的发育[1-4]。此外,大脑皮层、海马、神经元细胞和胶质细胞的成熟和运动能力均需要Leptin存在,Leptin缺陷的ob/ob小鼠脑组织较小,而且髓磷脂水平显著降低,给予外源性Leptin后可明显增加脑的重量、纠正神经发育的缺陷[5,6]。近年来,Leptin在脑缺血性损伤中的作用引起关注。本课题组前期研究发现,Leptin在脑缺血性损伤后能够通过修复神经胶质细胞的功能状态而间接发挥神经保护作用[7],但是,Leptin对于受损神经元是否具有直接修复作用,目前尚未见有研究报道。因此,本文拟建立复制小鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,研究Leptin在脑缺血性损伤神经元凋亡中的作用及其机制。
1 材料与方法
1.1 实验动物及分组
健康昆明小鼠75只,雄性,体重20~25g,中国医学科学院实验动物中心提供。自由饮食,饲养于SPF级动物实验室内。将75只小鼠完全随机分成3组,即假手术组、缺血/再灌注模型组、腹腔给予Leptin组,每组25只。
1.2 主要试剂
小鼠Leptin(mLeptin)购自美国PEPROTECH公司;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)购自美国Sigma公司;TUNEL原位凋亡检测试剂盒购自南京凯基生物科技发展有限公司;Trizol购自美国Promega公司;RT-PCR试剂盒购自美国Invitrogen公司;2×PCR Master Mix 购自北京天根生化技术有限公司;兔抗鼠Bcl-2、Caspase-3多克隆抗体购自美国Thermo Fisher Scientific公司;羊血清、SABC免疫组化试剂盒购自北京中杉金桥生物技术有限公司;其他试剂均为国产分析纯。
1.3 引物设计
根据PubMed GeneBank数据库公布的小鼠bcl-2、caspase-3和β-actin cDNA序列,应用Primer 5软件设计相应的引物,由北京三博远志生物技术有限责任公司合成,序列、产物大小及扩增条件见表1。
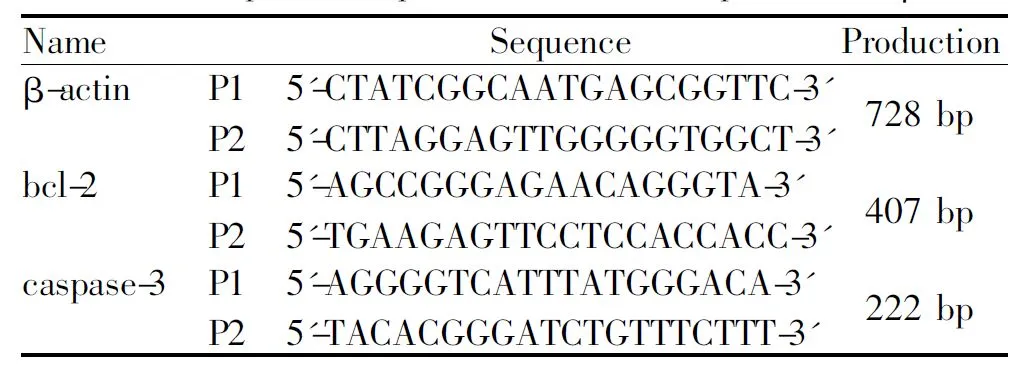
Tab. 1 The primer sequences of bcl-2, caspase-3 and β-actin
1.4 小鼠局灶性脑缺血/再灌注模型的制备及处理方法
用1%戊巴比妥钠腹腔注射(80 mg/kg体重)麻醉小鼠,采用改良的Longa线栓法[8]制备MCAO模型:分离并结扎右侧颈总动脉近心端和颈外动脉,在颈总动脉远心端剪一小口(距颈内、颈外动脉分叉处约0.5 cm),用眼科镊夹取适当直径的尼龙栓线沿切口插入,轻轻提起颈外动脉,以便于栓线顺利进入颈内动脉,当栓线顺利进入约1.5 cm时遇阻力即为进入颅内,结扎固定栓线后缝合皮肤,关闭切口,将栓线的尾端暴露在皮外。脑缺血2 h后轻轻回拉栓线1 cm,使头端撤回颈总动脉,实现再灌注。入选标准:小鼠清醒2 h后参照Longa等[8]方法进行评分,评为1~3分而且解剖取脑时未发现蛛网膜下腔出血者为模型成功标准。 Leptin干预组于栓线插入正确位置时(即缺血0 min)腹腔注射Leptin(1 μg/g体重),模型组腹腔注射等体积PBS作为对照,假手术组仅插入线栓0.5 cm。
1.5 TUNEL细胞凋亡检测
每组分别取小鼠5只,缺血2 h再灌注24 h后麻醉小鼠,开胸剪破右心耳,经左心室依次灌注生理盐水(含肝素0.4%)30 ml,4%多聚甲醛30 ml,立即取脑,置4%多聚甲醛中固定2 h,在额极后5 mm处取2 mm厚冠状切片,常规脱水、石蜡包埋切片,进行HE染色,根据HE染色结果判定缺血梗死灶部位并进行切片。切片用双蒸水洗涤,5 min×3次;滴加3%H2O2,50 μl,室温处理10 min,双蒸水洗2 min×3次;加0.01 mol/L TBS 1∶200 新鲜稀释的蛋白酶K,50 μl,37℃消化15 min,双蒸水洗2 min×3次;加标记缓冲液20 μl,室温放置15 min;分别取1 μl寡核苷酸末端脱氧核糖核酸转移酶(TdT)及地高辛标记的(DIG-dUTP)加至18 μl标记缓冲液中,混匀;甩掉切片上的标记缓冲液,加上上述混合标记液,20 μl,37℃ 湿盒中孵育2 h,0.01 mol/L TBS 洗2 min×3 次;加封闭液50 μl,室温30 min,甩去液体;用封闭液1∶100 稀释生物素化抗地高辛抗体,加至标本片上,50 μl,37℃湿盒中反应30 min,0.01 mol/L TBS 洗2 min×3 次;取SABC 加至切片,37℃反应30 min,0.01 mol/L TBS 洗5 min×4 次; DAB显色,水洗,苏木素轻度复染;常规梯度酒精脱水、二甲苯透明、中性树胶封片。
显微镜观察,细胞核呈棕褐色颗粒者为TUNEL(terminal deoxynucleotidyl transferase biotin-dUTP nick end labeling)阳性细胞,每张切片各取5个相互不重叠的高倍视野(10×40),计阳性细胞数及神经细胞总数,并计算阳性率。
1.6 RT-PCR检测凋亡相关基因bcl-2、caspase-3的表达
每组分别取小鼠15只(每个时间点每组5只),分别于缺血2 h再灌注12 h、24 h、36 h颈椎脱臼处死小鼠、迅速取脑,按照Promega公司Trizol说明书提取缺血侧脑组织总RNA,RNA纯度和完整性符合实验要求。cDNA第一链的合成按Invitrogen公司试剂盒操作,然后以cDNA第一链为模板,分别进行PCR扩增,获得bcl-2、caspase-3和β-actin目的片段,PCR反应条件见表2。
取5 μl PCR产物进行1.2%琼脂糖凝胶电泳,紫外灯下用Gel-Pro Imager Kit成像系统拍照,半定量分析产物的累积光密度值(IOD),与内参照β-actin比较的相对光密度值(relative OD)来评定表达水平。

Tab. 2 The parameter of polymerase chain reaction
1.7 免疫组化检测凋亡相关蛋白Bcl-2、Caspase-3的表达
各组分别取小鼠5只,缺血2 h再灌注24 h后麻醉小鼠,按照1.5方法处死并处理脑组织标本。根据HE染色结果判定缺血梗死灶部位并进行切片,按试剂盒说明书采用SABC法进行免疫组化染色。切片常规脱蜡至水,滴加3% H2O2,室温10 min,双蒸水洗3 min×3 次, 微波修复抗原;滴加5%BSA 血清封闭液,室温20 min;分别滴加PBS 1∶200~1∶300稀释的一抗(兔抗小鼠caspase-3、Bcl-2 IgG),37℃孵育120 min,PBS洗2 min×3 次;分别滴加PBS 1∶2 000稀释的二抗(生物素标记山羊抗兔IgG),37℃孵育20 min,PBS洗2 min×3 次;滴加试剂SABC,37℃ 反应20 min,PBS洗5 min×4 次;DAB显色, 蒸馏水洗涤;苏木素轻度复染,常规脱水,透明,封片。
显微镜观察,胞浆着色呈棕黄色为阳性细胞。光镜下每张切片随机选取5个视野,采用真彩色病理图像分析系统4.0(北京航空航天大学)测定平均光密度值,进行半定量分析。
1.8 统计学处理
2 结果
2.1 神经元凋亡(TUNEL染色)
凋亡神经元呈核固缩、浓染的棕褐色颗粒(图1,图1见彩图页Ⅴ)。假手术组仅见少量TUNEL阳性神经细胞;模型组TUNEL阳性神经细胞与假手术组相比明显增多(P<0.01),凋亡细胞主要分布于缺血梗死灶周边区(即半影区),在缺血中心区较少;Leptin干预组凋亡细胞较模型组显著减少(P<0.01,表3)。
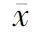

GroupApoptosisnumberPositivepercentage(%)Sham1.00±0.004.40±0.00Model12.83±1.77∗∗68.60±5.79∗∗Leptininterven⁃tion7.38±1.36##42.30±8.45##
**P<0.01vssham group;##P<0.01vsmodel group
2.2 小鼠脑组织凋亡相关基因bcl-2、caspase-3 mRNA表达产物分析
RT-PCR扩增产物电泳结果见图2,bcl-2、caspase-3 所对应的条带大小正确;对各组条带进行光密度值分析,结果显示模型组再灌注各时间点抑凋亡基因bcl-2、促凋亡基因caspase-3表达水平均明显高于假手术组(P<0.01);与模型组相比,Leptin干预组caspase-3表达水平于再灌注12 h、24 h两个时间注点显著降低(P<0.01, 图3),而抑凋亡基因bcl-2的表达于再灌注24 h、36 h两个时间点显著增强(P<0.01,图4)。

Fig. 2 Amplification of apoptosis related gene bcl-2 and caspase-3 by RT-PCR
M: DL2000 Marker; 1,4,7: Sham group after reperfusion 12 h, 24 h, 36 h; 2,5,8: Model group after reperfusion 12 h, 24 h, 36 h; 3,6,9: Leptin intervention group after reperfusion 12 h, 24 h, 36 h

Fig. 3 Effect of leptin on mRNA expression of promo-apoptosis gene caspase-3
**P<0.01vssham group;##P<0.01vsmodel group

Fig. 4 Effect of leptin on mRNA expression of anti-apoptosis gene bcl-2
*P<0.05,**P<0.01vssham group;##P<0.01vsmodel group
2.3 脑缺血半影区凋亡相关蛋白Bcl-2和Caspase-3的表达
假手术组有少量Bcl-2、Caspase-3蛋白表达,模型组缺血半影区Bcl-2和Caspase- 3蛋白表达光密度值较假手术组显著增加(P<0.01);Leptin干预组Caspase-3蛋白较模型组则显著减少,但是Bcl-2蛋白表达则显著高于模型组(P<0.01,表4,图5,图5见彩图页Ⅴ)。
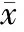

GroupBcl⁃2expressionCaspase⁃3expressionSham0.35±0.010.37±0.03Model0.51±0.04∗∗0.57±0.05∗∗Leptinintervention0.76±0.09##0.45±0.04∗∗##
**P<0.01vssham group;##P<0.01vsmodel group
3 讨论
脑缺血后受损神经元最终以坏死和凋亡两种形式死亡,在脑缺血急性期,神经元坏死与凋亡并存,缺血中心区细胞迅速坏死,缺血半暗区细胞凋亡被启动;而脑缺血的迟发性神经元死亡期,则以细胞凋亡为主。因此,大量研究认为,凋亡可能决定了缺血脑组织最终的梗死体积,针对凋亡环节的干预可减轻缺血/再灌注损伤程度,改善卒中的预后[9-11]。
本研究通过TUNEL染色观察凋亡神经元形态变化,发现MCAO模型小鼠损伤侧脑组织缺血中心区主要以细胞坏死为主,周围的半影区存在较多的神经元凋亡,而Leptin干预组缺血半影区的凋亡细胞数量较模型组显著减少,提示Leptin的神经保护作用可能与抗凋亡作用有关。
脑缺血损伤引起细胞凋亡机制非常复杂,受到多种凋亡相关基因及蛋白的调控,其中研究较多的有caspase-蛋白酶家族和bcl-2基因家族等。caspase-蛋白酶即半胱氨酸-天冬氨酸特异性的蛋白酶,是凋亡信号传导的共同通路,即凋亡的核心所在,各种引起细胞凋亡的因素,如Fas、P53等均须激活caspase才能导致细胞凋亡,caspase家族中的caspase-3被认为是凋亡级联反应中的关键酶,caspase-3水平可间接反映细胞凋亡程度,对caspase-3的干预可减少凋亡的发生;另一方面,bcl-2基因家族中的bcl-2具有抑制凋亡促进细胞存活的作用[12-14]。因此,细胞是否发生凋亡, 依赖于caspase-3和bcl-2表达水平的相对浓度。
为探讨Leptin在脑缺血/再灌注损伤中的抗凋亡机制,本研究检测了在Leptin干预下,凋亡相关基因bcl-2、caspase-3 mRNA表达水平的变化。结果发现,假手术组再灌注12 h bcl-2、caspase-3在mRNA水平均存在微量表达,再灌注24 h、36 h明显减弱,可能为机体对手术创伤的一过性应激反应所致;模型组脑组织bcl-2、caspase-3 mRNA表达水平显著升高,Leptin干预组bcl-2 mRNA表达水平较模型组进一步升高,caspase-3 mRNA表达水平较模型组显著降低,此趋势于再灌注24 h时间点最为显著。我们通过免疫组织化学方法进一步分析Leptin对Bcl-2、Caspase-3 蛋白表达水平的影响,得出的结论与mRNA表达水平一致,提示Leptin可通过抑制促凋亡基因caspase-3的表达活化、诱导抑凋亡基因bcl-2的表达,从而抑制脑缺血性损伤诱导的凋亡反应,促进神经细胞的存活。
目前在脑缺血/再灌注损伤模型中针对Leptin和凋亡相关基因之间的关系的研究国内外尚未见报道,本研究初步明确了Leptin通过抑制促凋亡基因caspase-3表达活化、诱导抑凋亡基因bcl-2表达,在脑缺血性损伤中发挥抗凋亡的神经保护作用。此结果与McGaffin KR等[15]在心脏缺血/再灌注模型中的研究结果一致,他们观察到Leptin在小鼠心肌梗死模型中可通过STAT-3信号途径上调bcl-2和survivin(存活素)基因表达水平、下调caspase-3表达水平,从而起到心肌保护的作用。虽然对Leptin诱导细胞凋亡的详细过程尚不十分清楚,但是越来越多的研究证据支持Leptin在损伤修复过程具有重要作用,提示其可能作为一个核心,以细胞能量调节为基础,以复杂的网络方式发挥着保护作用。
[1] Kim JG, Suyama S, Koch M,etal. Leptin signaling in astrocytes regulates hypothalamic neuronal circuits and feeding [J].NatNeurosci, 2014, 17(7): 908-910.
[2] Do HJ, Jin T, Chung JH,etal. Voglibose administration regulates body weight and energy intake in high fat-induced obese mice [J].BiochemBiophysResCommun, 2014, 443(3): 1110-1117.
[3] Wada N, Hirako S, Takenoya F,etal. Leptin and its receptors [J].JChemNeuroanat, 2014, 61-62: 191-199.
[4] Khanh DV, Choi YH, Moh SH,etal. Leptin and insulin signaling in dopaminergic neurons: relationship between energy balance and reward system [J].FrontPsychol, 2014, 5: 846.
[5] Goforth PB, Leinninger GM, Patterson CM,etal. Leptin actsvialateral hypothalamic area neurotensin neurons to inhibit orexin neurons by multiple GABA-independent mechanisms [J].JNeurosci, 2014, 34(34): 11405-11415.
[6] Mela V, Díaz F, Lopez-Rodriguez AB,etal. Blockage of the neonatal leptin surge affects the gene expression of growth factors, glial proteins, and neuropeptides involved in the control of metabolism and reproduction in peripubertal male and female rats [J].Endocrinology, 2015, 156(7): 2571-2581.
[7] Zhang JY, Yan GT, Liao J,etal. Leptin attenuates cerebral ischemia/reperfusion injury partially by CGRP expression [J].EurJPharmacol, 2011, 671(1-3): 61-69.
[8] Longa EZ, Weinstein PR, Carlson S,etal. Reversible middle cerebral artery occlusion without craniectomy in rats [J].Stroke, 1989, 20(1): 84-91.
[9] Marzban H, Del Bigio MR, Alizadeh J,etal. Cellular commitment in the developing cerebellum [J].FrontCellNeurosci, 2015, 8: 450.
[10]Hirayama Y, Ikeda-Matsuo Y, Notomi S,etal. Astrocyte-mediated ischemic tolerance [J].JNeurosci, 2015, 35(9): 3794-3805.
[11]颜 玲, 周庆华. 黄芪多糖对缺血性脑损伤大鼠的神经保护作用及其机制研究 [J]. 中国应用生理学杂志, 2012, 28(4): 373-377.
[12]Kim YR, Kim HN, Jang JY,etal. Effects of electroacupuncture on apoptotic pathways in a rat model of focal cerebral ischemia [J].IntJMolMed, 2013, 32(6): 1303-1310.
[13]Nishijima Y, Niizuma K, Fujimura M,etal. Consistent delayed unilateral neuronal death after modified transient focal cerebral ischemia in mice that mimics neuronal injury after transient global cerebral ischemia [J].JNeurosurg, 2015, 123(1): 243-253.
[14]张明艳, 范淑娟, 李利平, 等. 灯盏花注射液抗新生鼠缺氧缺血性脑损伤的作用及对Bcl-2、Bax蛋白表达的影响 [J]. 中国应用生理学杂志, 2011, 27(2): 196-200.
[15]McGaffin KR, Witham WG, Yester KA,etal. Cardiac-specific leptin receptor deletion exacerbates ischaemic heart failure in mice [J].CardiovascRes, 2011, 89(1): 60-71.
The effects of leptin on neuron apoptosis in mice with cerebral ischemia/reperfusion injury
SI Yi-ling, ZHANG Jin-ying, DENG Zi-hui, XUE Hui, YAN Guang-tao△
(Research Laboratory of Biochemistry, Basic Medical Institute, General Hospital of PLA, Beijing 100853, China)
Objective: To study the effect of leptin on neuron apoptosis in mice with cerebral ischemia injury. Methods: Seventy-five male Kuming mice were randomly divided into 3 groups: sham, model and leptin intervention group, respectively. Focal cerebral ischemia/reperfusion injury model in mice was established by middle cerebral artery occlusion. Leptin intervention group was injected with leptin (1 μg/g weight, I.P.) at 0 min of ischemic injury. Neuron apoptosis was detected by TUNEL staining. The mRNA expression of apoptosis relative gene bcl-2 and caspase-3 were detected by RT-PCR. The protein expression of bcl-2 and caspase-3 were detected by immunohistochemistry. Results: In model group, most of the neurons in the central area of cerebral ischemia had necrosis obviously, and the amount of neuron apoptosis was much higher than that in sham group (P<0.01). Compared with sham group, both expression of pro-apoptosis gene caspase-3 and anti-apoptosis gene bcl-2 increased significantly in model group (P<0.01). Compared with model group, the amount of neuron apoptosis and expression level of caspase-3 were decreased significantly (P<0.01), whereas the mRNA and protein expression of bcl-2 were increased significantly in leptin intervention group (P<0.01). Conclusion: Leptin could reduce neuron apoptosis through down-regulation the expression of caspase-3 and up-regulation the expression of bcl-2. It suggests that leptin could play a neuroprotective role in cerebral ischemia injury.
leptin; cerebral ischemia; neuron; apoptosis; neuroprotection; mice
国家自然科学基金资助项目(30670821)
2015-11-04
2016-04-05
R743.310
A
1000-6834(2016)04-305-06
△【通讯作者】Tel: 010-66937027; E-mail: yan301@263.net

