右美托咪定对大鼠I/R损伤肺组织TLR4表达及保护作用的影响*
何金波, 宋 冬, 罗梓垠, 张聪聪, 应 磊, 汪 洋, 王万铁△
(1. 温州医科大学缺血/再灌注损伤研究所, 浙江 温州 325035; 2. 十堰市太和医院麻醉科, 湖北 十堰 442000)
右美托咪定对大鼠I/R损伤肺组织TLR4表达及保护作用的影响*
何金波1,2, 宋 冬1, 罗梓垠1, 张聪聪1, 应 磊1, 汪 洋1, 王万铁1△
(1. 温州医科大学缺血/再灌注损伤研究所, 浙江 温州 325035; 2. 十堰市太和医院麻醉科, 湖北 十堰 442000)
目的:探讨右美托嘧啶对大鼠再灌注损伤肺组织Toll样受体素4(TLR4)表达的调控,并分析其对肺保护作用机制。方法:采用大鼠在体左侧肺缺血/再灌注(I/R)模型,50只健康雄性成年SD大鼠随机分为5组(n=10):对照组(Sham组)、缺血/再灌注组(I/R组)、右美托咪定组(Dex组)、阿替美唑组(Atip组)、右美托咪定+阿替美唑组(Dex+Atip组),实验结束后处死大鼠,留取左肺,检测肺湿干重比(W/D)和总肺水含量(TLW);光镜下观察肺组织形态结构变化;PCR检测肺组织TLR4 mRNA表达;Western blot检测肺组织TLR4的蛋白表达。结果:与Sham组相比,其余各组W/D和TLW明显升高(P<0.05,P<0.01),TLR4 mRNA和蛋白表达量上升(P<0.01),光镜显示肺组织结构出现明显损伤性变化;与I/R组相比,Dex组W/D和TLW下降(P<0.05,P<0.01),TLR4 mRNA和蛋白表达量降低(P<0.01),光镜下肺组织损伤减轻;与Dex组比较,Dex+Atip组W/D和TLW明显升高(P<0.05,P<0.01),TLR4 mRNA和蛋白表达量上升(P<0.01),光镜肺组织结构损伤严重;I/R组、Atip组、Dex+Atip组两两比较,以上各指标均无统计学差异(P>0.05)。结论:I/R可引起大鼠肺组织TLR4表达上调和肺组织损伤;右美托咪啶可减轻肺I/R损伤,抑制TLR4表达,这种作用与α2-肾上腺素能受体有关。
右美托咪啶;缺血/再灌注损伤;炎症反应;Toll样受体素4;大鼠
【DOI】 10.13459/j.cnki.cjap.2016.04.018
研究和临床中发现,缺血组织或器官在恢复血流灌注后,反而产生了损伤加重的现象,即缺血/再灌注损伤 (ischemia/reperfusion injury,I/RI)。随着医学科学的迅猛发展,肺动脉袖状切除、肺移植、心肺联合移植、肺溶栓治疗等新的医疗方法不断地建立和应用,在术中恢复血流灌注过程中所出现的肺缺血/再灌注损伤(lung ischemia/reperfusion injury, LI/RI)已经成为了导致患者术后呼吸功能障碍及急性肺损伤发生,影响患者预后的主要原因。研究表明,LI/RI的发生是由多种因素共同作用的结果,再灌注期间,自由基的大量生成、炎症反应、凋亡都是导致LI/RI的重要原因[1-3]。
TLRs是l类模式识别受体(pattern recognition receptors,PRRs),是介导内毒素/脂多糖应答的主要受体,能识别外源性微生物或内源性配体,对致病因素的相关分子肽进行识别,从而启动免疫调控程序, 介导天然免疫和炎症反应[4]。 在机体各个器官的缺血/再灌注过程中,Toll样受体素4(Toll-like receptor 4,TLR4)也发挥着重要作用,是介导器官再灌注损伤的重要因素之一[5-7]。
右美托咪定(dexmedetomidine,Dex)是比可乐定特异性更强的一种高选择性的α2肾上腺素受体激动剂,研究表明,右美托嘧啶有较好的降低应激反应、维持循环血流动力学稳定、预防术后谵妄的效果,能够有效改善术中缺血对器官组织的损伤,对缺血/再灌注器官有很好的保护作用,能减轻再灌注损伤,但具体的机制目前尚不清楚[8,9]。阿替美唑(atipamezole,Atip)是一种特异性α2-肾上腺素受体阻滞剂,它可以有效拮抗α2肾上腺素受体激动剂对α2肾上腺素受体的激动作用,快速逆转α2肾上腺素受体激动引起的镇静和麻醉。本实验选用右美托咪定进行干预,研究其对大鼠再灌注损伤肺组织TLR4表达的调控,并通过加用阿替美唑进一步研究其可能的肺保护作用机制,为临床手术中选择合适的麻醉药减轻再灌注损伤提供新的思路。
1 材料与方法
1.1 实验动物与主要试剂
SPF级健康雄性成年SD大鼠50只,体重(300±30)g,由温州医学院实验动物中心提供【SYXK(浙)2010-0150】。RT-PCR试剂盒购自美国Ferments公司,RT-PCR引物购自上海生工生物工程技术公司,TLR4一抗、二抗购自英国abcam公司。GAPDH一抗购自中国杭州贤至科技有限公司,GAPDH二抗购自中国碧云天生物技术研究所,BCA蛋白定量试剂盒购自中国碧云天生物技术研究所,其它试剂均为国产分析纯产品。
1.2 大鼠肺缺血/再灌注损伤模型的制备和实验分组
采用大鼠在体左侧肺缺血/再灌注(ischemia/reperfusion, I/R)模型,大鼠称重后,用20%乌拉坦(7 ml/kg)腹腔注射麻醉,颈胸部皮肤消毒,暴露气管后,行T型切口切开,置人14-gauge气管插管,接小动物呼吸机行机械通气,调节呼吸机参数为:呼吸频率RR 70次/分,吸呼比为I∶E=3∶4,氧浓度100%,潮气量30 ml/kg。于大鼠左胸部3-5肋间心脏搏动最明显处开胸,仔细游离左侧肺门,肝素50 U/kg大鼠阴茎背静脉注射5 min后,用无损伤动脉夹阻断左侧肺门,当通气时肺组织不再膨胀,表明阻断成功,阻断左肺门30 min后松开动脉夹,再灌注2 h。灌注结束后采集血样,处死SD大鼠,取左肺组织。大鼠50只,体重(300±30)g,随机分为5组(n=10):对照组(Sham组)、缺血/再灌注组(I/R组)、右美托咪定组(Dex组)、阿替美唑(atipamezole,Atip)组(Atip组)、右美托咪定+阿替美唑组(Dex+Atip组)。Sham组:仅行开胸处理,不夹闭肺门,机械通气150 min;I/R组:开胸后行左侧肺门阻断30 min,再灌注2 h;Dex组:肺门阻断前30 min给予腹腔注射右美托咪啶(20 μg/kg),其余处理同I/R组;Atip组:肺门阻断前30 min给予腹腔注射阿替美唑(250 μg/kg),其余处理同I/R组;Dex+Atip组:肺门阻断前30 min腹腔同时注射右美托咪定(20 μg/kg)和阿替美唑(250 μg/kg),其余处理同I/R组。
1.3 肺W/D和TLW检测
实验结束,取左肺上叶组织, 用生理盐水漂洗表面残留血液, 滤纸吸干表面水分,称重,记为湿重(wet weight,W); 在恒温电热鼓风干燥箱70℃ 24 h烘干后称重,记为干重(dry weight,D),两者之比为肺湿干重比 (wet/dry weight ratio,W/D)。肺总肺水含量 (total lung water content,TLW) 的计算公式如下:TLW =(W-D)/D 。
1.4 光镜下肺组织形态学观察及肺泡损伤定量评估
再灌注结束后,取左肺下叶约0.5 cm×0.5 cm×0.5 cm 大小肺组织,经4%甲醛固定,常规进行石蜡包埋切片,HE染色,光镜下观察各组标本组织学改变。在400倍视野下随机连续观察50个视野,计数每个视野下的总肺泡数及损伤肺泡数。肺泡内含红细胞或白细胞超过2个或肺泡内含有水肿渗出液的均视为损伤肺泡,计算损伤肺泡数与总肺泡数的
比值,把损伤肺泡数占总计肺泡数百分比的值作为肺泡损伤评估指数(index of quantitative assessment,IQA)。
1.5 RT-PCR方法检测大鼠肺组织中TLR4 mRNA的表达
各组分别取-70℃冷藏肺组织100 mg,放入研钵中,Trizol法提取大鼠肺组织总RNA,蛋白核酸仪进行RNA浓度检测。按RNA逆转录试剂盒说明书合成cDNA产物。按RT-PCR逆转录试剂盒说明书准备25 μl的反应体系: 模板cDNA 1 μl(2 μg/μl) ,PCR Mix 12.5 μl,上下游引物各1 μl,加三蒸水至25 μl ,引物序列见表1。TLR4的PCR反应条件:94℃ 预变性3 min,进入循环:94℃ 30 s,58℃ 30 s,72℃ 1 min,29个循环,再72℃ 5 min。GAPDH的PCR反应条件:94℃ 预变性3 min,进入循环:94℃ 30 s,58℃ 30 s,72℃ 1 min,28个循环,再72℃ 5 min。PCR产物用1.5%的琼脂糖凝胶进行电泳,用MUVB-20凝胶图像分析仪进行灰度值扫描,拍照。用Quantity One凝胶软件分析系统分析灰度值,TLR4 mRNA的表达量用GAPDH内参的灰度值进行校正,以TLR4 mRNA灰度值和GAPDH mRNA灰度值之比作为TLR4 mRNA相对表达量。
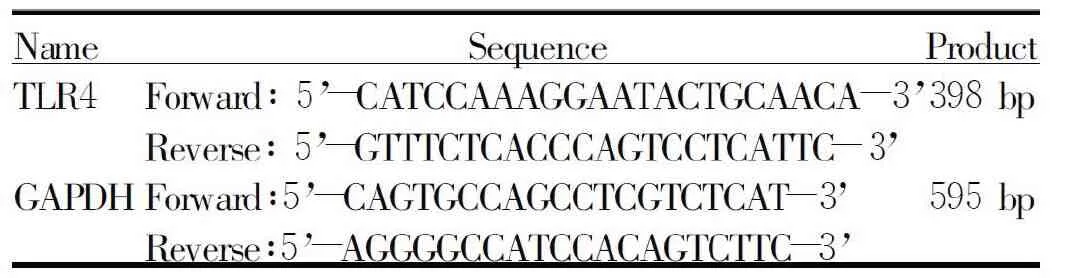
Tab. 1 Sequences of the primers
1.6 Western blot方法检测大鼠肺组织中TLR4蛋白的表达
各组取肺组织100 mg置于预冷的研钵中,加液氮研成粉末后,同时加入RIPA裂解液(强)1 000 μl和PMSF 10 μl,充分匀浆,将匀浆液转移至1.5 ml EP管,置于冰上30 min,使其充分裂解,然后4℃ 12 000 r/min,离心5 min,吸取上清。BCA法测定蛋白含量,用5×蛋白上样缓冲液将蛋白样品调整至同一浓度,沸水浴煮沸10 min,冷却后,分装保存-20℃备用。 配制10%分离胶和5%浓缩胶,每个样孔上样20 μl(2 μg/μl),行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳结束后,转膜,漂洗转入封闭液(5%脱脂奶粉),室温封闭90 min。封闭结束后,将PVDF膜取出,转入一抗稀释液(5%脱脂牛奶配制)中,4℃冰箱孵育过夜(15 h)。一抗孵育结束后,将PVDF膜用TBST液洗涤10 min×3次,然后将其转入二抗稀释液中孵育,室温1.5 h。ECL发光、显影及定影。扫描底片,用Quantity One凝胶软件分析系统进行灰度值分析,以TLR4蛋白的灰度值与GAPDH蛋白的灰度值比值作为TLR4蛋白的相对含量。
1.7 统计学处理

2 结果
2.1 各组大鼠肺 W/D 和T LW的比较
与Sham组相比,其余各组的W/D和TLW的值均明显升高(P<0.05,P<0.01),肺组织水肿加重;与I/R组相比,Dex组肺组织水肿有明显改善,W/D、TLW下降(P<0.01),提示Dex对再灌注肺组织的保护作用;Dex+Atip组的W/D和TLW与Dex组相比明显升高,差异有明显统计学意义(P<0.01),与I/R组的W/D和TLW相比,差异无统计学意义。Atip组的W/D和TLW与I/R组比较,差异无统计学意义(表2)。
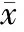

GroupW/DTLWSham1.98±1.950.98±1.95I/R5.09±0.38∗∗4.09±0.38∗∗Dex2.88±0.39∗##1.88±0.39∗##Atip5.36±0.39∗∗ΔΔ4.36±0.39∗∗ΔΔDex+Atip5.38±0.39∗∗ΔΔ4.38±0.39∗∗ΔΔ
I/R: Ischemia/reperfusion; Dex: Dexmedetomidine; Atip: Atipamezole; W/D: Wet/dry weight ratio; TLW: Total lung water content
*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsI/R group;ΔΔP<0.01vsDex group
2.2 各组光镜下肺组织形态学变化及肺泡损伤定量评估
Sham组肺间质及肺泡完整,未见炎症细胞浸润,肺组织损伤评分较低,肺泡损伤轻微 ;I/R组肺泡结构紊乱,肺泡壁水肿增厚或破裂,间质出现水肿,肺泡内见渗出液或红细胞漏出,肺泡损伤评分与Sham组相比,差异有显著统计学意义(P<0.01);Dex组较I/R组肺组织损伤减轻,肺泡结构相对较完整,肺泡内水肿及炎症细胞浸润均有不同程度减轻,肺泡间质渗出减少,IQA的值明显降低,差异有显著统计学意义(P<0.01),直观反映了Dex对再灌注肺组织的保护作用;Dex+Atip组肺泡结构紊乱,肺泡壁水肿严重,间质内严重渗出,肺泡内见大量渗出液或红细胞,肺泡损伤评分与Dex组相比,差异有显著统计学意义(P<0.01),与I/R组相比,差异无统计学意义;Atip组与I/R组相比,差异无统计学意义(表3,图1,图1见彩图页Ⅵ)。
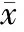
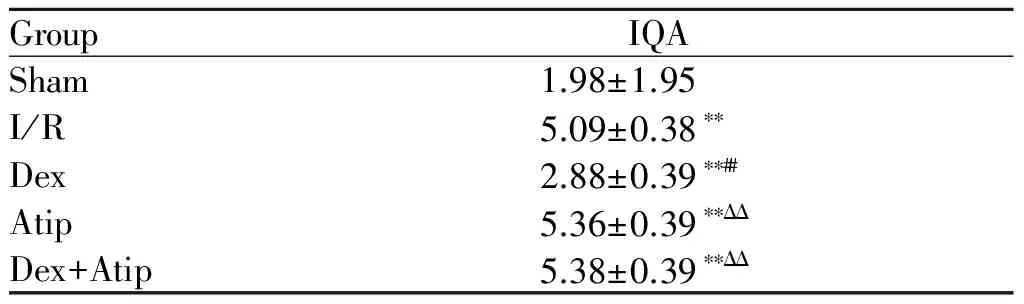
GroupIQASham1.98±1.95I/R5.09±0.38∗∗Dex2.88±0.39∗∗##Atip5.36±0.39∗∗ΔΔDex+Atip5.38±0.39∗∗ΔΔ
I/R: Ischemia/reperfusion; Dex: Dexmedetomidine; Atip: Atipamezole; IQA: Index of quantitative assessment
**P<0.01vssham group;##P<0.01vsI/R group;ΔΔP<0.01vsDex group
2.3 各组肺组织TLR4 mRNA相对表达量的比较
与Sham组相比,其余各组肺组织TLR4 mRNA相对表达量显著升高(P<0.01);与I/R组相比,Dex组TLR4 mRNA相对表达量明显降低(P<0.01);Dex+Atip组与Dex组比较,TLR4 mRNA相对表达量显著升高,差异有统计学意义(P<0.01),Dex+Atip组肺组织TLR4 mRNA相对表达量与I/R组相比,差异无统计学意义(P>0.05),Atip组的TLR4 mRNA相对表达量与I/R组相比,差异无统计学意义(图2)。
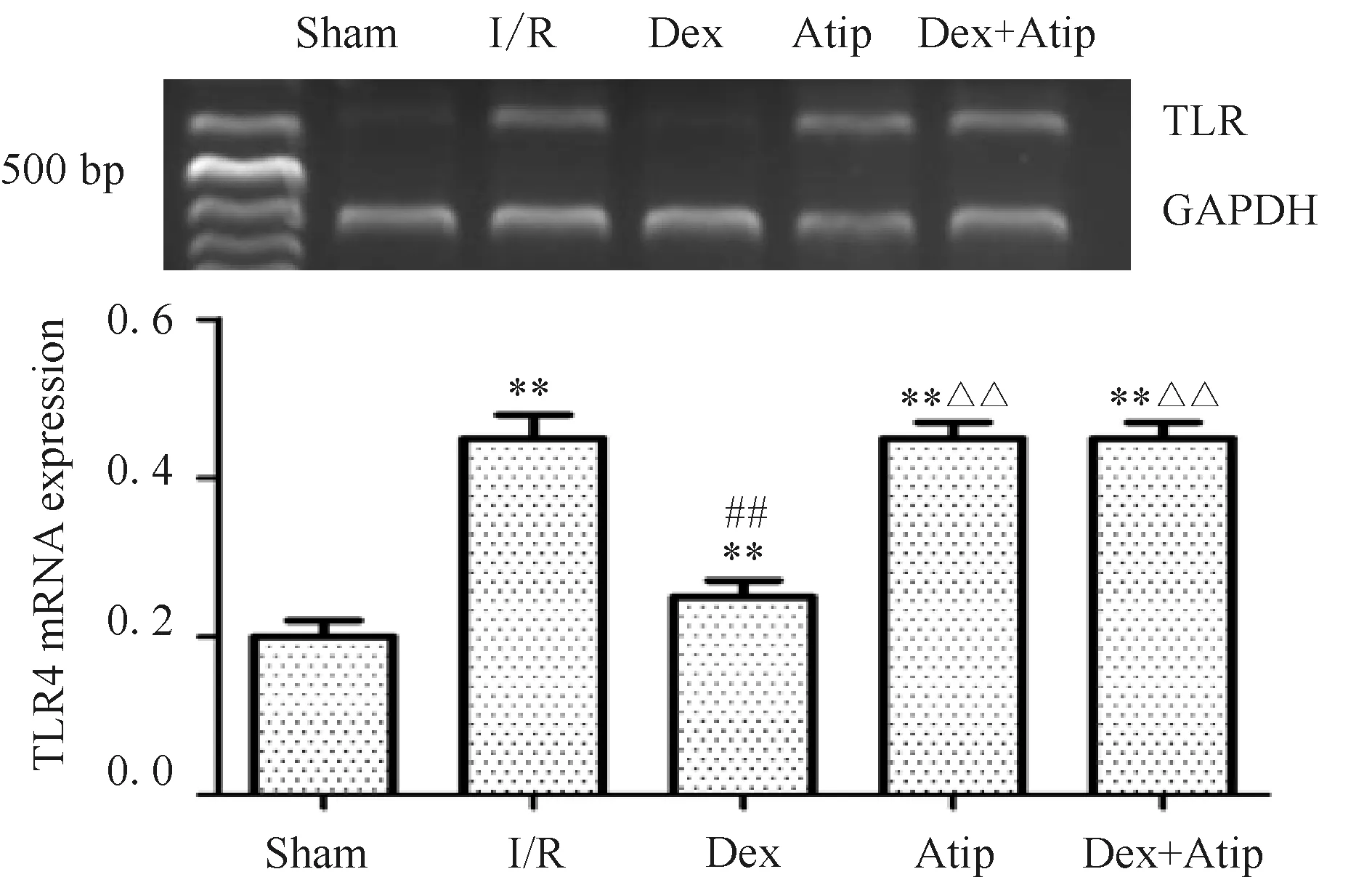
Fig. 2 TLR4 mRNA expression in different groups
I/R: Ischemia/reperfusion; Dex: Dexmedetomidine; Atip: Atipamezole; TLR4: Toll like receptor 4
**P<0.01vsSham group;##P<0.01vsI/R group;
ΔΔP<0.01vsDex group
2.4 各组大鼠肺组织TLR4蛋白表达量的比较
与Sham组相比,其余各组肺组织TLR4 蛋白的表达量有明显上升(P<0.01);与I/R组相比, Dex组TLR4蛋白含量明显降低(P<0.01),与Dex组比较,Dex+Atip组TLR4蛋白相对表达量明显上升,差异有统计学意义(P<0.01),与I/R组比较,Dex+Atip组蛋白相对表达量差异均无统计学意义;Atip组的TLR4 蛋白含量与I/R组相比,差异无统计学意义(图3)。
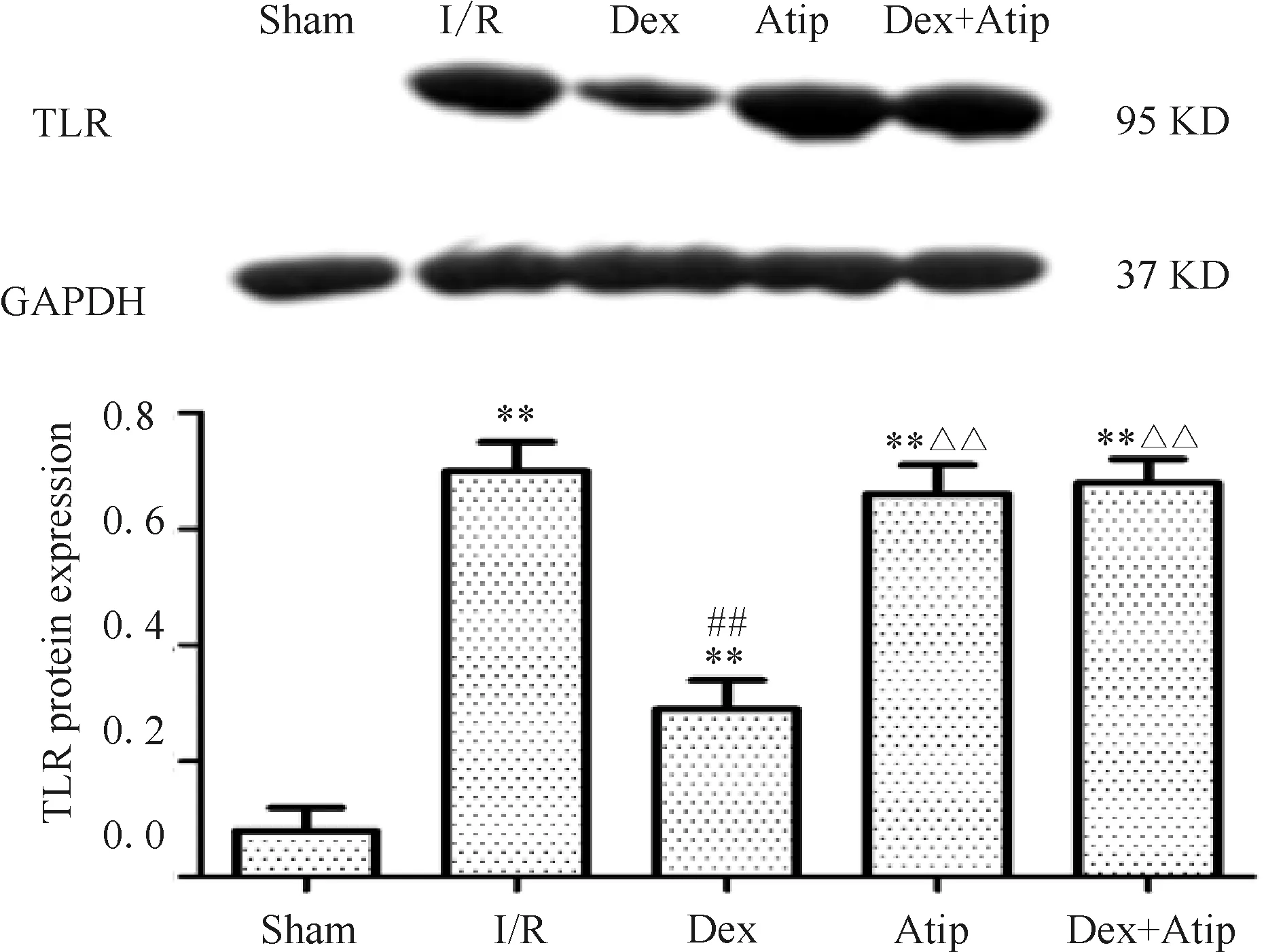
Fig. 3 TLR protein expression in different groups
I/R: Ischemia/reperfusion; Dex: Dexmedetomidine; Atip: Atipamezole
**P<0.01vssham group;##P<0.01vsI/R group;
ΔΔP<0.01vsDex group
3 讨论
炎症反应在机体各种疾病的发生发展中扮演着重要角色,在机体各个器官的缺血/再灌注进程中,炎症反应也是引起再灌注损伤的重要因素。在我们之前的研究,离体心肌缺血/再灌注过程中,随着再灌注时间的延长,心肌中炎症IL-1β的表达量上升,介导炎症反应,最终引起心肌再灌注损伤[10]。TLR4是一种主要的天然免疫模式识别受体,可与病原识别模式分子结合,通过诱导NF-κВ的活化,引发众多前炎性因子的表达,介导机体的炎症损伤。有研究表明,心脏、脑、肾脏等其他器官在经历缺血/再灌注后,TLR4/NF-κB通路被激活,炎症因子的表达量升高,而在使用药物干预后,通过抑制TLR4 所介导的炎症反应,使相应组织与血浆中炎症介质的表达降低,器官的缺血/再灌注损伤也得到有效缓解[11]。TLR4的过度表达和各种原因所致的肺损伤有密切联系,也是引起再灌注肺损伤的重要原因[12]。
作为一种高选择性α2肾上腺素受体激动剂,右美托咪定于2009年才开始国内应用,其具有剂量依赖性的镇静、镇痛、抗焦虑和催眠作用[13]。与咪达唑仑等其他镇静药相比,右美托咪定作为术前用药不会产生呼吸抑制作用,且保留了生理睡眠周期,极大地减少了手术病人在苏醒后谵妄、躁动的发生。近些年来,右美托咪定在临床应用时对围术期I/R器官的保护作用也得到了大家的肯定。有实验表明,右美托咪定能减轻心脏、脑、肾脏等器官的I/R损伤[14]。
实验结果显示,与Sham组相比,大鼠肺组织在经历缺血/再灌注之后,出现了严重损伤,肺W/D和TLW上升,水肿严重,光镜下肺泡内大量炎症细胞浸润,TLR4 mRNA和蛋白表达量上升。在经过右美托咪定预处理后,与 I/R组相比,大鼠肺W/D和TLW下降,水肿减轻,光镜下肺泡内炎症细胞浸润大大降低。在经过右美托咪定预处理后,TLR4 mRNA和蛋白表达量下降,TLR4的转录与翻译受到抑制,说明右美托咪定对I/R肺的保护作用与抑制TLR4表达有关。Atip组肺组织的W/D和TLW与I/R组相比,差异无统计学意义,Atip组TLR4 mRNA和蛋白表达量与I/R组的差异也无明显统计学意义,光镜下可直观看到Atip组与I/R组的肺组织损伤相当,IQA的值差异无明显统计学意义,这些都提示单独使用Atip对肺缺血/再灌注进程没有影响,但在Dex+Atip组,当在使用右美托咪定和阿替美唑同时腹腔注射后,Dex+Atip组TLR4 mRNA和蛋白表达量与Dex组相比,出现了明显的上升,光镜下肺组织炎症浸润加重,IQA的值升高,并且将Dex+Atip组和I/R组相比,以上指标均无统计学意义,说明了阿替美唑完全阻断了右美托咪定对再灌注损伤肺组织的保护作用,提示右美托咪定通过激动α2-肾上腺素能受体抑制TLR4表达、保护再灌注损伤肺组织。
综上所述,在肺的缺血/再灌注过程中,TLR4的过度表达是介导再灌注肺损伤的重要原因。右美托咪定通过抑制TLR4表达起到对I/R肺的保护作用,其机制与激动α2-肾上腺素能受体有关。
[1] 王万铁, 周伟斌, 倪世蓉, 等. 川芎嗪对兔肺缺血/再灌注损伤时血红素氧合酶-1表达与活性的影响[J]. 中国应用生理学杂志, 2005, 21(4): 427-431.
[2] 周俊辉, 马迎春, 何金波, 等. 姜黄素对肺缺血/再灌注损伤小鼠Caspase-12及细胞凋亡的影响[J]. 中西医结合杂志, 2014, 34(9): 1118-1124.
[3] 陈海娥, 马迎春, 何金波, 等. 缺血后处理对肺缺血/再灌注损伤的保护作用及其机制[J]. 中国应用生理学杂志, 2014, 30(3): 251-256.
[4] Takata S, Sawa Y, Uchiyama T,etal. Expression of Toll-Like receptor 4 in glomerular endothelial cells under diabetic conditions[J].ActaHistochemCytochem, 2013, 6(1): 35-42.
[5] Tan Z, Shi Y, Yan Y,etal. Impact of endogenous hydrogen sulfide on toll-like receptor pathway in renal ischemia/reperfusion injury in rats[J].RenFail, 2015, 37(4): 727-733.
[6] Vilahur G, Badimon L. Ischemia/reperfusion activates myocardial innate immune response: the key role of the toll-like receptor[J].FrontPhysiol, 2014, 12(5): 496.
[7] Lu C, Ren D, Wang X,etal. Toll-like receptor 3 plays a role in myocardial infarction and ischemia/reperfusion injury[J].BiochimBiophysActa, 2014, 1842(1): 22-31.
[9] Guler L, Bozkirli F, Bedirli N,etal. Comparison of the effects of DexmedetomidinevsKetamine in cardiac ischemia/reperfusion injury in rats-preliminary study[J].AdvClinExpMed, 2014, 23(5): 683-689.
[10]何金波, 包财盈, 叶玉柱, 等. 缺氧/复氧大鼠心肌中IL-1β浓度的动态变化及意义[J]. 中国应用生理学杂志, 2014, 30(1): 55-59.
[11]刘亚坤, 黄林静, 赵 珊, 等. 血必净注射液对缺氧/复氧大鼠心肌TLR4--NF-κВ--IL-1β通路的影响[J]. 中国应用生理学杂志, 2014, 30(1): 55-59.
[12]金晓凤, 徐正衤介, 王万铁, 等. 虎杖甙对家兔肺缺血/再灌注损伤肺组织TLR4和ICAM-1表达的影响[J]. 中国应用生理学杂志, 2009, 25(1): 41-44.
[13]Gupta S, Singh D, Sood D,etal. Role of dexmedetomidine in early extubation of the intensive care unit patients[J].JAnaesthesiolClinPharmacol, 2015, 31(1): 92-98.
[14]Samantaray A, Hemanth N, Gunnampati K,etal. Comparison of the effects of adding dexmedetomidine versus midazolam to intrathecal bupivacaine on postoperative analgesia[J].PainPhysician, 2015, 18(1): 71-77.
Dexmedetomidine prevents inflammatory responses in injured rat lung tissues induced by ischemia/reperfusion through inhibition of TLR4 expression
HE Jin-bo1,2, SONG Dong1, LUO Zi-yin1, ZHANG Cong-cong1, YING Lei1, WANG Yang1, WANG Wan-tie1△
(1. Ischemia/Reperfusion Injury Research Institute, Whenzhou Medical University, Whenzhou 325035;2. Department of Anesthesiology, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, China)
Objective: To investigate the effect of Dexmedetomidine (Dex) on Toll-like receptor 4(TLR4) expression in lung during lung ischemia/reperfusion(I/R) in rats and its possible protecting mechanisms. Methods:InvivoI/R model in left lung of SD rats was established. Fifty adult healthy male SD rats were randomly divided into five groups (n=10): control group (Sham group), I/R group, Dex group, atipamezole group (Atip group) and Dex+Atip group. After the I/R experiment,rats were killed and the left lung tissues were harvested to get the lung wet/dry weight(W/D); Ultrastructure of lung tissue were observed under light microscopy; The mRNA expression of TLR4 in lung tissues were determined by RT-PCR; The protein level of TLR4 in lung tissues was detected by Western blot. Results: ①Compared with those in the Sham group, W/D and total lung water content (TLW) in other groups increased significantly (P<0.05), the mRNA and protein expression levels of TLR4 in lung tissues increased too. The structure damages of lung tissues observed under light microscopy in other groups were more than that of Sham group. ②Compared with those in the I/R group, W/D and TLW in the Dex group were lower (P<0.05,P<0.01), the mRNA and protein expression levels of TLR4 in lung tissues decreased (P<0.01), and reduced structure damages of lung tissues were observed under light microscopy in Dex group. ③Compared with those in the Dex group, W/D and TLW in the Dex+Atip group were higher (P<0.01), the mRNA and protein expression levels of TLR4 in lung tissues increased (P<0.01), and the structure damages of lung tissues observed under light microscopy were more serious. There was no significant difference of the above parameters among I/R、Atip、Dex+Atip groups. Conclusion: Lung ischemia/reperfusion caused high expression of TLR4 and finally induced damages of the lung. Dexmedetomidine could inhibit TLR4 expression and alleviate the lung ischemia/reperfusion injury, which was related to activation of α2-adreno receptor.
dexmedetomidine; ischemia/reperfusion injury; inflammatory response; Toll-like receptor 4
温州市公益性科技计划项目资助(Y20140652,2014S0045)
2015-05-22
2015-12-21
R363
A
1000-6834(2016)04-356-06
△【通讯作者】Tel: 0577-86689817; E-mail: wwt@wzmc.edu.cn

