肝功能Child B级肝癌患者射频消融术后应用人血白蛋白的效果观察
李宏,高建龙,朱能,胡建华,张新华
(湖北省肿瘤医院,武汉430079)
肝功能Child B级肝癌患者射频消融术后应用人血白蛋白的效果观察
李宏,高建龙,朱能,胡建华,张新华
(湖北省肿瘤医院,武汉430079)
目的 观察经射频消融术治疗的肝功能Child B级肝癌者术后应用白蛋白的效果。方法 选择经射频消融术治疗的肝功能Child B级肝癌患者41例,随机分为观察组21例及对照组20例,两组均行射频消融术治疗,观察组术后当天及第1、2天给予20%人血白蛋白10 g静脉滴注,1次/d,对照组术后不补充白蛋白。比较两组术前及术后第1、3、5天ALT、AST、血清白蛋白水平;比较两组围术期并发症发生情况及住院时间。结果 术后观察组未出现严重并发症,均顺利出院,术后住院时间(8.29±0.88)d;对照组出现不同程度腹水10例,住院时间(10.6±2.35)d;两组住院时间比较,P<0.05。手术前后两组间ALT、AST比较,P均>0.05;术前及术后第1天血清白蛋白水平比较,P均>0.05;术后第3、5天两组血清白蛋白水比较,P均<0.05。结论 经射频消融术治疗的肝功能Child B级肝癌者术后应用白蛋白可明显提高其血清白蛋白水平,降低腹水发生的风险,且对肝功能恢复无影响。
肝肿瘤;射频消融术;白蛋白;肝功能;Child B级;腹水
人血白蛋白是一种带负电荷的血清蛋白,相对分子质量66.5,主要在肝细胞内合成[1],其对维护血浆渗透压起重要作用。我国70%的原发性肝癌在肝硬化基础上发生。研究发现,肝硬化患者白蛋白的合成及功能均较正常人差[2,3],易发生低蛋白血症,导致腹水。手术及射频消融术治疗均为肝癌根治性治疗方式[4,5],因射频消融术治疗腹部创伤小,属微创,越来越多的患者选择其替代手术治疗。但关于射频消融术治疗对于肝脏合成白蛋白功能的影响,术后因低蛋白血症出现腹水等并发症的情况少有研究。本研究对经射频消融术治疗的肝功能Child B级肝癌者术后应用白蛋白效果进行观察。
1 资料与方法
1.1 临床资料 2011年3月~2014年3月本院收治的肝癌患者41例,男36例、女5例;血清白蛋白水平>30 g/L 39例,≤30 g/L 2例,且存在少量腹水,经术前补充白蛋白、护肝、利尿治疗后腹水消退并保持稳定。入选标准:经病理检查确诊为原发性肝癌;肝功能经Child-Pugh分级评估为Child B级;巴塞罗那肝癌分期A期;肿瘤直径<5 cm;均无肝性脑病。将患者随机分为观察组21例与对照组20例,两组临床资料比较具有可比性。
1.2 治疗方法 两组均在连续硬膜外麻醉下行肝癌射频消融术治疗,术后给予护肝、抑酸等辅助治疗,药物及剂量一致。另外,观察组术后当天及第1、2天给予20%人血白蛋白(武汉生物制品研究所)10 g同护肝药物一起静脉滴注,1次/d。术后第7天,对照组血清白蛋白<25 g/L或出现腹水、腹水仍呈增加趋势等,予以静脉补充白蛋白治疗。
1.3 指标观察 两组术前及术后第1、3、5天检测肝脏转氨酶(ALT、AST)、血清白蛋白;记录两组围术期并发症发生情况及住院时间。
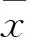
2 结果
术后观察组未出现任何严重并发症,均顺利出院,术后住院时间(8.29±0.88)d;对照组出现不同程度腹水10例,术后第7天给予补充白蛋白、利尿剂等对症治疗,经治疗后待腹水消退后出院,住院时间(10.6±2.35)d;两组住院时间比较,P<0.05。两组术前及术后第1、3、5天ALT、AST、血清白蛋白水平比较见表1。
3 讨论

表1 两组治疗前后ALT、AST、血清白蛋白水平比较
注:与同组术前比较,*P<0.05;与对照组同时间点比较,#P<0.05。
血清白蛋白主要在肝脏内合成,其主要功能是维持人体胶体渗透压、抗氧化及稳定内皮细胞。肝脏一般每天产生10~15 g白蛋白,在机体需求增加时,白蛋白合成量可增加至3~4倍[6]。研究发现,肝硬化患者肝脏白蛋白合成明显减少且合成的白蛋白功能明显异常,无法正常维持胶体渗透压[7,8]。当肝脏经历有创治疗后,其血浆白蛋白量会进一步下降[9,10]。当血浆白蛋白量降至无法维持正常胶体渗透压时,继而产生腹水。白蛋白等生物制品存在受污染而引起疾病传播的风险,且其价格昂贵,对于血清白蛋白水平正常的患者使用白蛋白可能增加肾脏负担。如能根据手术创伤、患者肝功代偿等具体情况确定术后是否需使用白蛋白,不仅可加速患者术后恢复,而且可节约医疗资源。
Child-Pugh评分一直被认为是肝功能分级的金标准[11],主要用于评估肝切除患者的预后,Child-Pugh评分A级患者肝功能储备能力较好,对于创伤耐受力高,恢复能力强;B级患者肝脏储备功能较A级患者差,对于创伤耐受力较弱,恢复能力较A级差。目前已有研究证实,对肝功能Child A级患者术后可不必补充白蛋白[9],但对于肝功能Child B级肝癌患者,射频消融术后是否需补充白蛋白国际上尚无统一标准,相关研究较少。
射频消融术以创伤小、安全性高、可重复应用、可凝固灭活肿瘤等优点在肝癌治疗中的重要性日益凸显,其与手术、肝移植同为肝癌治疗的重要手段之一[12~14]。越来越多的早期肝癌患者选用射频消融术治疗。一般认为射频消融术治疗对患者创伤小,对肝脏的损伤较肝切除术小,但即使较小创伤亦可导致部分患者术后出现血清白蛋白下降、肝功能失代偿、住院时间延长等情况。本研究结果显示,术前及术后第1天两组血清白蛋白比较差异无统计学意义,但第3、5天比较差异有统计学意义,表明射频消融术后血清白蛋白水平下降,主要因为手术、创伤所致肝合成白蛋白功能下降、白蛋白分解增多。观察组通过补充外源性白蛋白可纠正术后低蛋白血症。但有研究认为,肝切除术后血管通透性增加及白蛋白渗漏等因素为术后白蛋白下降的主要影响因素,因此认为即使补充白蛋白亦难以有效提升血清白蛋白水平[15],该结果与本研究结果并不一致。原因可能为肝切除术所造成创伤较大,导致全身应激系统激活,全身炎症反应使蛋白合成受到持续性抑制;其次,全身反应会引起血管通透性增高,血清白蛋白丢失增多[16~19]。相较于传统手术,射频消融术治疗对机体创伤较小,白蛋白合成时间短,血管通透性增高所致白蛋白丢失少,这是射频消融术的优势之一;另一方面,射频消融术后患者恢复快,术后可早期恢复进食,肝切除术对于患者损伤较大,进食恢复时间晚。相关研究证实,术后早期进食者较肠外营养者血清白蛋白水平更高,且升高更为迅速[20],这亦是射频消融术的第二个优势,亦是本研究与肝切除术后白蛋白相关研究结果不同的原因之一。
本研究结果显示,对照组中有10例患者术后出现不同程度腹水,而观察组无一例出现术后腹水并。表明腹水的出现与低蛋白血症存在密切关系,故认为创伤所致低蛋白血症是引起腹水的主要因素之一。该结果证实,术后及时补充白蛋白能有效预防因低蛋白血症所致腹水的发生。而补充外源性白蛋白后,两组术后第5天肝功能指标无统计学差异。对照组因出现了低蛋白血症继而出现腹腔积液的并发症,进而需继续住院治疗,而使得住院时间较观察组明显延长。表明补充白蛋白并未对患者造成明显不良反应,同时能缩短患者住院时间。
综上所述,对肝功能Child B级肝癌患者经射频消融术治疗后补充20%外源性人血白蛋白可有效改善术后低蛋白血症的发生,显著降低术后腹腔积液并发症,并明显缩短患者住院时间。但对照组中仍有部分患者术后血清白蛋白轻度下降,未出现腹腔积液并发症,说明单一依靠Child分级可能无法完全预测射频消融术后肝脏合成白蛋白合成功能的变化,可能还需要结合吲哚青绿试验以及其他指标共同判断,以求更准确预测术后患者是否需补充白蛋白,进行更有针对性的治疗。尽量减少患者使用白蛋白可能产生的风险,降低患者治疗费用。
[1] He XM, Carter DC. Atomic structure and chemistry of human serum albumin[J]. Nature, 1992,358(6383):209-215.
[2] Mauro B, Carmen SR, Giacomo Z. Role of human albumin in the management of complications of liver cirrhosis[J]. Clin Exp Hepatol, 2014,4(4):302-311.
[3] Quinlan GJ, Martin GS, Evans TW. Albumin: biochemical properties and therapeutic potential[J]. Hepatology, 2005,41(6):1211-1219.
[4] 秦叔逵,樊嘉,沈峰.原发性肝癌诊疗规范(2011年版)[J].临床肝胆病杂志,2011,27(11):1141-1159.
[5] Feng K. Ma KS. Value of radiofrequency ablation in the treatment of hepatocellular carcinoma[J]. World J Gastroenteml, 2014,20(20):5987-5998.
[6] Quinlan GJ, Martin GS, Evans TW. Albumin: biochemical properties and therapeutic potential[J]. Hepatology, 2005,41(16):1211-1219.
[7] Garcia-Martinez R, Caraceni P, Bernardi M, et al. Albumin: pathophysiologic basis of its role in the treatment of cirrhosis and its complications[J]. Hepatology, 2013,58(5):1836-1846.
[8] Arroyo V, Fernandez J. Pathophysiological basis of albumin use in cirrhosis[J]. Ann Hepatol, 2011,10(Suppl 1):S6-S14.
[9] 李权林,李敬东,徐威,等.肝癌肝切除术后持续低蛋白血症的相关因素分析[J].中华消化外科杂志,2012,11(2):151-154.
[10] 邓侠兴,沈柏用,吕文杰,等.百特5%及25%人血白蛋白在肝脏、胰腺手术围手术期应用的疗效和安全性[J].中华肝胆外科杂志,2009,15(3):192-195.
[11] 任贵兵,钱崇宽,赵端仪,等.D-山梨醇清除法补充吲哚氰绿潴留率和Child-pugh分级评估肝储备功能[J].中国普外基础与临床杂志,2008,15(4):271-273.
[12] Kudo M, Okanoue T. Management of hepatocellular carcinoma in Japan: consensus-based clinical practice manual proposed by the Japan Society of Hepatology[J]. Oncology, 2007,72(Suppl 1):2-15.
[13] Gong CG, Wang B, Zhan Q, et al. Analysis of incidence and influencing factors of systemic inflammatory response syndrome afterhepatectomy[J]. J Pharm Pract, 2012,30(5):361-364.
[14] Villanueva A, Hemandez-Gea V, Llovet JM. Medical therapies for hepatocellular carcinoma:a critical view of the evidence[J]. Nat Rev Gastmenteml Hepatol, 2013,10(1):34-42.
[15] 毛一雷,桑新亭,黄洁夫,等.肝脏手术后病人白蛋白临床应用研究[J].中国实用外科杂志,2007,27(8):616-618.
[16] Li QL, Li JD, Xu W, et al. Factors related to continual hypopro-teinemia after hepatectomy for patients with hepatocellular carcinoma[J]. Chin J Digest Surg, 2012,11(2):151-154.
[17] Mendez CM, McClain CJ, Mamano LS. Albumin therapy in clinical practice[J]. Nutr Clin Praet, 2005,20(3): 314-320.
[18] Burroughs AK. Is the use of albumin of value in cirrhosis? The case is not so favour, or is there an alternative[J]. Dig Liver Dis, 2003,35(9):664-667.
[19] Moreau R, Valla DC, Durand-Zaleski I, et al. Comparison of out-come in patients with cirrhosis and ascites following treatment with albumin or a synthetic colloid: a randomised controlled pilot trail[J]. Liver Int, 2006,26(1):46-54.
[20] 商昌珍,张磊,余达成,等.术后早期肠内营养在肝细胞肝癌半肝切除患者中的应用价值[J].中华肝脏外科手术学,2013,2(5):298-301.
武汉市药学会生物药物学基金项目(201502004)。
张新华(E-mail:relaxing2008@163.com)
10.3969/j.issn.1002-266X.2016.37.022
R735.7
B
1002-266X(2016)37-0066-03
2016-06-10)

