SOCS1基因沉默对人膀胱癌T24细胞增殖、侵袭及化疗敏感性的影响
闫骏,朱小军,斯钦布和,王国强,陈利刚,黄勇
(内蒙古医科大学附属医院,呼和浩特010050)
SOCS1基因沉默对人膀胱癌T24细胞增殖、侵袭及化疗敏感性的影响
闫骏,朱小军,斯钦布和,王国强,陈利刚,黄勇
(内蒙古医科大学附属医院,呼和浩特010050)
目的 探讨细胞因子信号转导抑制因子1(SOCS1)基因沉默对人膀胱癌细胞增殖、侵袭及化疗敏感性的影响。方法 将培养好的人膀胱癌T24细胞随机分为三组,用Lipo2000将重组质粒pU-SOCS1-siRNA(沉默SOCS1基因)、阴性对照质粒分别转染至干扰组、对照组,空白组不做任何处理。基因沉默后,用RT-PCR技术检测细胞中SOCS1 mRNA表达;Western blotting法检测细胞中SOCS1蛋白表达;MTT法检测细胞增殖率;流式细胞术检测细胞周期及化疗药物诱导的细胞凋亡率;Transwell小室模型检测细胞侵袭能力;MTT法检测细胞化疗敏感性。结果 与其他两组比较,干扰组SOCS1基因沉默后SOCS1 mRNA和蛋白表达降低(P均<0.05);细胞增殖率降低(P均<0.05);G0/G1期细胞增多,S、G2/M期细胞减少(P均<0.05);吉西他滨诱导的细胞凋亡率升高(P<0.05);体外侵袭能力减弱(P均<0.05);对化疗药物卡铂和吉西他滨的敏感性增强(P均<0.05)。结论 SOCS1基因沉默后,人膀胱癌细胞T24的增殖、体外侵袭能力下降,化疗敏感性增强。
膀胱肿瘤;细胞因子信号转导抑制因子1;基因沉默;细胞增殖;细胞侵袭;化疗敏感性
细胞因子信号转导抑制因子1(SOCS1)在肿瘤中既可作为原癌基因也可作为肿瘤抑制因子发挥作用。研究表明,SOCS1可抑制人胃癌细胞的生长及腹膜种植转移[1];SOCS1过表达可阻止癌细胞转移及使其侵袭能力减弱[2];SOCS1过表达还可通过抑制Janus激酶信号转导/转录激活因子(JAK-STAT)通路和激活p53信号通路负性调控恶性黑色素瘤细胞的增殖,促进体内外细胞凋亡,使细胞周期阻滞在S期[3]。但另有研究证实,沉默SOCS1表达能抑制肿瘤细胞增殖,并阻止肿瘤恶性转化的发生[4]。miR-572通过抑制SOCS1基因表达,促进人卵巢癌细胞增殖和细胞周期进展[5]。SOCS1在肿瘤发生中的作用机制目前存在争议,甚至在同种肿瘤不同细胞系中作用也可能不一致,推测SOCS1的作用可能与肿瘤类型、细胞种类等有关。为明确SOCS1在膀胱癌发生发展中的作用,2015年2~12月,本研究将人膀胱癌细胞株T24中SOCS1基因沉默后,观察细胞增殖、侵袭及化疗敏感性的变化。
1 材料与方法
1.1 主要试剂与仪器 人膀胱癌细胞株T24(中国典型培养物保藏中心),10%胎牛血清、DMEM培养基(美国,Gibco),RT-PCR试剂盒、2×Taq PCR MasterMix PCR扩增试剂(日本,TaKaRa),pSilencerTM2.1-U6neo质粒(美国,Ambion),核酸内切酶(美国,NEB),卡铂、吉西他滨、SOCS1抗体(美国,Sigma),Lipo2000、BLOCK-iTTMU6 RNAi Entry Vector 试剂盒(美国,Invitrogen),β-actin抗体(武汉,博士德),羊抗兔二抗、羊抗鼠二抗(南京,碧云天),细胞裂解液、MTT甲基噻唑基四唑(江苏,凯基生物),BCA蛋白浓度检测试剂盒、预染蛋白Marker(美国,Thermo Fisher Scientific),引物(上海生工公司)。流式细胞仪(美国,BD),梯度PCR仪(美国,Applied Biosystems 9700)。
1.2 SOCS1基因沉默及细胞分组 SOCS1干扰片段设计参考文献[6]。SOCS1-siRNA寡核苷酸片段退火形成双链DNA后,与pSilencerTM2.1/U6neo载体连接,构建pU-SOCS1-siRNA真核表达载体。取对数期T24细胞种植于六孔板,培养12 h,细胞融合度为40%~50%备用。将培养好的T24细胞随机分为三组,采用Lipo2000严格按照说明书进行转染。干扰组转染重组质粒pU-SOCS1-siRNA沉默SOCS1基因,阴性对照组转染阴性对照质粒,空白组不做任何处理。转染6 h,换含10%胎牛血清的DMEM高糖培养液,继续培养。
1.3 细胞内SOCS1 mRNA表达检测 采用RT-PCR技术。基因沉默后48 h收集细胞,六孔板每孔添加适量TRIzol和氯仿,移液器吹打,提取总RNA,去基因组后检测RNA纯度,纯度合格且无蛋白质污染,用MMLV逆转录酶进行逆转录。GAPDH上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物:5′-GAAGATGGTGATGGGATTTC-3′;SOCS1上游引物:5′-ATGCAGTCTCCACAGCAGCAGAG-3′,下游引物:5′-CGAACGGAATGTGCGGAAGTG-3′。逆转录成cDNA后,进行定量分析。反应条件:预变性95 ℃、5 min,变性94 ℃、30 s,SOCS1退火60 ℃、30 s(内参GAPDH退火55 ℃、30 s),延伸72 ℃、1 min,40个循环,72 ℃、6 min。PCR产物进行琼脂糖凝胶电泳,紫外灯下观察DNA条带,凝胶成像系统拍照保存。ΔCt=目的基因Ct-内参Ct;ΔΔCt=待测样品中目的基因ΔCt-参照样品中目的基因ΔCt;基因相对表达量=2-ΔΔCt。
1.4 细胞内SOCS1蛋白表达检测 采用Western blotting法。基因沉默后48 h收集细胞,冰上加裂解液充分裂解细胞,离心收集上清液,使用BCA法测定样品蛋白浓度,分装成50 μg/管,加上样缓冲液高温变性,样品经SDS-PAGE电泳后电转移至PVDF膜,TBST配制的5%脱脂奶粉常温封闭1~2 h,TBST洗膜3次后孵育一抗,SOCS1稀释比例为1∶1 000,β-actin稀释比例为1∶2 000,一抗4 ℃摇床孵育过夜,TBST洗膜3次后孵育对应的HRP标记的羊抗小鼠或羊抗兔二抗,稀释比例为1∶5 000,常温孵育2 h;TBST洗膜后暗室添加适量ECL试剂后压片、显影、定影,胶片扫描后蛋白条带用Image J软件进行灰度分析,得到各蛋白条带灰度值。蛋白相对表达量=待测样品中目标蛋白灰度值/参照样品中目标蛋白灰度值。
1.5 细胞增殖率检测 采用MTT法。分别于基因沉默后12、24、48、72、96 h收集细胞,各组均设置3个复孔,添加MTT溶液,继续培养5 h,弃MTT溶液,加DMSO后采用酶标仪于波长490 nm处测光密度值(OD值),细胞增殖率=(实验组OD490值-对照组OD490值)/对照组OD490值×100%。
1.6 细胞周期与凋亡检测 采用流式细胞术。细胞周期:基因沉默后48 h,收集细胞,用-20 ℃预冷的70 %冰乙醇固定,于4 ℃冰箱过夜,冰乙醇用DEPC水配制,碘化丙啶染色0.5 h,直接上机检测,计数各周期细胞百分比。细胞凋亡:各组细胞于转染前8 h添加化疗药物吉西他滨,终浓度6 nmol/L,转染后48 h收集细胞,加入Annexin Ⅴ及缓冲液5 μL将其制成细胞数约1×109/L悬液,避光反应30 min,然后加入PI 10 μL流式上机检测,计算细胞凋亡率。
1.7 细胞侵袭能力测定 采用Transwell侵袭小室试验。转染后48 h,取0.5 g/L Matrigel人工基质胶20 μL均匀涂抹于孔径为8 μm的Transwell侵袭小室微孔膜表面,37 ℃放置30 min,待其聚成凝胶状。各组均取转染后48 h的细胞1.0×107个分别接种于Transwell微孔膜上层,下层添加条件培养基0.6 mL,继续在CO2细胞培养箱中培养24 h,培养结束后PBS洗涤,使用棉签轻轻抹去微孔膜表面未侵入膜的细胞,微孔膜常温干燥0.5 h后吉姆萨染色,在显微镜下随机计数5个视野中穿膜细胞数,取平均值。
1.8 细胞化疗敏感性检测 采用MTT法。基因沉默后48 h收集细胞,种植于96孔板。按照分组分别添加不同浓度的卡铂(0、5、10、20、30、40 mg/L)和吉西他滨(0、5、10、20、40、80 nmol/L),三组各浓度均设置3个复孔,作用48 h添加MTT溶液,继续培养5 h,弃MTT溶液,加DMSO后用酶标仪于波长490 nm处测OD值,根据OD值绘制细胞生长曲线图,采用GraphPad Prism软件计算半数抑制浓度(IC50)。
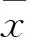
2 结果
2.1 SOCS1基因沉默后细胞内SOCS1 mRNA及蛋白表达比较 基因沉默后48 h,空白组SOCS1 mRNA及蛋白相对表达量分别为1.00±0.08、1.00±0.12,阴性对照组分别为0.94±0.11、1.05±0.16,干扰组分别为0.22±0.03、0.13±0.06;与其他两组比较,干扰组SOCS1 mRNA及蛋白相对表达量降低(P均<0.05)。
2.2 SOCS1基因沉默对细胞增殖率的影响 三组增殖率比较见表1。
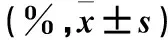
表1 三组增殖率比较
注:与干扰组同时间点比较,*P<0.05。
2.3 SOCS1基因沉默对细胞周期的影响 见表2。

表2 三组各周期细胞分布比较±s)
注:与干扰组比较,*P<0.05。
2.4 SOCS1基因沉默对吉西他滨诱导的细胞凋亡的影响 空白组、阴性对照组、干扰组经吉西他滨处理后凋亡率分别为(34.3±3.6)%、(32.9±4.2)%、(46.1±3.5)%,与其他两组比较,干扰组细胞凋亡率升高(P均<0.05)。
2.5 SOCS1基因沉默对细胞侵袭能力的影响 基因沉默后24 h,空白组、阴性对照组、干扰组穿膜细胞数分别为(93±16)、(87±19)、(39±8)个,与其他两组比较,干扰组穿膜细胞数减少(P均<0.05)。
2.6 SOCS1基因沉默对细胞化疗敏感性的影响 SOCS1基因沉默后48 h,空白组对卡铂、吉西他滨的IC50分别为(15.34±1.32)mg/L、(20.32±2.51)nmol/L,阴性对照组分别为(14.62±1.57)mg/L、(20.73±2.48)nmol/L,干扰组分别为(9.83±1.05)mg/L、(11.28±1.46)nmol/L;与其他两组比较,干扰组对卡铂、吉西他滨的IC50减小(P均<0.05)。
3 讨论
SOCS1是细胞因子信号转导抑制因子蛋白家族的重要成员。近年来随着对SOCS1研究的深入,其各种功能逐渐被发现。SOCS1参与体内多种免疫反应、激素的调节以及多种肿瘤的生成和发展等,尤其是它与肿瘤的关系成为近期研究的热点。SOCS1是固有免疫和获得性免疫的重要生理性调节因子,能够调节淋巴细胞的激活、发育和分化,使人γ-干扰素等炎症因子的分泌减少,起到炎症抑制作用;还可通过JAK-STAT信号通路作用于T淋巴细胞、树突细胞和单核-巨噬细胞,参与癌症、动脉粥样硬化等疾病的发生发展。SOCS1的表达与肿瘤细胞增殖、周期及侵袭能力等的调节有关。研究报道,SOCS1过表达可通过JAK/STAT3、p53信号通路负性调控人黑色素瘤细胞的增殖活性[3]。人舌鳞癌细胞CAL27中基因SOCS1沉默后,细胞增殖能力减弱,使细胞周期阻滞在G0/G1期[7]。miR-155抑制SOCS1表达激活STAT3信号通路,阻止胰腺癌细胞转移,并减弱其侵袭能力[8]。本研究表明,T24细胞SOCS1基因沉默后,细胞增殖能力和体外侵袭能力受到抑制;还影响细胞周期,细胞有丝分裂受到抑制,S期细胞明显减少,G0/G1期细胞显著增多,与上述文献报道一致。
Zhang等[5]研究指出,miR-572过表达,下调SOCS1,使人卵巢癌细胞G0/G1期细胞明显减少,而S期细胞显著增多;相反,当抑制miR-572表达时,SOCS1表达上调,人卵巢癌细胞G0/G1期细胞明显增多变大,而S期细胞显著减少,与本研究SOCS1沉默后增加人膀胱癌G0/G1期细胞数目及减少S、G2/M期细胞数目等结论相反,推测原因可能为SOCS1在肿瘤中的作用与肿瘤类型相关。而另有研究结果显示,SOCS1可使人胃癌细胞周期阻滞在G2/M期,并使G0/G1期细胞数目增多[1]。SOCS1过表达显著减弱宫颈癌的侵袭和转移能力,促进细胞凋亡,SOCS1表达还明显抑制结直肠癌细胞的体外侵袭和体内转移能力[9]。与本研究中SOCS1沉默增加人膀胱癌细胞侵袭能力及增加凋亡细胞数目等结论相反,推测原因同样是SOCS1在肿瘤中作用因细胞种类不同所致。
SOCS1高表达可影响细胞对多种细胞因子的敏感性,在IFN-γ敏感性降低的过程中可能发挥着重要作用。研究表明,人胰腺癌细胞株PANC1中SOCS1表达被抑制后,增殖能力下降,并增强细胞对IFN-γ的敏感性[4]。人舌鳞癌细胞SOCS1沉默,显著降低化疗药物卡铂和紫杉醇对癌细胞的IC50,提高细胞对化疗药物的敏感性[7]。本研究结果显示,沉默T24细胞SOCS1的表达,可增加T24细胞对化疗药物卡铂和吉西他滨的敏感性,并提高化疗药物诱导的细胞凋亡率,说明干扰SOCS1表达可能成为未来人膀胱癌临床治疗和药物干预的靶标。研究表明,SOCS1干扰显著抑制人黑色素瘤细胞Mel526的生长,S期细胞减少,增强肿瘤细胞对γ-干扰素的敏感性,且对奥沙利铂化疗药物的IC50值明显变小[10],与本研究结果一致。
综上所述,人膀胱癌T24细胞SOCS1基因沉默后显著抑制细胞的增殖和体外侵袭,并增强其对化疗药物的敏感性,提示基因SOCS1可能是影响人膀胱癌治疗效果的重要靶点。SOCS1可以作为一种肿瘤标记物,来判断肿瘤的恶性程度、分期,甚至是否有远处转移等。但是因为大部分肿瘤都有SOCS1的改变,故特异性较差,可只应用于已明确诊断的肿瘤,或者用于判断预后。目前,SOCS1在肿瘤治疗方面虽初见成效,但仍需要通过大量的动物实验和临床研究来证实SOCS1在肿瘤治疗方面的机制和作用。
[1] Natatsuka R, Takahashi T, Serada S, et al. Gene therapy with SOCS1 for gastric cancer induces G2/M arrest and has an antitumour effect on peritoneal carcinomatosis[J]. Br J Cancer, 2015,113(3):433-442.
[2] Scutti JA, Matsuo AL, Pereira FV, et al. Role of SOCS-1 gene on melanoma cell growth and tumor development[J]. Transl Oncol, 2011,4(2):101-109.
[3] Tagami-Nagata N, Serada S, Fujimoto M, et al. Suppressor of cytokine signaling-1 induces significant preclinical antitumor effect in malignant melanoma cells[J]. Exp Dermatol, 2015,24(11):864-871.
[4] 吕清林,王娟,陈黎萍.SOCS1 基因沉默对人胰腺癌细胞增殖和干扰素-γ敏感性的影响[J].天津医药,2014,42(9):863-866.
[5] Zhang X, Liu J, Zang D, et al. Upregulation of miR-572 transcriptionally suppresses SOCS1 and p21 and contributes to human ovarian cancer progression[J]. Oncotarget, 2015,6(17):15180-15193.
[6] Lesinski GB, Zimmerer JM, Kreiner M, et al. Modulation of SOCS protein expression influences the interferon responsiveness of human melanoma cells[J]. BMC Cancer, 2010(10):142.
[7] 马壮,张胜,朱郁文,等.人舌鳞癌细胞 SOCS1 基因沉默对细胞增殖和化疗药物敏感性的影响[J].口腔医学研究,2015,31(3):283-286.
[8] Huang C, Li H, Wu W, et al. Regulation of miR-155 affects pancreatic cancer cell invasiveness and migration by modulating the STAT3 signaling pathway through SOCS1[J]. Oncol Rep, 2013,30(3):1223-1230.
[9] David M, Naudin C, Letourneur M, et al. Suppressor of cytokine signaling 1 modulates invasion and metastatic potential of colorectal cancer cells[J]. Mol Oncol, 2014,8(5):942-955.
[10] Xu Y, Wang W, Gou A, et al. Effects of suppressor of cytokine signaling 1 silencing on human melanoma cell proliferation and interferon γ sensitivity[J]. Mol Med Rep, 2015,11(1):583-588.
Effects of silencing SOCS1 gene on proliferation, invasion and chemosensitivity of human bladder cancer T24 cells
YANJun,ZHUXiaojun,SIQinbuhe,WANGGuoqiang,CHENLigang,HUANGYong
(TheAffiliatedHospitalofInnerMongoliaMedicalUniversity,Hohhot010050,China)
Objective To investigate the effects of suppressor of cytokine signaling-1 (SOCS1) gene silencing on cell proliferation, invasion and chemotherapeutic drugs sensitivity of human bladder cancer cells.Methods Human bladder cancer cell line T24 cells were randomly divided into three groups: the interference group (which was transfected by recombinant plasmid pU-SOCS1-siRNA), control group (which was transfected by negative control plasmid) and blank group without any treatment. RT-PCR and Western blotting were used to detect the SOCS1 mRNA and protein expression in human bladder cancer cell line (T24) after transfection. The cell proliferation rate was detected by MTT assay, flow cytometry was used to detect the cell cycle and cell apoptosis rate; the invasive ability of T24 cells in vitro was evaluated by Transwell migration assay and the change of chemosensitivity was determined by MTT. Results Compared with the other groups, after silencing SOCS1 in the interference group, the expression levels of SOCS1 mRNA and protein were significantly decreased (allP<0.05), and the cell proliferation rate was decreased significantly (allP<0.05); the cells at the G0/G1phase increased, but the cells in S phase and G2/M decreased (allP<0.05); the cell apoptosis rate of gemcitabine-induced T24 cells significantly increased after SOCS1 gene silencing (P<0.05) and the invasive ability of T24 cells in vitro was decreased (allP<0.05); and the sensibility to chemotherapeutic drugs (carboplatin and gemcitabine) increased significantly (allP<0.05). Conclusion After SOCS1 gene silencing, the proliferation ability and invasion ability in vitro of human bladder cancer cell line T24 decrease and the sensitivity of T24 cells to chemotherapeutic drugs increases.
human bladder neoplasms; suppressor of cytokine signaling protein 1; gene silencing; cell proliferation; cell invasion; chemosensitivity
R737.14
A
1002-266X(2016)37-0021-04
闫骏(1972-),男,副主任医师,硕士,主要研究方向为泌尿系统肿瘤。E-mail:147206358@qq.com
简介:黄勇(1970-),男,主任医师,硕士,主要研究方向为泌尿系统肿瘤。E-mail:swjs231@163.com
10.3969/j.issn.1002-266X.2016.37.007
2016-03-13)

