缺血后处理对高脂血症大鼠脑缺血再灌注后脑组织TNF-ɑ和SOCS-3表达的影响
唐娟,王德芳,徐艳,唐兴江
(西南医科大学附属医院,四川泸州646000)
缺血后处理对高脂血症大鼠脑缺血再灌注后脑组织TNF-ɑ和SOCS-3表达的影响
唐娟,王德芳,徐艳,唐兴江
(西南医科大学附属医院,四川泸州646000)
目的 观察缺血后处理(IPO)对高脂血症大鼠局灶性脑缺血再灌注(I/R)损伤后脑组织肿瘤坏死因子ɑ(TNF-ɑ)和细胞因子信号转导抑制因子3(SOCS-3)表达的影响。方法 选择成年健康雄性SD大鼠105只,制作高脂血症模型后随机分为假手术组(sham组)、I/R组和IPO组各35只。采用改良线栓法制作局灶性脑I/R模型(I/R组);再灌注前采用灌注15 s、闭塞15 s,重复3次的形式制作IPO模型(IPO组)。分别于7个时间点(造模后3、6、12、24、48、72 h及7 d)每组各取5只大鼠处死取脑组织,用HE染色法观察各组脑组织病理形态改变,免疫组化法测定脑组织TNF-ɑ、SOCS-3的表达。结果 sham组脑组织无病理损伤改变,IPO组脑组织病理损伤较I/R组减轻。I/R组脑组织TNF-ɑ、SOCS-3表达于造模后3 h升高,24 h达到峰值,随后各时间点表达量逐渐下降,于7 d时仍有少量表达。IPO组各时间点脑组织TNF-ɑ、SOCS-3表达趋势与I/R组相同,但于造模后6、12、24、48、72 h时TNF-ɑ表达较I/R组降低(P均<0.05),SOCS-3表达较I/R组升高(P均<0.05),且各时间点IPO组、I/R组脑组织TNF-ɑ、SOCS-3表达均高于sham组(P均<0.05)。结论 IPO能抑制高脂血症大鼠局灶性脑I/R损伤后脑组织TNF-ɑ的表达、上调SOCS-3的表达。
脑缺血;再灌注损伤;高脂血症;缺血后处理;肿瘤坏死因子ɑ;细胞因子信号转导抑制因子3;大鼠
近年来,随着人们饮食结构的改变,特别是高脂饮食的过多摄入,高脂血症发病率不断上升,成为心脑血管疾病发生的主要危险因素,严重威胁人们身体健康。尽快恢复脑血流是减轻脑缺血的重要措施,但缺血再灌注(I/R)使脑组织产生不同程度的损伤。因此,寻求有效的脑保护方法以减轻I/R损伤成为临床研究热点。Zhao等[1]对心肌I/R犬模型的研究发现,采用反复多次间断性再灌注的方法能够缩小心肌梗死面积,改善心功能,首次提出了缺血后处理(IPO)的概念。但以高脂血症为基础的局灶性脑缺血大鼠模型来探讨IPO的作用罕见报道。2015年10月~2016年3月,本研究探讨IPO对高脂血症大鼠局灶性脑I/R损伤后脑组织肿瘤坏死因子ɑ(TNF-ɑ)和细胞因子信号转导抑制因子3(SOCS-3)表达的影响,为进一步探究IPO对脑保护作用的可能机制提供参考。
1 材料与方法
1.1 动物分组、试剂及仪器 健康成年雄性SD大鼠105只,体质量160~180 g,由西南医科大学实验动物中心提供。参考吴栩等[2]的高脂饲料配方进行饲养,制备高脂血症模型。将105只高脂血症大鼠随机分为假手术组(sham组)、I/R组、IPO组各35只。TC试剂盒、TG试剂盒、LDL-C试剂盒和HDL-C试剂盒[贝克曼库尔特实验系统(苏州)有限公司];兔抗大鼠TNF-ɑ多克隆抗体(美国Bioworld公司);兔抗大鼠SOCS-3多克隆抗体(美国Bioworld公司);DAB显色剂(杭州赫贝科技有限公司)。全自动生化分析仪(日本Hitachi公司);Leica DM 2500显微镜(德国Leica公司)。
1.2 IPO模型制备 用10%水合氯醛对大鼠行腹腔麻醉,麻醉成功,大鼠取仰卧位,将其头部和四肢固定于解剖台上,充分暴露颈部组织。sham组仅单纯暴露右侧颈总、颈内、颈外动脉;I/R组采用Longa等[3]的改良线栓法制作右侧大脑中动脉栓模型,缺血90 min拔出线栓实施再灌注;IPO组参照孙静等[4]的造模方法,即缺血90 min后,在实施再灌注前,将线栓拔出5 mm,维持15 s灌注后再将线栓插入维持15 s,如此反复3次。造模后根据Longa等[3]的评分原则对各组神经功能缺失情况进行评价,将无神经功能缺失症状体征、开颅后出现蛛网膜下腔出血、未完成实验即死亡的大鼠予以剔除,后续补入。分别于造模后3、6、12、24、48、72 h及7 d每组各取5只大鼠予以水合氯醛麻醉,迅速断头取脑组织,并去除低位脑干和小脑。将所取脑组织置于4%的多聚甲醛中固定,石蜡包埋,从视交叉后方连续冠状位切片(厚3 μm),4 ℃保存备用。
1.3 大鼠脑组织形态学观察 采用HE染色法。将备用切片予以二甲苯脱蜡,梯度浓度乙醇至水,苏木素-伊红染色,中性树胶封片。光镜下找到梗死灶一侧,400倍高倍镜下观察梗死灶及其周围组织的病理改变。
1.4 大鼠脑组织中TNF-ɑ、SOCS-3表达检测 采用Envision法,具体步骤参照说明书。低倍镜下于每张切片梗死灶周围选取4个不同象限视野进行观察,于400倍高倍镜下分别选取5个不连续视野进行阳性细胞计数,TNF-ɑ、SOCS-3表达阳性的细胞表现为细胞核、细胞质呈棕褐色,或其胞质内有棕褐色颗粒。
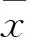
2 结果
2.1 各组脑组织形态学改变 sham组脑组织未见明显病理改变,其神经细胞形态、胞质、胞核等均表现正常,间质无水肿、无炎性细胞浸润等。I/R组于造模后3 h时即观察到脑组织神经细胞轻微的病理损害表现,神经元及神经胶质细胞核固缩,但无明显细胞坏死,部分可见空泡样改变,炎性浸润细胞少见;于造模后12 h时出现较为明显的病理改变;24~48 h时病理改变达到高峰,神经细胞出现典型的病理改变:细胞核固缩(浓染)、变形(呈梭形、新月形、长条形、三角形等)、碎裂甚至溶解,细胞高度水肿,出现空泡样改变(即气球样变性),炎性细胞浸润明显,且主要位于右侧大脑皮质及基底核区;72 h后病变减轻,细胞水肿程度逐渐减轻,炎性细胞浸润逐渐减少。与I/R组比较,IPO组24~72 h脑组织细胞水肿程度减轻、炎性细胞浸润减少。
2.2 各组不同时间点脑组织TNF-ɑ、SOCS-3表达比较 见表1、2。
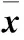
表1 各组不同时间点脑组织TNF-ɑ阳性细胞数比较(个/视野,±s)
注:与前一时间点比较,*P<0.05;与sham组比较,#P<0.05;与I/R组比较,★P<0.05。
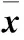
表2 各组不同时间点脑组织SOCS-3阳性细胞数比较(个/视野,±s)
注:与前一时间点比较,*P<0.05;与sham组比较,#P<0.05;与I/R组比较,★P<0.05。
3 讨论
近年来,IPO作为缺血性脑血管疾病的处理措施备受关注。IPO可能通过影响炎症反应、凋亡途径、蛋白激酶B途径等多种途径来减轻I/R损伤[5]。但是对于IPO的方式、时间窗、缺血程度、再灌注/闭塞时间、循环次数等仍备受争议。本研究采用孙静等[4]的最佳IPO方案,并在预实验中观察到在脑缺血90 min时予以反复3次再灌注15 s/缺血15 s的措施能够产生脑保护作用。
目前研究发现,炎症反应是脑I/R损伤的重要机制之一。在脑I/R早期,内皮细胞、神经元、胶质细胞及血管周围的炎性细胞便释放出TNF-ɑ、IL-6、IL-1等大量细胞炎症因子,过度表达的细胞炎症因子可引起脑组织强烈的炎症反应,从而引起脑组织I/R损伤。作为炎症反应的起始因子,TNF-ɑ在脑I/R损伤中发挥着极其重要的作用,可以促进内皮细胞、神经细胞等释放大量炎症因子,促进白细胞和内皮细胞黏附,引起白细胞浸润,激活炎症细胞的级联反应。研究发现,白细胞与TNF-ɑ的表达呈正相关,表明TNF-ɑ与脑缺血的炎症反应有关[6]。细胞炎症因子(TNF-ɑ、IL-6、IL-1等)主要通过JAK/STAT等细胞内信号转导途径发挥脑损伤作用,而SOCS-3可以对JAK/STAT信号转导途径进行负性调控,以减少炎症因子的表达,从而减轻炎症反应,起到脑保护作用[7]。
He等[8]研究发现,TNF-ɑ在大鼠脑I/R 3 h开始表达,并于24 h达到高峰,抑制其活性或减少其表达将会减轻大鼠脑组织损伤程度。Xing等[9]运用局灶性缺血60 min后,反复5次再灌注30 s/缺血30 s的处理方法发现,介导炎症反应的TNF-ɑ、IL-1 mRNA和细胞间黏附因子1的蛋白表达较对照组均明显降低。本研究结果显示,TNF-ɑ在sham组仅见少量表达,在I/R组中于I/R 3 h开始表达上升,6 h明显上升,24 h达高峰。同时,IPO组大鼠TNF-ɑ在I/R 24 h达高峰,72 h时仍维持在较高水平,在6~72 h时,其表达较I/R组均明显降低(P均<0.05),且I/R组和IPO组各时间点TNF-ɑ表达均高于sham组(P均<0.05),与上述文献报道基本相符。可见,IPO可以启动机体相关内源性保护机制,减轻炎症反应,从而减轻脑I/R损伤。但是,本研究炎症因子表达与既往类似研究结果比较,其表达趋势虽然相似,但各时间点的表达量却更高,从而推测高脂血症可能也会影响炎症因子的表达。Bate等[10]应用大鼠局灶性缺血模型发现,在梗死半球一侧,SOCS-3 mRNA表达在I/R 12 h达高峰,24 h时仍维持在较高水平。有研究表明,若抑制脑缺血后SOCS-3的表达,脑梗死体积将明显增加,神经功能损害也明显加重[11];而上调SOCS-3表达,则可明显缩小脑梗死体积[12]。因此,可以推测SOCS-3在缺血性脑损伤中起重要的保护作用。本研究发现,sham组可见极少量SOCS-3表达,I/R组SOCS-3在I/R 3 h开始表达,并于24 h达高峰,至7 d天时仍有少量表达;IPO组在6~72 h时,SOCS-3较I/R组表达升高(P均<0.05),与上述研究表达趋势相似。说明IPO可以上调SOCS-3的表达,并且,其与TNF-ɑ表达变化趋势相同。说明I/R上调TNF-ɑ的表达,引起炎症级联反应的同时,受损脑组织自身也会上调SOCS-3的表达,以抑制炎症因子表达,起到内源性保护作用。因此,IPO在一定程度上能上调SOCS-3的表达,以抑制炎症因子的过度释放,从而减轻脑组织炎性反应,达到脑保护作用。
综上所述,IPO对I/R损伤具有一定保护作用。但不同于既往研究,本研究采用高脂血症大鼠来制作局灶性脑缺血模型,更接近于人体的自然发病过程。但炎症因子表达较既往类似研究表达更高,因此,在高脂血症的基础上给予IPO是否进一步影响了炎症因子及其上调因素的表达有待下一步研究证实。
[1] Zhao ZQ, Corvera JS, Halkos ME, et al. Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning[J]. Am J Physiol Heart Circ Physiol, 2003,285(2):H579-H588.
[2] 吴栩,韦伟标,刘少斌.高脂血症大鼠模型4种造模方法的筛选及优化[J].动物医学进展,2013,34(9):75-78.
[3] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[4] 孙静,董海龙,栾琪,等.缺血后处理减轻大鼠局灶性脑缺血再灌注损伤最佳方案[J].医学争鸣,2007,28(24):2214-2216.
[5] Zhao H. Ischemic postconditioning as a novel avenue to protect against brain injury after stroke[J]. Cereb Blood Flow Metab, 2009,29(5):873-885.
[6] Adibhatla RM, Hatcher JF. Secretory phospholipase A2 ⅡA is upregulated by TNF-ɑ and IL-1ɑ/β after transient focal cerebral ischemia in rat[J]. Brain Res, 2007,1134(1):199-205.
[7] Boyle K, Zhang J, Nicholson S, et al. Deletion of the SOCS box of suppressor of cytokine signaling 3 (SOCS3) in embryonic stem cells reveals SOCS box-dependent regulation of JAK but not STAT phosphorylation[J]. Cell Signal, 2009,21(3):394-404.
[8] He ZJ, Huang ZT, Chen XT, et al. Effects of matrix metalloproteinase 9 inhibition on the blood brain barrier and inflammation in rats following cardiopulmonary resuscitation[J]. Chin Med J (Engl), 2009,122(19):2346-2351.
[9] Xing B, Chen H, Zhang M, et al. Ischemic postconditioning protects brain and reduces inflammation in a rat model of focal cerebral ischemia/reperfusion[J]. J Neurochem,2008,105(5):1737-1745.
[10] Bates S, Read SJ, Harrison DC, et al. Characterisation of gene expression changes following permanent MCAO in the rat using subtracitve hybridisation[J]. Brain Res Mol Brain Res, 2001,93(1):70-80.
[11] Rao VLR, Bowen KK, Dhodda VK, et al. Gene expression analysis of spontaneously hypertensive rat cerebral cortex following transient focal cerebral ischemia[J]. J Neurochem, 2002,83(5):1072-1086.
[12] Satriotomo I, Bowen K K, Vemuganti R. JAK2 and STAT3 activation contributes to neuornal damage fllowing transient focal cerebral ischemia[J]. J Neurochem, 2006,98(5):1353-1368.
唐兴江(E-mail:3161946txj@163.com)
10.3969/j.issn.1002-266X.2016.37.012
R743.31
A
1002-266X(2016)37-0038-03
2016-04-10)

