阴道镜下宫颈组织活检诊断宫颈上皮内瘤变的准确性及其影响因素分析
姚军,王蔼明,,宋志琴,高金芳
(1安徽医科大学海军总医院临床学院,北京 100048;2中国人民解放军海军总医院)
阴道镜下宫颈组织活检诊断宫颈上皮内瘤变的准确性及其影响因素分析
姚军1,王蔼明1,2,宋志琴2,高金芳2
(1安徽医科大学海军总医院临床学院,北京 100048;2中国人民解放军海军总医院)
目的 观察阴道镜下宫颈组织活检诊断宫颈上皮内瘤变(CIN)的准确性,并探讨其影响因素。方法 选择阴道镜下宫颈组织活检诊断为CIN的499例患者,均行子宫颈锥形切除术或者全子宫切除术治疗,术后均行病理检查。以术后病理诊断为金标准计算阴道镜下宫颈组织活检诊断CIN的准确率。多因素Logistic回归分析探讨阴道镜检查满意度、是否分娩、是否绝经、锥高、锥底直径、病变范围、活检病理结果、细胞学检查结果、锥切间隔时间及患病年龄与阴道镜下宫颈组织活检准确性的关系。结果 阴道镜下宫颈组织活检准确率为60.7%,其中活检诊断为CIN Ⅰ的准确率为33.3%、CIN Ⅱ为36.6%、CIN Ⅲ为70.7%。阴道镜下宫颈组织活检准确性与阴道镜检查满意度、是否分娩、是否绝经、锥高、病变范围、活检病理结果、细胞学检查结果有关(P均<0.05),与患病年龄、锥切间隔时间、锥底直径等无关。结论 阴道镜下宫颈组织活检诊断CIN存在一定的误诊及漏诊。阴道镜下宫颈组织活检诊断CIN准确性的影响因素有阴道镜检查满意度、是否分娩、是否绝经、锥高、病变范围、活检病理结果、细胞学检查结果。
宫颈上皮内瘤变;阴道镜检查;病理检查;宫颈锥形切除术;全子宫切除术
目前,阴道镜检查是宫颈癌筛查中的第二步,在宫颈上皮内瘤变(CIN)及早期宫颈癌的诊断及处理中起重要作用[1]。直视下阴道镜下宫颈组织活检能够简单、有效地诊断CIN,但其诊断结果不可避免地存在一定主观上的偏差[1~4]。本研究观察了阴道镜下活检诊断CIN的准确性,并探讨其影响因素。
1 资料与方法
1.1 临床资料 收集我院2010年1月~2015年12月阴道镜下活检诊断为CIN行手术治疗患者共499例,年龄18~73(41.0±9.4)岁。所有的患者术前均签署手术知情同意书。
1.2 阴道镜下宫颈组织活检诊断CIN准确率计算方法 所有患者阴道镜下选用活检钳取可疑病变区0.2~0.4 cm大小组织块送往病理检查。对于细胞学检查提示异常腺细胞以及阴道镜检查阴性患者给予宫颈管搔刮,标本送病理检查。均行子宫颈锥形切除术或全子宫切除术治疗,未绝经患者手术于月经干净第3~7天开展,已绝经患者择期实施。手术切除标本送病理学检查,以手术后病理诊断结果为金标准计算阴道镜下活检诊断CIN的准确率。
1.3 阴道镜下宫颈组织活检诊断CIN准确性的影响因素分析方法 查询既往有关影响阴道镜下活检准确性的参考文献,咨询妇科肿瘤专家,结合实际临床工作情况,初步认为阴道镜下活检准确性可能与阴道镜检查满意度、分娩、绝经、锥高、锥底直径、病变范围、活检病理结果、细胞学结果、锥切间隔时间和发病年龄存在相关性,赋值见表1。由2名研究人员分别收集上述相关资料(住院病历、手术记录、术后随访记录等),必要时通过电话随访方式收集相关数据。
1.4 统计学方法 采用SPSS19.0统计软件。不同病变程度组间准确性分析采用多个独立样本的χ2检验,影响因素分析采用多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 阴道镜下宫颈组织活检诊断CIN的准确性 阴道镜下宫颈组织活检诊断CIN的准确率为60.7%;诊断CIN Ⅰ正确7例、误诊14例;诊断CIN Ⅱ正确45例、误诊78例;诊断CIN Ⅲ正确251例、误诊104例;病变升级率为13.4%(67/499),病变降级率为25.9%(129/499);病变程度越轻阴道镜下宫颈组织活检的准确率越低(P<0.01)。
2.2 阴道镜下宫颈组织活检诊断CIN准确性的影响因素 阴道镜下活检诊断CIN准确性的影响因素多因素Logistic回归分析结果见表2。
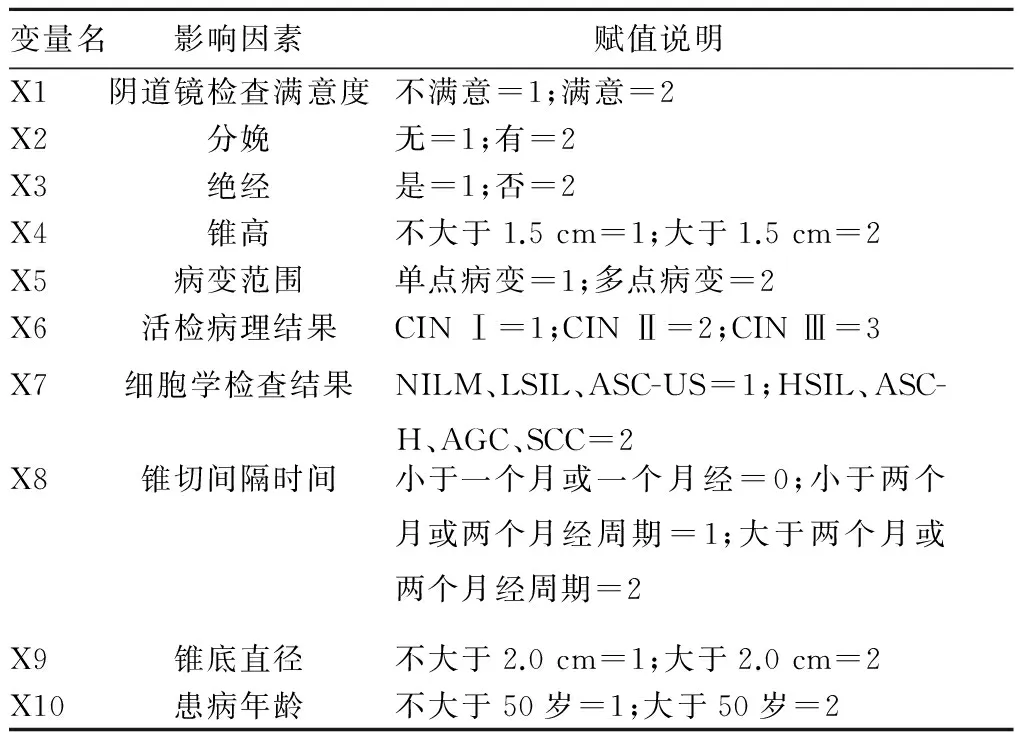
表1 阴道镜下活检诊断CIN准确性的可能影响因素赋值
注:满意阴道镜指宫颈转化区及病变区域完全可见;单点病变为活检组织病理学结果中仅存在一点提示此级别病变;ASC-US为意义未明的非典型鳞状细胞;LSIL为鳞状上皮内低度病变;HSIL为鳞状上皮内高度病变;ASC-H为非典型鳞状细胞不能除外高度鳞状上皮内病变;NILM为未见异常细胞;AGC为非典型腺细胞;SCC为鳞状细胞癌。

表2 阴道镜下活检诊断CIN准确性的影响因素多因素Logistic回归分析结果
3 讨论
宫颈癌癌前筛查主要方案为三阶梯筛查,目前公认此种筛查模式的准确性最高。当细胞学或高危HPV检查存在异常时,阴道镜检查对于CIN诊疗起至关重要的作用。阴道镜可将视野放大,醋酸及碘试验后可以细致地观察病变上皮、血管等结构,提高活检的准确性。然而,在临床工作中阴道镜下活检因取材主观,其结果准确性备受争议[2~4]。文献[2,3]报道的阴道镜下宫颈组织活检诊断CIN的准确率为43.4%~74.7%,而CIN病变程度越轻误诊率越高[5]。本研究结果表明阴道镜下宫颈组织活检诊断CIN的准确率为60.7%,病变程度越轻活检的准确率越低;这可能是因为低级别CIN的病变范围小且不典型,阴道镜下很难取到典型的病变组织,阴道镜下活检存在一定的误诊率,因此对于CIN Ⅰ级及年轻的CIN Ⅱ级女性实施宫颈锥切治疗前应慎重考虑,可适当采取小范围锥切治疗,避免不必要的锥切后并发症。
目前认为影响阴道镜下宫颈组织活检诊断CIN准确性的主要因素为阴道镜医师经验、病变范围、阴道镜检查满意度等[4,6,7]。Spitzer等[8]研究表明,阴道镜检查准确性与满意度密切相关,其中不满意的阴道镜检查中宫颈癌的漏诊率可达7.0%。另有研究[9~11]表明多点活检的准确率明显高于单点活检。Gage等[12]研究表明CIN病变范围越广阴道镜下活检的准确率越高。Baum等[13]发现具有两年以内工作经验的操作者阴道镜下活检准确率为77%,而经过两年专业培训的阴道镜操作者活检准确率可达92%。另有文献[14]报道,当患者年龄超过50岁时阴道镜下活检的准确性明显下降。但Muller等[10]认为,年龄大于50岁并不是阴道镜下宫颈组织活检误诊的危险因素。年龄对于阴道镜下宫颈组织活检准确性的影响主要表现为不满意阴道镜发生率的增加,但同时年龄与绝经存在相关性,对绝经后患者采取宫颈管搔刮术可以减轻年龄对于阴道镜下活检的影响效应。在临床工作中,手术操作者很难评估阴道镜医师经验。故本研究采用多因素Logistic回归模型分析探讨阴道镜检查满意度、分娩、绝经、锥高等与阴道镜活检准确率间的关系,期望通过其他客观指标综合评估阴道镜活检结果的可靠性。本研究结果表明,阴道镜下宫颈组织活检准确性受阴道镜检查满意度、分娩、绝经、锥高、病变范围、活检病理结果、细胞学检查结果影响。其中,阴道镜检查满意度影响最大,原因是暴露不充分时定向活检反而降低了阴道镜活检的准确性。细胞学检查结果代表脱落的宫颈上皮细胞病变程度,与病变程度存在一定的相关性;分娩的过程中宫颈发生撕裂,其后宫颈转化区暴露更加充分,阴道镜更易观察到完整的转化区;锥高增加,宫颈锥切完整取出病变组织的可能性越大;这些都能增加阴道镜下宫颈组织活检的准确性。另外,病变范围越小,阴道镜下活检越难取到典型的病变;绝经后缺乏激素作用,转化区回缩到宫颈管内,不利于转化区的暴露;这些都可能降低阴道镜下宫颈组织活检准确性。
可见,当阴道镜活检诊断为CIN患者中存在绝经、不满意阴道镜检查等因素时,应结合患者生育要求、诊疗目的、随访条件等因素采取个性化诊疗方案,提高诊疗的准确性。
[1] Massad LS, Weber KM, Wilson TE, et al. Correlating knowledge of cervical cancer prevention and human papillomavirus with compliance after colposcopy referral[J]. J Low Genit Tract Dis, 2012,16(2):98-105.
[2] Pretorius RG, Kim RJ, Belinson JL, et al. Inflation of sensitivity of cervical cancer screening tests secondary to correlated error in colposcopy[J]. J Low Genit Tract Dis, 2006,10(1):5-9.
[3] Pretorius RG, Bao YP, Belinson JL, et al. Inappropriate gold standard bias in cervical cancer screening studies[J]. Int J Cancer, 2007,121(10):2218-2224.
[4] Song Y, Zhao YQ, Zhang X, et al. Random biopsy in colposcopy-negative quadrant is not effective in women with positive colposcopy in practice[J]. Cancer Epidemiol, 2015,39(2):237-241.
[5] Duesing N, Schwarz J, Choschzick M, et al. Assessment of cervical intraepithelial neoplasia (CIN) with colposcopic biopsy and efficacy of loop electrosurgical excision procedure (LEEP)[J]. Arch Gynecol Obstet, 2012,286(6):1549-1554.
[6] Bifulco G, De Rosa N, Lavitola G, et al. A prospective randomized study on limits of colposcopy and histology: the skill of colposcopist and colposcopy-guided biopsy in diagnosis of cervical intraepithelial lesions[J]. Infect Agent Cancer, 2015,10:47.
[7] Pretorius RG, Belinson JL, Burchette RJ, et al. Regardless of skill, performing more biopsies increases the sensitivity of colposcopy[J]. J Low Genit Tract Dis, 2011,15(3):180-188.
[8] Spitzer M, Apgar BS, Brotzman GL. Management of histologic abnormalities of the cervix[J]. Am Fam Physician, 2006,73(1):105-112.
[9] Wentzensen N, Walker JL, Gold MA, et al. Multiple biopsies and detection of cervical cancer precursors at colposcopy[J]. J Clin Oncol, 2015,33(1):83-89.
[10] Muller K, Soergel P, Hillemanns P, et al. Accuracy of Colposcopically Guided Diagnostic Methods for the Detection of Cervical Intraepithelial Neoplasia[J]. Geburtshilfe Frauenheilkd, 2016,76(2):182-187.
[11] Nakamura Y, Matsumoto K, Satoh T, et al. Optimizing biopsy procedures during colposcopy for women with abnormal cervical cancer screening results: a multicenter prospective study[J]. Int J Clin Oncol, 2015,20(3): 579-585.
[12] Gage JC, Hanson VW, Abbey K, et al. Number of cervical biopsies and sensitivity of colposcopy[J]. Obstet Gynecol, 2006,108(2):264-272.
[13] Baum ME, Rader JS, Gibb RK, et al. Colposcopic accuracy of obstetrics and gynecology residents[J]. Gynecol Oncol, 2006,103(3):966-970.
[14] Baldauf JJ, Dreyfus M, Ritter J, et al. An analysis of the factors involved in the diagnostic accuracy of colposcopically directed biopsy[J]. Acta Obstet Gynecol Scand, 1997,76(5):468-473.
国家“十二五”科技支撑项目(2012BAI32B05)。
王蔼明(E-mail: one_army@sina.com)
10.3969/j.issn.1002-266X.2016.35.018
R711.74
B
1002-266X(2016)35-0057-03
2016-05-25)

