活检病理为食管黏膜中度不典型增生病变内镜下切除治疗的可行性研究
李素华,潘淑平,夏 伟,周瑞雪,雷复华
(肥城市人民医院, 山东 泰安 271600)
活检病理为食管黏膜中度不典型增生病变内镜下切除治疗的可行性研究
李素华,潘淑平,夏 伟,周瑞雪,雷复华
(肥城市人民医院, 山东 泰安 271600)
目的 对食管上皮不典型增生病变内镜下表现进行量化评分,并结合活检病理以期更能准确反映出病变真实程度,并及时给予相应的处理措施。方法 作者回顾性分析有明确病理诊断的180例食管上皮不典型增生患者的内镜下表现,找寻其中规律以此为基础制定出内镜下评分标准,再应用此评分标准,分析活检病理为食管上皮中度不典型增生患者84例内镜下评分与术后病理的关系。结果 84例活检病理为中度不典型增生患者,活检病理诊断与内镜下食管黏膜切除术(EMR)后病理诊断一致50例,活检病理诊断不足22例,EMR术后病理不足诊断中度不典型增生(轻度不典型增生或炎症)12例。内镜下评分≥8分者36例(43%),EMR术后中度不典型增生者18例(21%),EMR术后重度不典型增生者18例(21%),重度不典型增生与中度不典型增生的比值为11。结论 活检病理存在一定的局限性,不能完整反映食管癌前病变的严重程度,内镜下评分可以在一定程度上反映病变的严重程度,且能指导内镜下治疗。内镜下评分≥8分可作为活检病理为中度不典型增生病变行EMR治疗的标准。
食管中度不典型增生;内镜下食管黏膜切除术;内镜下评分
食管上皮不典型增生作为癌前病变,对其进行恰当的干预治疗,可以显著降低食管癌发病率和死亡率[1]。轻度和中度不典型增生13.5 a癌变率分别为25%、50%,而重度不典型增生13.5 a癌变率75%。因此,对于轻、中度不典型增生患者可以定期随访观察,而重度不典型增生以上患者应及时采取相应的措施干预治疗[2]。但是在实际工作中,由于内镜活检的局限性,活检病理与术后病理之间存在一定的差异性[3],单纯依靠内镜活检病理结果并不能完全反映病变的真实程度,部分活检病理为食管上皮中度不典型增生的患者实际上已经发展至重度不典型增生甚至以上阶段。本研究旨在对食管上皮中度不典型增生病变内镜下表现进行量化评分,并结合活检病理以期更能准确的反映出病变真实程度,并及时给予相应的处理措施。
1 资料与方法
1.1 研究对象 收集2013年1月至2014年5月在我院行胃镜检查活检病理为食管上皮中度不典型增生并行内镜下食管黏膜切除术(endoscopic mucosal resection,EMR)术患者共95例,排除病变的内镜下表现没有详细记录者4例,EMR术未能完全切除病变者7例,本研究共纳入84例,其中男48例,女36例;年龄范围44~78岁,中位年龄65.9岁。
1.2 研究方法 首先回顾性分析2010年至2012年在我院行内镜检查180例食管上皮不典型增生患者的内镜下表现,从病变颜色、形态、碘染色分级及病变范围4个方面进行研究,我们发现食管病变由轻度不典型增生、中度不典型增生发展到重度不典型增生或原位癌、早期食管癌,其在镜下的表现有一定的规律性。见表1,图1~5。
食管黏膜由轻度不典型增生→中度不典型增生→重度不典型增生/原位癌→食管癌的发展过程中,白区、红区、糜烂、隆起、微皱襞消失等内镜下特征性表现及病变范围所占比例呈明显增大趋势,碘染色分级由3级到1级所占比重明显增加,由此我们根据病变在颜色、形态、碘染色分级[4]以及染色后病变范围这4个方面的发展变化特点,制定食管黏膜病变的内镜下表现评分,其中病变颜色包括正常颜色、白区、红区;病变形态包括正常粘膜表现、血管纹理中断或者消失、粗糙或颗粒样改变、糜烂、凹陷、隆起以及微皱襞消失(僵硬感);碘染色分为4个级别:染色后呈正常棕色为阴性,染色后不着色区颜色较淡且边界不清为Ⅲ级,染色后不着色区颜色淡但不着色区边界清楚为Ⅱ级,染色后病变处不着色且边界清楚为Ⅰ级;染色后病变范围包括病变长度及病变横径。将以上各种因素分别赋予不同分值来量化,当每个方面出现多种表现并存时仅选取病变表现相对应的较高分值,将4个方面因素分值相加计算病变的总分值。见表2。
应用上述评分标准,分析2013年 1月至 2014 年5月在我院行胃镜检查的患者活检病理为食管上皮中度不典型增生并行EMR术患者共95例,排除病变的内镜下表现没有详细记录者4例,EMR术未能完全切除病变者7例,本研究共纳入84病例,分析内镜下评分与病理的关系。对所有病例均给予透明帽法EMR术完全切除,以术后病理为金标准,分析比较内镜下评分与病理之间的相关性。
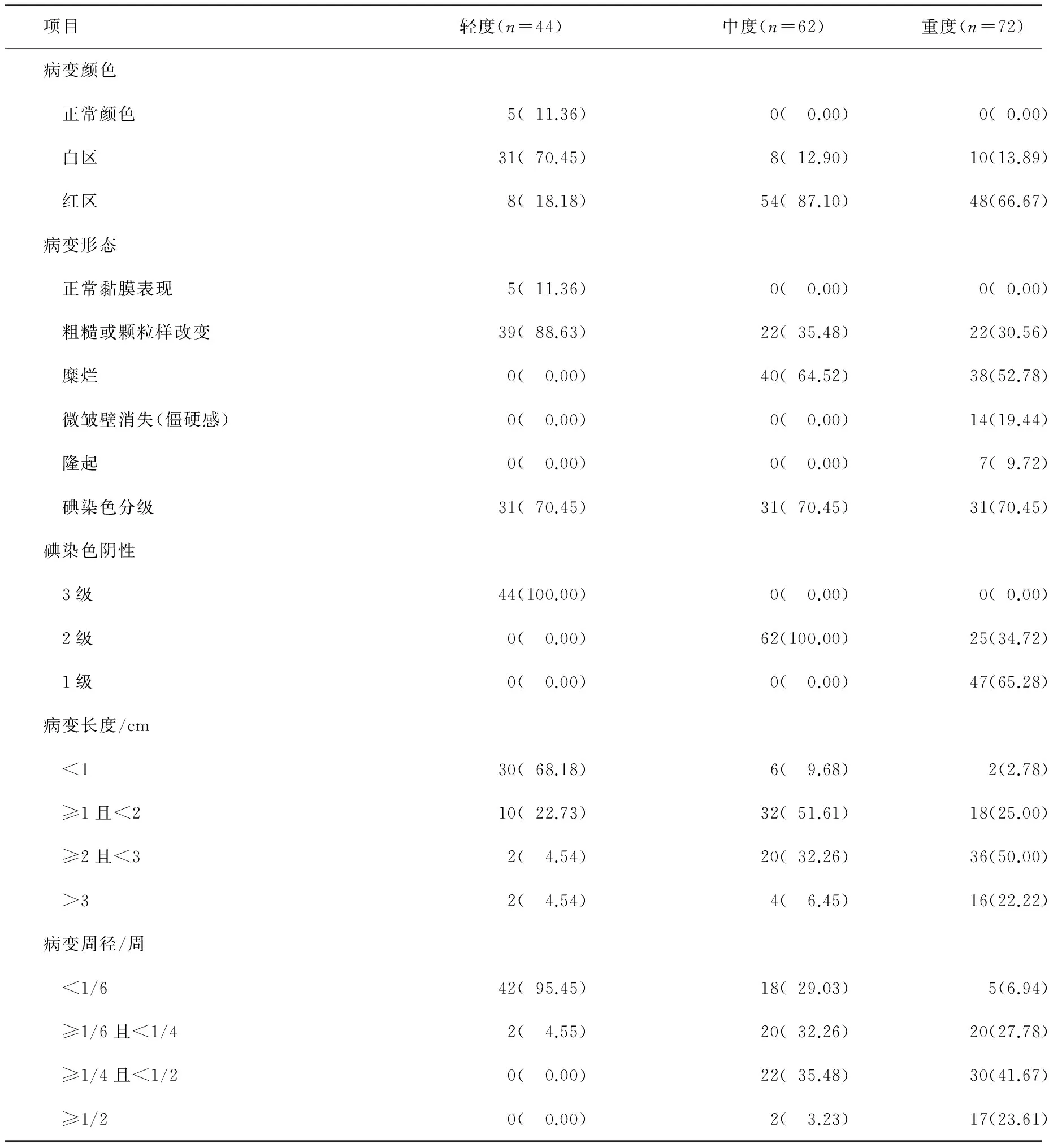
表1 食管癌前病变各阶段镜下表现

图1 颜色占比图
轻度不典型增生患者食管颜色以白区为主,中度不典型增生患者食管颜色以红区为主
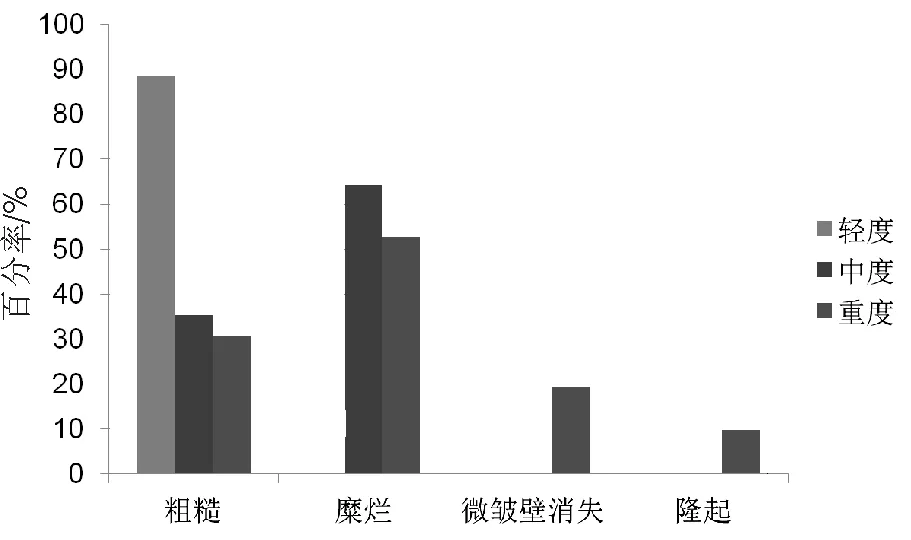
图2 形态占比图
轻度不典型增生患者食管形态表现为正常黏膜或粗糙,以粗糙为主,占88.63%,中度不典型增生食管形态表现为粗糙或糜烂,以糜烂为主,占64.52%,重度不典型增生患者食管形态多变,粗糙占30.56%,糜烂52.78%,微皱襞消失19.44%,隆起9.72%

图3 碘染色分级图
食管轻度不典型增生碘染色为3级,食管中度不典型增生为2级,食管重度不典型增生为1级占65.28%,2级占34.72%
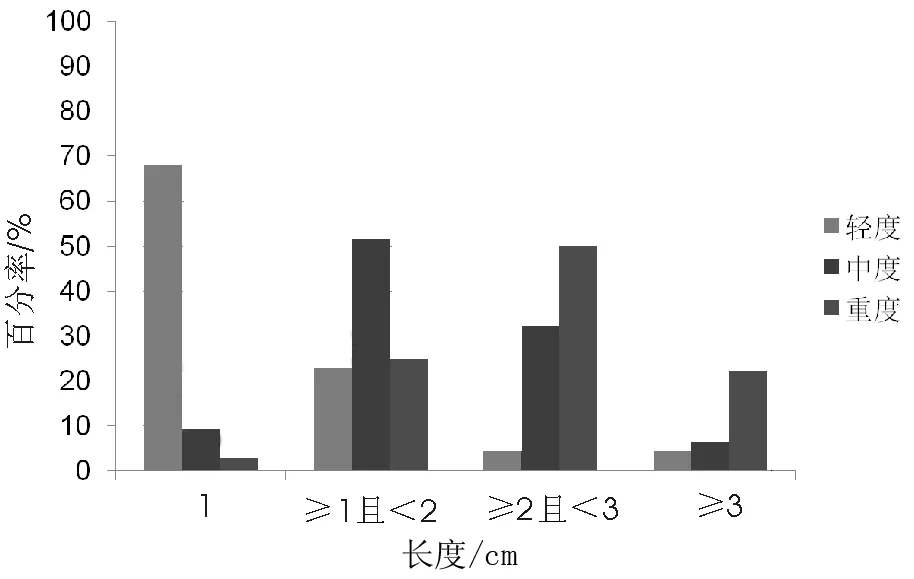
图4 病变长度分布图
轻度不典型增生病变长度<1 cm占68.18%;中度不典型增生病变长度长短不一,≥1 cm且<2 cm;重度不典型增生中,≥2 cm且<3 cm者占50.00%,≥3 cm者占22.22%
图5 病变周径分布图
轻度不典型增生病变周径以<1/6周为主,占95.45%;中度不典型增生病变周径大小不一,≥1/6周且<1/4周;重度不典型增生病变上周径多≥1/4周,<1/2周者占41.67%,≥1/2周者占23.61%
2 结果
84例活检病理为中度不典型增生患者中,EMR术后病理为重度不典型增生以上者22例(26.19%),其中内镜下评分<8分者4例(4.76%),内镜下评分≥8分者18例(21.43%)。病变的活检病理结合内镜表现评分≥8分,可以发现21.43%的活检病理为中度不典型增生而实际病变程度为重度不典型增生以上的患者。以此为临界点,内镜表现评分与术后病理结果的相关性见表3。

表2 食管癌前病变内镜下表现量化评分标准

表3 内镜表现评分与术后病理的关系 n(%)
3 讨论
食管癌是我国最常见的消化道恶性肿瘤,位居肿瘤死亡第四位。目前研究[5]认为食管鳞状上皮癌变的规律为依次正常上皮、单纯性增生、食管鳞状上皮轻度不典型增生、中度不典型增生、重度不典型增生、原位癌、早期浸润癌、浸润癌,这是一个连续谱段式的演进过程。在食管癌病因预防及特异性诊断标志物尚未找到的情况下,早期发现、早期诊断及早期治疗是减少食管癌发生率、降低死亡率的重要举措之一,而对重度不典型增生病变给予及早的发现并干预治疗成为降低食管癌发生率、死亡率关键之一[6]。一直以来我们普遍接受的观点是活检是确定病变的金标准,可是活检的准确性却高低不一,日本的最高,已达到90%以上,我国的统计资料是70%[7],分析其原因,可能有以下几点:1)活检位置不准,内镜科医生认识不够,不能取到病变的严重之处;2)活检诊断只是活检病变一个点的诊断,而不是整个病变的诊断;3)内镜活检深度不够;4)活检第1钳最重要,最关键,否则活检后病灶渗血,病变及边界视野不清,影响活检的准确性;5)某些病变位置特别,活检不易夾到;6)活检时钳除了病变中最严重成分。这些原因导致活检病理与术后病理存在一定的差异性[8],也就是说活检病理并不能完全反映病变的真实程度,活检病理只是一个点的诊断,部分活检病理为食管上皮轻、中度不典型增生病变实际上可能已经发展到重度不典型增生甚至以上阶段。对于面积较大的病灶,我们应该提高警惕,需结合内镜下表现综合评估。
早期食管癌及癌前病变在内镜下表现复杂多样,常见有红区、白区、黏膜增厚、血管纹理紊乱、糜烂、粗糙、斑块、结节等[9],且各种表现轻重不一又可以重叠共存,加之内镜清晰度的差异、内镜检查者对病变认识水平不同等诸多方面因素干预,内镜下对病变的表现描述有极强的主观性,碘染色及分级虽然可以敏感的发现病变并在一定程度上区分病变的严重情况,但其准确性仍欠佳[10]。活检病理对内镜下切除病变具有较好的提示作用,本研究试图以内镜表现量化评分并结合活检病理的方式来更真实反映食管癌及癌前病变情况,并及时给予相应处理。本研究从内镜下病变颜色、形态、碘染色分级、病变范围4个方面对常见表现分别量化评分,使病变的内镜下表现尽量客观化,再结合活检病理以达到能更准确反映病变程度,弥补单纯活检病理带来的局限性。
本研究中,活检病理为中度不典型增生84例中,实际上已发展为重度不典型增生以上病变者22例。当内镜下评分≥7分时选取的病例数为52例,其中,中度不典型增生者32例,重度不典型增生者20例,重度不典型增生与中度不典型增生的比值为11.6;当内镜下评分≥8分时选取的病例数为36例,其中,中度不典型增生者18例,重度不典型增生者18例,重度不典型增生与中度不典型增生的比值为11;当内镜下评分≥9分时选取的病例数为16例,其中中度不典型增生者4例,重度不典型增生者12例,重度不典型增生与中度不典型增生的比值为31。我们发现,随着内镜下评分分值的升高,重度不典型增生与中度不典型的比值明显增高。当≥8分时,重度不典型增生与中度不典型增生的比值达11。因此,我们推荐≥8分作为活检病理为中度不典型增生病变行EMR术治疗的标准,此标准可以找寻出一定的诊断不足病例,并及时行内镜下黏膜切除治疗。
通过该评分系统能够在一定程度上弥补单纯活检病理带来的诊断局限性,及时找寻出内镜下活检病理为中度不典型增生而实际上已发展为重度不典型增生以上阶段的这部分人群,并及时给予积极的干预治疗。部分患者实际上病理降低,随访即可,不必激进行EMR,因此在强调一下此评分系统可以避免一部分患者的过度治疗。由于此评分系统对内镜设备要求不高,更适合在尚不具备NBI、放大内镜等先进技术的基层医院作为筛查食管早癌及癌前病变的判断方法之一。
本评分系统在食管癌及癌前病变的诊疗方面仍有一些不足的方面:譬如单纯应用内镜评分对区分反流性食管炎、食管间质瘤、乳头状瘤等其他良性病变方面特异性不佳;同时也发现有一些病变范围很小,内镜下形态无明显表现。对于这些患者,内镜下评分应用价值不大;由于样本量相对不足,该评分对判断轻度不典型增生与中度不典型增生之间的差异性不明显;对于目前为中度不典型增生病变而将来会发展为重度不典型增生病变的这部分人群在内镜下表现评分中的研究也不足,有待于进一步的研究。
[1] Wang LD, Zheng S, Zheng ZY, et al. Primary adenocarcinomas of lower esophagus, esophagogastric junction and gastric cardia: in special reference to China[J].World J Gastroenterol,2003,9(6):1156-1164.
[2] 陈志峰,侯浚,张建慧,等.食管鳞状上皮细胞重度不典型增生研究进展[J]. 河南肿瘤学杂志,2004,17(1):72-74.
[3] 张游,令狐恩强,卢忠生,等. 术前活检在胃粘膜病变内镜粘膜下剥离术治疗中的价值分析[J]. 中国继续医学教育,2011,(12):86-89.
[4] Dawsey SM, Fleischer DE, Wang GQ,et al. Mucosal iodine staining improves endoscopic visualization of squamous dysplasia and squamous cell carcinoma of the esophagus in Linxian, China[J].Cancer,1998,83(2):220-231.
[5] 刘复生,林培中.食管癌的病理和预防[M].北京:地质出版社,1994:42-44.
[6] 王国清.食管癌癌前病变的发展趋势及对策[J].中华肿瘤杂志,2002,24(2):106-107.
[7] 方野纯治.内镜诊断与鉴别诊断图谱[M].沈阳:辽宁科技出版社,2003:292.
[8] 陈志峰,王国清,侯浚,等.158例食管重度不典型的随访结果[J],中国肿瘤临床,2004,31(6):306-309.
[9] 李益农,陆星华.消化内镜学[M].2版.北京:科学出版社,2004:278-282.
[10]方晓松,周颦,汪宇鸿,等. 内镜下卢戈氏液染色对早期食管癌及癌前病变的诊断研究[J]. 重庆医学,2009,38(11):1365-1366.
泰安市科技发展计划项目(编号:201340629)
李素华(1964-),女,副主任护师,主要从事临床管理及食管癌早诊早治工作。E-mail:vyi2046@163.com
10.3969/j.issn.1673-5412.2016.05.016
R735.1;R730.4
B
1673-5412(2016)05-0423-05
2016-02-12)

