高精度持续循环腹腔热灌注化疗联合静脉化疗治疗卵巢癌的临床研究
辛敏洁,王晓琼,张菊新
(郑州大学人民医院妇产科,河南 郑州 450003)
高精度持续循环腹腔热灌注化疗联合静脉化疗治疗卵巢癌的临床研究
辛敏洁,王晓琼,张菊新
(郑州大学人民医院妇产科,河南 郑州 450003)
目的 探讨高精度持续循环腹腔热灌注化疗(HIPEC)联合静脉化疗治疗卵巢癌的临床疗效。方法 入组卵巢癌患者198例,分为2组,其中治疗组120例(HIPEC联合紫杉醇+奥沙利铂方案静脉化疗组)、对照组78例(紫杉醇+奥沙利铂方案静脉化疗组)。观察2组患者的生存时间、病死率、复发率、生活质量及化疗毒副反应。结果 治疗组患者术后1 a、2 a、3 a病死率及复发率明显低于对照组,而平均生存时间高于对照组(P<0.05)。结论 HIPEC联合静脉化疗能有效降低卵巢癌患者术后复发率及病死率,提高生活质量,延长其生存时间。
卵巢癌;高精度持续循环腹腔热灌注化疗;静脉化疗
卵巢癌是女性生殖器官常见的3大恶性肿瘤之一,其发病率仅次于宫颈癌和子宫内膜癌列居第3位,其是女性生殖道恶性肿瘤致死率最高的疾病,较高的死亡率使得卵巢癌的诊治成为妇科肿瘤专家关注的重点。卵巢癌的转移以局部浸润和种植播散为主,即使行肿瘤细胞减灭术也不能将腹腔内转移病灶完全清除,腹腔内仍残留有微小肿瘤转移灶及游离的肿瘤细胞。自1980年,Spratt等[1]首次报道高精度持续循环腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy ,HIPEC)用于治疗腹膜癌以来,HIPEC技术逐渐应用于卵巢癌的治疗中,并成为卵巢癌患者行肿瘤细胞减灭术后的一项有效的辅助治疗。本文对卵巢癌患者行肿瘤细胞减灭术后给予HIPEC联合静脉化疗的临床疗效进行分析,现总结分析如下。
1 资料与方法
1.1 研究对象
1.1.1 一般材料 收集郑州大学人民医院2012年4月至2014年3月收治的198例Ⅲ期卵巢癌患者,所有患者均行满意的肿瘤细胞减灭术。治疗组(HIPEC联合紫杉醇+奥沙利铂静脉化疗):共120例,其中Ⅲa期 13例,Ⅲb期82例,Ⅲc期25例;黏液性癌16例,浆液性癌85例,其他上皮性卵巢癌19例。对照组(紫杉醇+奥沙利铂静脉化疗):共78例,Ⅲa期 9例,Ⅲb期55例,Ⅲc期14例;黏液性癌13例,浆液性癌55例,其他上皮性卵巢癌10例。2组患者术前KPS评分均≥60分。2组患者基本资料比较差异无统计学意义(P>0.05),具有对比性。
1.1.2 纳入及排除标准 纳入标准 根据2012年FIGO卵巢癌临床治疗指南,手术病理分期为Ⅲ期的首次确诊的卵巢癌患者;行腹经满意的肿瘤细胞减灭术;患者年龄>20~<70岁;手术时间不超过4 h。
排除标准:复发性卵巢癌患者;严重肝肾功能不全者;严重心脑血管疾病、高血压者;不能耐受化疗者;有各种原因导致的严重腹腔内粘连者。
1.2 研究方法
1.2.1 术前准备 详细询问患者病史、全面记录体格检查,常规行血常规、尿常规、肝功能、肾功能、电解质、凝血功能、心电图、传染病、胸部正位片、盆腹腔及乳腺超声、盆腹腔MRI、肿瘤标志物如CA125、CA199、CEA等检查,
1.2.2 术后2组的治疗方法 治疗组术后第1、3、5天通过高精度腹腔热灌注治疗系统(BR-TRG-Ⅱ型)分别向3 000 mL生理盐水中加入顺铂90 mg、60 mg、60 mg腹腔内循环灌注,每次灌注结束后,腹腔内留有灌注液1 000 mL,前2次灌注后4根腹腔灌注管开放引流,第3次灌注结束后向腹腔内注入顺铂60 mg,夹闭4根腹腔热灌注管,24 h后引流腹腔内液体。腹腔热灌注治疗系统温度设定43 ℃,灌注速度 400 mL·min-1,循环恒温灌注60 min,灌注过程中监测脉搏、血压、体温、及4根热灌注管通畅情况。最后一次灌注后2周行“紫杉醇135 ~175 mg·m-2+奥沙利铂130 mg·m-2”方案相同方案静脉化疗1次,后每隔21 d行相同方案静脉化疗1次,共行6周期。对照组于术后第7~10天行相同方案静脉化疗,后每隔21 d行相同方案静脉化疗1次,共行6周期。
1.3 随访 对所有研究对象进行随访:术后1~2 a内,每3个月1次,术后3~5 a内每6个月1次。
1.4 伦理学审核 该研究符合郑州大学人民医院负责人体试验的委员会制定的伦理学标准,并通过审核。告知患者及其家属HIPEC可能出现的毒副反应及解决办法,并签署知情同意书。
1.5 统计学处理 采用SPSS 17.0进行数据分析,病理类型、病理分期等计数资料比较采用χ2检验,等级资料比较采用秩和检验,采用Kaplan-Meier法绘制生存曲线,行log rank检验进行差异性分析,检验水准α=0.05。
2 结果
2.1 2组患者复发率比较 2组术后1 a、2 a、3 a复发率比较差异均有统计学意义(P均<0.05)。见表1。

表1 2组患者复发率比较 n(%)
2.2 2组患者病死率比较 2组术后1 a、2 a、3 a病死率比较差异均有统计学意义(P均<0.05)。见表2。

表2 2组患者病死率比较 n(%)
2.3 2组患者生活质量改善情况 2组术后生活质量改善情况比较差异无统计学意义 (P>0.05)。见表3。
2.4 2组生存分析结果比较 治疗组平均生存时间高于对照组,差异有统计学意义(P<0.05)。见图1。

表3 2组生活质量改善情况比较 n
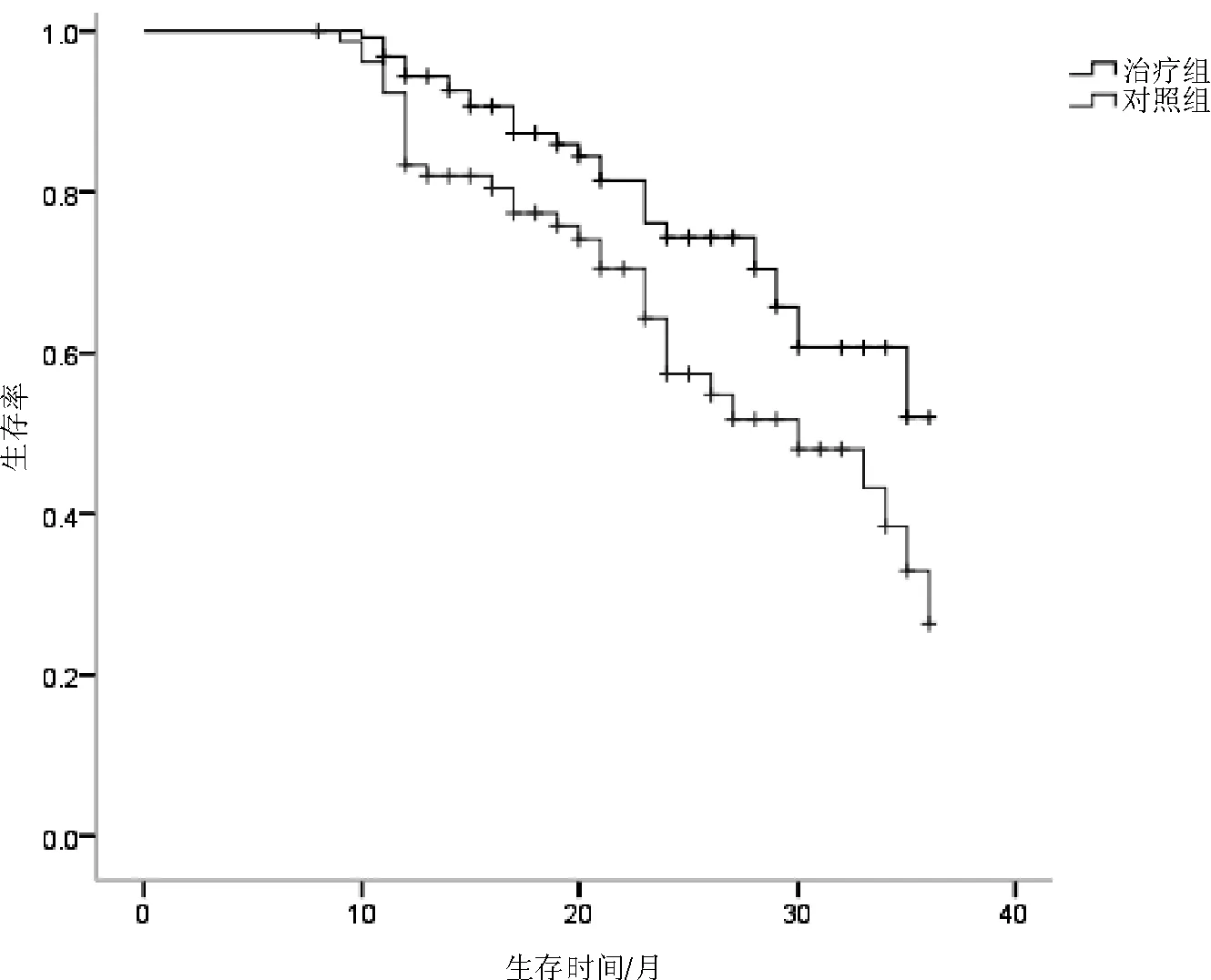
图1 2组生存曲线比较
2.5 2组患者化疗毒副反应比较 2组患者治疗期间无因严重化疗毒性反应而终止治疗者,其中治疗组腹泻发生率高于对照组,差异有统计学意义(P<0.05)。见表4。

表4 2组患者化疗毒副反应比较 n
3 讨论
卵巢癌的转移方式包括局部浸润、种植播散、血行转移及淋巴转移,其中局部浸润、种植播散为主要转移方式,其治疗原则仍以手术为主,术后辅以化疗、放疗及生物治疗,一线化疗方案为卡铂类联合紫杉醇。腹腔内化疗最初用于治疗胃肠道恶性肿瘤,因应用腹腔内化疗治疗胃肠道恶性肿瘤疗效显著,其治疗范围逐渐扩大,HIPEC治疗方案是将含有化疗药物的灌注液,精准恒温、循环灌注、充盈腹腔,维持一定时间,以达到有效清除腹腔内恶性肿瘤细胞,杀灭肿瘤亚临床病灶的目的[2]。
本研究采用回顾性队列研究设计,收集了卵巢癌Ⅲ期患者198例,均行满意的肿瘤细胞减灭术,生存分析显示治疗组平均生存时间高于对照组,治疗组患者术后1 a、2 a、3 a复发率、病死率均低于对照组,治疗组生活质量的改善高于对照组,但差异无统计学意义(P>0.05)。相关研究[3-4]表明,腔热灌注组与静脉滴注组1 a生存率分别是87.5%、77.5%,2 a生存率分别是75.0%、60.0%,3 a生存率分别是70.0%、42.5%,前者有效延长了晚期卵巢癌患者的生存时间。治疗组与对照组的毒副反应中骨髓抑制、呕吐、肝功能损伤比较差异均无统计学意义(P均>0.05),仅腹泻比较差异有统计学意义(P<0.05),可能与HIPEC过程中引起患者肠道水肿有关。
HIPEC机制包括:热疗对肿瘤细胞的直接杀伤作用、化疗药物与热疗的协同作用及机械冲刷作用。肿瘤组织和正常组织对温度的耐受存在差异性,正常组织在47 ℃高温条件下可耐受1 h,而肿瘤细胞仅可耐受43 ℃高温[5],47 ℃、43 ℃高温持续1 h被称为正常组织细胞和肿瘤细胞不可逆损害的临界温度。肿瘤细胞减灭术后腹腔内残留的肿瘤组织及游离的肿瘤细胞在高温的作用下,DNA修复能力及RNA的合成能力发生相应变化,使肿瘤细胞更容易发生变形坏死。热疗和化疗联合应用具有显著的协同作用[6-9],由于“腹膜-血浆屏障”的存在,腹腔内的化疗药物浓度高于血液中浓度,提高了化疗药物对腹腔内病灶的疗效,De Bree等[10]对卵巢癌患者行肿瘤细胞减灭术及术中2 h紫杉醇腹腔热灌注化疗,研究显示:腹腔液内药物浓度最高达101 mg·L-1,是血液最高浓度的1 178倍,5 h后是366倍。在加温条件下,细胞膜的流动性增强,药物的通透性增加利于化疗药物进入肿瘤细胞内,抗肿瘤作用明显增强,提高药物反应率。热疗还可增加肿瘤细胞对化疗药物的敏感性、渗透性[11],使得药物的渗透浓度从1~2 mm加深至5 mm[12]。HIPEC的容量作用使得残留的肿瘤组织脱落,缩小癌灶,转化肿瘤细胞的生物学特性[13-16],减轻腹腔内肿瘤负荷,净化了腹腔的内环境。
细胞在高温这一应激因素的刺激下产生热休克蛋白,热应激后1 h,热休克蛋白开始合成,4 h达到高峰期,24 h恢复正常,热休克蛋白的产生与细胞对热耐受能力的升高有着明显的伴随关系[17],间隔24 h进行HIPEC,避免了卵巢癌细胞热耐受对疗效的影响。
总之,HIPEC联合静脉化疗能有效降低卵巢癌患者术后复发率及病死率,提高生活质量,延长其生存时间,但由于样本量小及随访时间短的关系,尚需进一步扩大样本量和延长随访时间观察。
[1] Spratt JS,Adcock RA,Muskovin M,et al.Clinical delivery system for intraperitoneal hyperthermic chemotherapy[J]. Cancer Res,1980,40(2):256-260.
[2] 高辛. 腹腔热灌注化疗联合静脉化疗治疗胃肠道肿瘤合并恶性腹水的临床研究[J]. 内科,2009,4(2):199-200.
[3] 徐明波,程素琦. 热休克蛋白代谢过程中HeLa细胞热耐受性的变化[J]. 中国应用生理学杂志,1991,7(1):41-44.
[4] 闫玉兰,张冬梅,王英,等. 腹腔灌注与静脉化疗治疗晚期卵巢癌的疗效对比研究[J]. 国际妇产科学杂志,2014,41(6):655-657.
[5] Garofalo A, Valle M, Garcia J, et al. Laparoscopic intraperitoneal hyperthermic chemotherapy for palliation of debilitating malignant ascites[J]. Eur J Surg Oncol,2006,32(6):682-685.
[6] Kusamura S, Dominique E, Baratti D, et al. Drugs, carrier solutions and temperature in hyperthermic intraperitoneal chemotherapy[J]. J Surg Oncol,2008,98(4):247-252.
[7] Zhang X, Shi H, Tang H, et al. miR-218 inhibits the invasion and migration of colon cancer cells by targeting the PI3K/Akt/mTOR signaling pathway[J]. Int J Mol Med,2015,35(5):1301-1308.
[8] Cui S, Ba M, Tang Y, et al. B ultrasound-guided hyperthermic intraperitoneal perfusion chemotherapy for the treatment of malignant ascites[J]. Oncol Rep,2012,28(4):1325-1331.
[9] Ruan Q, Fang ZY, Cui SZ, et al. Thermo-chemotherapy Induced miR-218 upregulation inhibits the invasion of gastric cancer via targeting Gli2 and E-cadherin[J]. Tumour Biol,2015,36(8):5807-5814.
[10]De Bree E, Rosing H, Filis D, et al. Cytoreductive surgery and intraoperative hyperthermic intraperitoneal chemotherapy with paclitaxel: a clinical and pharmacokinetic study[J]. Ann Surg Oncol,2008,15(4):1183-1192.
[11]Brigand C, Arvieux C, Gilly FN, et al. Treatment of peritoneal carcinomatosis in gastric cancers[J]. Dig Dis,2004,22(4):366-373.
[12]Jacquet P, Averbach A, Stuart OA, et al. Hyperthermic intraperitoneal doxorubicin: pharmacokinetics, metabolism, and tissue distribution in a rat model[J]. Cancer Chemother Pharmacol,1998,41(2):147-154.
[13]崔书中,巴明臣,黄迪文,等. BR-TRG-I型体腔热灌注治疗系统的研制与开发[J]. 中国医疗设备,2009,24(9):7-9.
[14]崔书中,巴明臣,黄狄文,等. BR-TRG-Ⅰ型体腔热灌注治疗系统安全性评估的动物实验[J]. 中国比较医学杂志,2009,19(10):27-31.
[15]陈祖龙,吴印兵,唐鸿生,等. 腹腔热灌注化疗联合静脉化疗治疗恶性腹水的临床疗效观察[J]. 实用医学杂志,2014,30(18):2950-2952.
[16]王俞,崔书中,巴明臣. 腹腔热灌注化疗联合免疫治疗在恶性腹水中的应用[J]. 临床肿瘤学杂志,2013,18(11):1041-1044.
[17]徐明波,程素琦. 热休克蛋白代谢过程中HeLa细胞热耐受性的变化[J]. 中国应用生理学杂志,1991,7(1):41-44.
Clinical Study of High Precision Continuous Circulating Hyperthermic Intraperitoneal Chemotherapy Combined with Intravenous Chemotherapy in the Treatment of Ovarian Cancer
Xin Minjie, Wang Xiaoqiong, Zhang Juxin
(DepartmentofObstetricsandGynecology,thePeople’sHospitalofZhengzhouUniversity,Zhengzhou450003,China)
Objective To investigate the clinical efficacy of high precision continuous circulating hyperthermic intraperitoneal chemotherapy (HIPEC) combined with intravenous chemotherapy in the treatment of ovarian cancer.Methods The 198 patients with ovarian cancer were divided into two groups: 120 patients in the treatment group (HIPEC combined with paclitaxel and oxaliplatin intravenous chemotherapy group) and 78 patients in the control group (paclitaxel and oxaliplatin intravenous chemotherapy). The survival time, mortality, recurrence rate, quality of life and toxicities of the two groups were compared.Results In the treatment group, 1-year, 2-year, 3-year mortality rate and recurrence rate were significantly lower than those in the control group, the average survival time were higher than that of the control group, the difference were statistically significant (P<0.05). Conclusion HIPEC combined with intravenous chemotherapy can effectively reduce the recurrence rate and mortality rate of ovarian cancer patients after operation, improve the quality of life, prolong the survival time.
ovarian cancer; high precision continuous circulating hyperthermic intraperitoneal chemotherapy; intravenous chemotherapy
河南省科技攻关项目(编号:132102310062)
辛敏洁(1990-),女,硕士,主要从事卵巢癌的基础研究与临床治疗工作。E-mail:xinminjiezzu@sina.com
张菊新(1955-),女,主任医师,硕士生导师,主要从事妇科肿瘤基础与临床研究。E-mail:zjx1106@tom.com
10.3969/j.issn.1673-5412.2016.05.006
R737.31;R730.53
A
1673-5412(2016)05-0389-04
2016-03-19)

