顶空气相色谱法筛选低含量氰化物酿酒原料的研究
刘诗宇,吴幼茹,付跃,李连威,江伟,王德良,陈彬,黄时海,栾春光*
(1.广西大学生命科学与技术学院,广西南宁530004;
2.中国食品发酵工业研究院酿酒工程技术研究发展部,北京100015;3.酒类品质与安全国际联合研究中心,北京100015)
顶空气相色谱法筛选低含量氰化物酿酒原料的研究
刘诗宇1,2,吴幼茹1,2,付跃1,李连威1,江伟2,3,王德良2,3,陈彬2,黄时海1,栾春光2,3*
(1.广西大学生命科学与技术学院,广西南宁530004;
2.中国食品发酵工业研究院酿酒工程技术研究发展部,北京100015;3.酒类品质与安全国际联合研究中心,北京100015)
采用氯胺T将高粱中的氰化物衍生为氯化氰,利用顶空气相色谱法对不同高粱品种中的氰化物含量进行测定,建立了高粱原料中氰化物的检测方法。结果表明,该检测方法在氰化钾含量0~10 μg/g的线性范围内回归系数R2=0.998 5,平均回收率为95.8%,相对标准偏差值为4.2%(n=5),检出限为0.11 μg/g(S/N=3)。而常用的蒸馏前处理方式会引起原料中氰化物含量的损失。不同高粱品种中氰化物含量有明显差异,证明了低含量氰化物粮食品种存在可筛选性。该方法可以准确、快速、灵敏的检测粮食中的氰化物含量,为酿酒原料的品质安全监控提供了技术支持。
氰化物;顶空气相色谱法;粮食;酿酒原料
粮食既是人们日常生活中必不可少的食物来源,也是酒类酿造的主要原料。目前,我国常用的酿酒原料包括高粱、大米、玉米、小麦、糯米以及以甘薯干为主的薯类等[1]。但市场上的各类粮食品种混杂,种目繁多,质量良莠不齐。因此,酿酒原料的优劣是决定成品酒品质的重要因素[2]。研究表明,高粱等酿酒原料中都含有游离态的氰化物,氰化物在植物原料中以氰苷配糖体的形式存在[3-4]。氰化物是一种剧毒物质,其可通过呼吸道或消化道进入人体与线粒体内氧化型细胞色素氧化酶中的三价铁结合,阻止氧化酶中的三价铁还原,从而妨碍细胞正常呼吸,使机体缺氧死亡[5-6]。我国规定原粮中氰化物含量应<5 mg/kg(以HCN计)[7]。虽然氰化物在粮食中的含量较低,但若大量摄入和积累,仍有对人体造成巨大危害的风险。同时,原料中的氰化物也是白酒中氨基甲酸乙酯的前体物质[8],控制白酒中氨基甲酸乙酯的含量也是白酒品质的关键指标[9]。因此,建立一种准确、快速、灵敏的酿酒原料中氰化物含量的检测方法对控制粮食及白酒酿造品质具有重要的意义。而对低氰化物酿酒原料的筛选和使用也是降低成品白酒中氨基甲酸乙酯(ethyl carbamate,EC)的根本途径。
目前,氰化物的检测方法主要有国标中的苦味酸试纸法、比色法、滴定法,还有适用于白酒中氰化物检测的异烟酸-吡唑啉酮法、异烟酸-巴比妥酸法、吡啶-巴比妥酸等光度法,顶空气相色谱法,电化学法及容量法等[10-13]。但上述方法操作繁琐、费时。国标法的检出限为0.15 mg/kg[14]并不能满足高精度的检测要求,也无法检测酿酒原料中低含量的氰化物[15]。如果利用适用于白酒中氰化物的检测方法[16]来检测酿酒原料中的氰化物含量,样品前处理方法的不当会导致粮食中残留氰化物损失而无法得到可信度结果,达不到筛选低含量氰化物酿酒原料的目的。因此,找到一种适用于酿酒原料中氰化物含量的检测方法迫在眉睫。
本实验利用氯胺T对主要的酿酒原料-高粱进行前处理,将酿酒原料中的游离态氰化物衍生为氯化氰,再通过顶空进样器自动进样和气相色谱分析,实现对不同品种高粱中氰化物含量的检测。研究中也对平衡温度、反应时间、反应溶液pH值等反应条件进行了优化,以期得到最适合的实验反应参数。
1 材料与方法
1.1材料与试剂
10个高粱品种:中国食品发酵工业研究院收集提供。
氰化钾标准储备液、硝酸银标准储备液、NaOH、硝酸铅、碘化钾、氨水:国药集团化学试剂有限公司;磷酸盐缓冲液(pH 7.0):称取34.0 g无水磷酸二氢钾和35.5 g磷酸二氢钠加水溶解稀释至1 000 mL;氯胺T溶液:称取1.0 g氯胺T(有效含量>11%)溶于100 mL水中,临用时现配。所有试剂均为分析纯。
1.2仪器与设备
Agilent 6890气相色谱仪、HP-5毛细管柱(5%苯基聚硅氧烷涂层,30m×320μm×0.25μm):美国Agilent公司;AM Combi PAL顶空进样器:法国Alpha M.O.S公司;FW100高速万能粉碎机:上海科恒实业发展有限公司;KQ-100DE型数控超声波清洗器:昆山市超声仪器有限公司;ST180-A苏格电磁炉:广东省中山市苏格电器有限公司;AL204电子天平:瑞士METTLER TOLEDO公司;PHS-3C PH精密酸度计:郑州宝晶电子科技有限公司。
1.3实验方法
1.3.1样品前处理
方法一:称取10个高粱品种样品各5.0 g,使用高速万能粉碎机粉碎。准确称取各样品粉末1.0 g,分别加入至20 mL顶空瓶中。然后向顶空瓶中加入双蒸水10 mL,混匀。将顶空瓶置入超声波清洗机中处理30 min提取高粱中的氰化物,取出顶空瓶,按顺序分别加入配好的磷酸盐缓冲液1 mL及氯胺T溶液0.3 mL,立即用聚四氯乙烯盖密封,混匀。将顶空瓶按样品序号放入进样盘。设置平衡温度为40℃,平衡时间为30 min。
方法二:精确称取10个品种高粱样品各20.0 g,放入500 mL凯氏烧瓶中。向凯氏烧瓶中加水200 mL,密封瓶口,室温浸泡3 h。迅速将凯氏烧瓶与水蒸气蒸馏装置连接,使冷凝管下端置于盛有20 mL的0.5 g/L氢氧化钠溶液的锥形瓶中,通水蒸气进行蒸馏,收集200 mL蒸馏液。混匀后,用移液器吸取10 mL蒸馏液。同方法一,分别加入磷酸盐缓冲液及氯胺T密封反应,置入进样盘。
方法三:按照国标GB/T 13084—2006《饲料中氰化物的测定》。
以上方法每个样品各重复3次实验。
1.3.2标液配制
用50 mg/L氰化钾标准储备液和0.1 mol/L氢氧化钠溶剂配制10 mg/L的氰化钾标准工作液。分别取0、1 mL、2 mL、5 mL、10 mL氰化钾标准工作液加入到5个10 mL顶空瓶中,加双蒸水定容至10mL,混匀。此时,5个标样中氰化钾含量分别为0、10μg/mL、20μg/mL、50μg/mL、100μg/mL。之后按方法一样品处理方法操作,通过峰面积与氰化钾质量浓度的关系绘制标准曲线。
1.3.3色谱条件
顶空条件:平衡温度40℃,振摇30 min,进样针温度70℃,充样速度500 μL/s,进样速度500 μL/s,进样后氮气冲洗进样针2 min。
检测条件:柱温升温程序为初始温度50℃,以3℃/min升温至80℃,再以20℃/min升温至200℃。进样口温度130℃,检测器温度260℃;进样量1 000 μL,不分流进样;流速1.0 mL/min;N2尾吹气:30 mL/min。
2 结果与分析
2.1线性范围与检出限
以5个氰化钾标液的含量(x)为横坐标,峰面积(y)为纵坐标绘制标准曲线,见图1。结果表明,标准曲线在0~10 μg/g范围内线性关系良好,得到回归方程y=129.35x+5.498 2,回归系数R2=0.998 5。以信噪比S/N=3计算氰化物的检出限为0.11 μg/g。
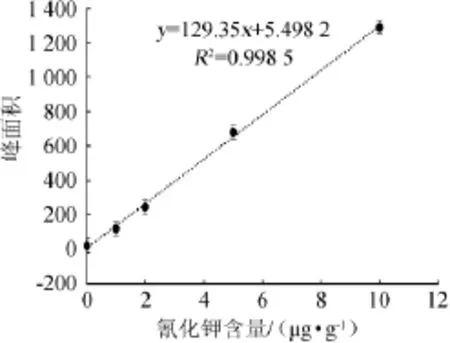
图1 氰化钾标准曲线Fig.1 Standard curve of potassium cyanide
2.2色谱条件优化
经过对不同柱箱温度、载气流量等色谱条件的优化[17],确定了最佳色谱条件,氰化钾的保留时间为2.07 min,色谱图见图2。

图2 氰化钾衍生物色谱图Fig.2 Chromatogram of potassium cyanide derivative
2.3实验条件优化
2.3.1前处理方式优化
根据国标中氰化物含量检测方法及前期的研究,样品的前处理有蒸馏、振荡、超声三种方式[18]。根据前期实验研究,得出蒸馏的前处理方式并不适宜,因为蒸馏会导致氰化物含量有损失。为了选取最适当的氰化物提取方式,分别向2号样品中加入等量的5 μg/mL的氰化物标液,分别使用振荡和超声的方法进行氰化物提取,提取时间分别为10 min、20 min、30 min、40 min、50 min、60 min、70 min,结果见图3。由图3可知,当使用超声前处理方式时,在提取时间为30 min时,峰面积达到最高值。而使用振荡前处理,需要振荡50 min才能达到最高值。因此,最后确定使用超声的样品前处理方式,超声提取30 min为最适宜的样品前处理条件。
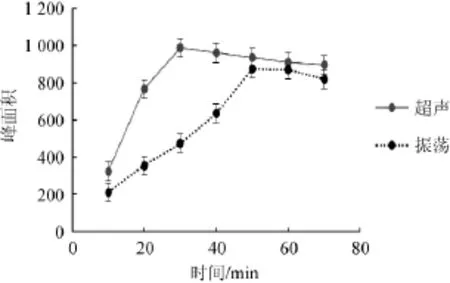
图3 不同前处理方式对响应值的影响Fig.3 Effects of different pretreatment methods on response values
2.3.2平衡反应pH值选择
平衡反应溶液的pH值会在一定程度上影响游离态氰化物衍生为氯化氰的量[19]。因此,为了选出最适宜的平衡反应pH值,要进行不同pH条件下的反应实验。向2号样品中加入5 μg/mL的氰化钾标液,之后分别用1 mol/L的盐酸溶液和1 mol/L的氢氧化钠溶液调节pH值分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5的平衡反应溶液,测定其峰面积,结果见图4。由图4可知,当平衡反应pH值为7.0时响应值最高。因此选取pH值为7.0的磷酸盐缓冲液作为平衡反应环境,并保证样品和标液在同一反应条件下进样。

图4 平衡反应溶液pH值对响应值的影响Fig.4 Effects of different equilibrium solution pH on response values
2.3.3平衡时间和平衡温度的选择
一般顶空平衡温度应高于被测物质的沸点,而小于样品溶剂的沸点[20]。而衍生产物氯化氰的沸点为13.8℃,样品溶剂水的沸点为100℃。因此,为了不使氯化氰过热分解[21],且又要保证反应完全,因此选取30℃、40℃、50℃三个平衡温度在同样的平衡时间内进行实验,并测定其峰面积,结果见图5。

图5 不同平衡温度对响应值的影响Fig.5 Effects of different equilibrium temperature on response values
由图5可知,根据响应值及保证检测灵敏度的前提下,选择40℃作为顶空平衡温度,相对标准偏差(relative standard deviation,RSD)(n=5)为4.2%,符合检测灵敏度及重复性要求。
平衡时间取决于反应溶液达到气液平衡的时间[22],一般通过顶空时间和顶空气体浓度曲线确定[23]。选取20 min、30 min、40 min、50 min作为反应时间分别进行平衡反应,并测定其峰面积,结果见图6。
由图6可知,30 min时已经达到气液平衡状态,为了避免顶空时间过长引起顶空瓶气密性变差而导致定量准确性的降低,提高实验精确度,因此选择30 min作为平衡时间,RSD(n=5)为4.2%,符合检测灵敏度及重复性要求。
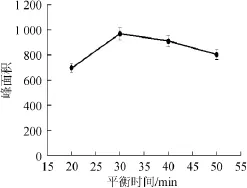
图6 不同平衡时间对响应值的影响Fig.6 Effects of different equilibrium time on response values
2.4检测结果分析
利用上述三种实验方法分别检测10个高粱品种的氰化物含量,检测结果见表1(表中的检测结果为3个重复实验结果的平均值)。实验结果表明,不同品种的高粱样品中氰化物含量差异较大(0.119~2.060 μg/g)。分析比较检测结果后发现,三种检测方法对同一高粱品种中氰化物含量检测结果是有差异的,但对不同品种高粱测量得到氰化物含量变化趋势是一致的。因此,实验结果的差异是由于不同的检测方法造成的,而不同高粱品种氰化物含量的差异表明筛选氰化物含量较低的粮食品种具有可行性。方法二和方法三的样品前处理方式中都存在蒸馏的过程,根据KOLB B等[24]的研究结果,粮食在蒸馏的过程中氰化物的含量会有损失并造成实验结果的偏差。此外,对于相同的高粱样品,方法一的检测结果要高于方法二和方法三。由此可以确定,方法一是高粱样品前处理的最适宜方法。对于国标法并未检出2号、3号和9号样品利用顶空气相色谱法则分别检出了其中的氰化物。这也证明了利用气相色谱法进行粮食中氰化物含量检测,最低检出限更低,方法更加灵敏可靠。

表1 氰化物含量检测结果Table 1 Detection results of cyanide contentsμg/g
2.5精密度与加标回收率
以2号高粱样品为原始样品,分别向其中添加0、2 μg/g、5 μg/g的氰化钾标液,按照方法一测定其精密度和回收率,每个样品做5次重复实验,实验结果见表2。

表2 试验精密度与加标回收率(n=5)Table 2 Precision and recovery rate of the experiment(n=5)
由表2可知,平均回收率为95.8%,3种样品的RSD值分别为3.7%、4.7%和6.3%,符合检测方法标准。
3 结论
本研究建立了一种使用于粮食的、准确、快速的氰化物含量检测方法。不同于往常的氰化物含量检测方法,本方法既从样品前处理方面改进了实验方法,消除了蒸馏前处理造成的氰化物含量损失,又将顶空气相色谱法引入氰化物含量检测,使氰化物最低检出限降低,提高了实验的精确性。在确定实验方法的同时,也对实验过程中的色谱条件、反应pH值、平衡温度、平衡时间等反应参数进行了优化,使实验步骤更趋于准确与合理。该检测方法在氰化钾含量0~10 μg/g的线性范围内回归系数R2=0.998 5,平均回收率为95.8%,相对标准偏差值为4.2%(n=5),检出限为0.11 μg/g(S/N=3)。本研究结果首次证实了不同品种的高粱中氰化物含量存在明显差异因而具有可筛选性,从原料上切断成品白酒中EC产生的根源。
作为重要的酿酒原料,如何筛选更加优质、安全的粮食是酿酒企业不可忽视的重要课题。本研究为其他粮食中氰化物含量的检测提供了方法与依据,同时也为将来更广泛和全面的低含量氰化物粮食品种筛选提供理论基础和方法上的参考。
[1]刘绪,张磊,刘念,等.不同原料酿造小曲酒的工艺技术研究[J].食品与发酵科技,2012,48(4):85-91.
[2]刘茂柯,唐玉明,任道群,等.酿酒高粱籽粒酿造性能的比较[J].中国酿造,2012,31(11):111-114.
[3]CURTIS A J,GRAYLESS C C,FALL R.Simultaneous determination of cyanide and carbonyls in cyanogenic plants by gas chromatographyelectron capture/photoionization detection[J].Analyst,2002,127(11): 1446-1449.
[4]熊丽娜,陆柏益.农产品中生氰糖苷安全性及减控技术研究进展[J].中国食品学报,2014,14(2):208-16.
[5]杜岩,姜晓佳.氰化物的中毒及其检验[J].微量元素与健康研究,2013,30(5):67-68.
[6]徐虹,宋寅生,曹文婷,等.氰化物中毒应急检测方法的研究[J].中国卫生检验杂志,2015,27(11):1705-1707.
[7]郭忠,张文德.食品中的氰化物来源及其安全性的研究进展[J].中国食品卫生杂志,2014,26(4):404-408.
[8]MACKENZIE W,CLYNE A,MACDONALD L.Ethyl carbamate formation in grain based spirits:part II the identification and determination of cyanide related species involved in ethyl carbamate formation in scotch grain whisky[J].J Inst Brew,1990,96(4):223-232.
[9]高年发,宝菊花.氨基甲酸乙酯的研究进展[J].中国酿造,2006,25(9):1-4.
[10]张娅,李春江,王茜.异烟酸-硫代巴比妥酸显色反应测定酒中氰化物的研究[J].中国酿造,2013,32(12):138-140.
[11]吴小松,曹玉发,姜雪,等.白酒中氰化物含量测定及其不确定度评定[J].中国酿造,2013,32(5):82-85.
[12]杨惠芬,李明元,沈文.食品卫生理化检验标准手册[M].北京:中国标准出版社,1997:601.
[13]孟凡昌,李升宪,赵丕虹.极谱络合物吸附波催化波[M].武汉:武汉大学出版社,2001:210.
[14]全国饲料工业标准化技术委员会.GB/T 13084—2006,饲料中氰化物的测定[S].北京:中国标准出版社,2006.
[15]段彬伍,谢黎虹,徐霞,等.植物性食品中氰化物的测定[J].食品与发酵工业,2009,35(5):167-169.
[16]姜汉硕,赵婉婧,蒋莹.连续流动注射分析法测定白酒中氰化物[J].中国食品卫生杂志,2016,28(4):476-479.
[17]SHIN D J,SUNG W,KIM I K.Simple SNR estimation methods for QPSK modulated short bursts;proceedings of the Global Telecommunications Conference,2001 GLOBECOM'01 IEEE,F,2001[C].IEEE.
[18]张顺荣,范文来,徐岩.不同香型白酒中氨基甲酸乙酯的研究与风险评估[J].食品与发酵工业,2016,42(5):198-202.
[19]AYLOTT R,COCHRANE G,LEONARD M J,et al.Ethyl Carbamate Formation IN Grain Based Spirits:Part I:Post-distillation ethyl carbamate formation in maturing grain whisky[J].J Inst Brew,1990, 96(4):213-221.
[20]严矿林,林丽琼,郑夏汐,等.样品前处理技术在气相色谱分析中的应用进展[J].色谱,2013,31(7):634-639.
[21]朱震海,蔡嵘,宣栋樑.顶空温度和平衡时间对顶空气相色谱法测定水中卤代烃结果的影响[J].中国卫生检验杂志,2015,27(6):797-800.
[22]王同蕾,王丽荣,田海燕.饮用水中氰化物的检测和处理技术[J].中国卫生检验杂志,2008,20(4):732-733.
[23]张营,李法云,范志平,等.气相色谱法测定水中苯系物气液平衡条件研究[J].安徽农业科学,2008,36(6):2174-2175,2198.
[24]KOLB B,ETTRE L S.Static headspace-gas chromatography:theory and practice[M].John Wiley&Sons,2006.
Screening of liquor-making raw materials with low cyanide content by headspace gas chromatography
LIU Shiyu1,2,WU Youru1,2,FU Yue1,LI Lianwei1,JIANG Wei2,3,WANG Deliang2,3,CHEN Bin2,HUANG Shihai1,LUAN Chunguang2,3*
(1.College of Life Science and Technology,Guangxi University,Nanning 530005,China; 2.Department of Brewing Engineering,China National Research Institute of Food&Fermentation Industries,Beijing 100015,China; 3.United Research Center of Alcohol Quality&Safety,Beijing 100015,China)
Using chloramine T as derivating agent,cyanogen chloride was derived from cyanide,the cyanide content in diverse sorghum varieties was determined by headspace gas chromatography and the cyanide determination method was established.The results showed that the regression coefficientR2was 0.998 5,the average recovery rate was 95.8%,the relative standard RSD of the method was 4.2%(n=5),the detection limit was 0.11 μg/g (S/N=3),and the method were all in the linear range of 0-10 μg/g.By comparing the experimental results,it validated that common distillation pre-procession can cause the loss of cyanide content and it also found there was a significant difference in cyanide content of different sorghum varieties,which proved that sorghum varieties with low cyanide content can be screened.The cyanide content in grain can be detected accurately,quickly and sensitively,providing technical support for the quality assurance of liquor-making raw materials.
cyanide;headspace gas chromatography;grain;liquor-making raw materials
TS261.2
0254-5071(2016)10-0157-05
10.11882/j.issn.0254-5071.2016.10.035
2016-06-21
国家高技术研究发展计划‘863计划’(2013AA102108)
刘诗宇(1990-),男,硕士研究生,研究方向为发酵工程。
栾春光(1974-),男,高级工程师,博士,研究方向为酿酒技术。

